2016-2017学年辽宁省辽师大附中高三上学期期中化学试卷
试卷更新日期:2017-03-16 类型:期中考试
一、选择题
-
1. 下列说法不正确的是( )A、硅胶作袋装食品的干燥剂没有发生化学变化 B、碳纤维是一种新开发的材料,它属于合成有机高分子化合物 C、Al2O3用作耐火材料,Al(OH)3用作阻燃剂 D、小苏打是治疗胃酸过多的一种药剂2. 下列描述正确的是( )A、氯水的标签上应标注:
 B、O2﹣的结构示意图:
B、O2﹣的结构示意图: 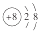 C、乙烯的结构简式:CH2CH2
D、BeCl2的电子式:
C、乙烯的结构简式:CH2CH2
D、BeCl2的电子式: 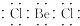 3. 分类是化学学习与研究的常用方法,下列分类正确的是( )A、Na2O2、MgO、Al2O3均属于碱性氧化物 B、纯碱、烧碱、熟石灰均属于碱 C、酸、碱、盐之间发生的反应均属于复分解反应 D、
3. 分类是化学学习与研究的常用方法,下列分类正确的是( )A、Na2O2、MgO、Al2O3均属于碱性氧化物 B、纯碱、烧碱、熟石灰均属于碱 C、酸、碱、盐之间发生的反应均属于复分解反应 D、 混合物、分散系、胶体从属关系如图所示
4. 用下列实验装置进行相应实验,能达到实验目的是( )
混合物、分散系、胶体从属关系如图所示
4. 用下列实验装置进行相应实验,能达到实验目的是( )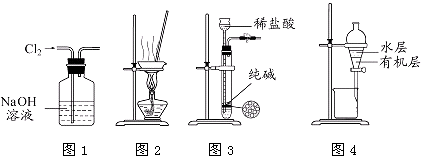 A、用图1所示装置除去Cl2中含有的少量HCl B、用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 C、用图3所示装置制取少量纯净的CO2气体 D、用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层5. 下列有关热化学方程式的叙述正确的是( )A、已知甲烷的燃烧热为890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═2CO2(g)+2H2O(g)△H=﹣890.3 kJ/mol B、已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 C、已知中和热为△H=﹣57.3 kJ/mol,则1mol稀硫酸和足量稀NaOH溶液反应的反应热就是中和热 D、已知S(g)+O2(g)═SO2(g)△H1;S(s)+O2(g)═SO2(g)△H2 , 则△H1<△H26. 下列叙述正确的是( )
A、用图1所示装置除去Cl2中含有的少量HCl B、用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 C、用图3所示装置制取少量纯净的CO2气体 D、用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层5. 下列有关热化学方程式的叙述正确的是( )A、已知甲烷的燃烧热为890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═2CO2(g)+2H2O(g)△H=﹣890.3 kJ/mol B、已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 C、已知中和热为△H=﹣57.3 kJ/mol,则1mol稀硫酸和足量稀NaOH溶液反应的反应热就是中和热 D、已知S(g)+O2(g)═SO2(g)△H1;S(s)+O2(g)═SO2(g)△H2 , 则△H1<△H26. 下列叙述正确的是( ) A、Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如图一所示,石墨电极上产生氢气,铜电极发生氧化反应 B、图一所示当有0.1mol电子转移时,有0.1mol Cu2O生成 C、图二装置中发生:Cu+2Fe3+═Cu2++2Fe2+ , X极是负极,Y极材料可以是铜 D、如图二,盐桥的作用是传递电荷以维持电荷平衡,Fe3+经过盐桥进入左侧烧杯中
A、Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如图一所示,石墨电极上产生氢气,铜电极发生氧化反应 B、图一所示当有0.1mol电子转移时,有0.1mol Cu2O生成 C、图二装置中发生:Cu+2Fe3+═Cu2++2Fe2+ , X极是负极,Y极材料可以是铜 D、如图二,盐桥的作用是传递电荷以维持电荷平衡,Fe3+经过盐桥进入左侧烧杯中二、选择题
-
7. 下列各组物质的分类正确的是( )
①混合物:氯水、氨水、水玻璃、水银、福尔马林、聚乙烯
②电解质:明矾、冰醋酸、石膏、纯碱
③CO2、NO2、P2O5均为酸性氧化物,Na2O、Na2O2为碱性氧化物
④同位素:1H+、2H2、3H
⑤同素异形体:C60、C80、金刚石、石墨
⑥同系物:CH2O2、C2H4O2、C3H6O2、C4H8O2
⑦同分异构体:乙二酸二乙酯、乙二酸乙二酯
⑧根据酸分子中含有的H原子个数将酸分为一元酸、二元酸、多元酸
⑨在熔化状态下能导电的化合物为离子化合物.
A、②⑤⑨ B、①②⑤⑦⑨ C、②④⑤⑥⑦⑨ D、全部正确8. 下列溶液中能大量共存的微粒的是( )A、无色溶液中可能大量存在:Al3+、NH4+、S2﹣、Cl﹣ B、酸性溶液中可能大量存在:I﹣、ClO﹣、SO42﹣、Na+ C、中性溶液中可能大量存在:SO42﹣、K+、Fe3+、Cl﹣ D、弱碱性溶液中可能大量存在:Na+、K+、Cl﹣、HCO3﹣9. 下列反应的离子方程式正确的是( )A、用石墨作电极电解AlCl3溶液:2Cl﹣+2H2O Cl2↑+H2↑+2OH﹣ B、酸性高锰酸钾溶液与H2O2溶液混合:2MnO4﹣+3H2O2+6H+═2Mn2++4 O2↑+6H2O C、向NaHSO4溶液中滴加Ba(OH)2溶液至不再产生沉淀:Ba2++OH﹣+H++SO42﹣═BaSO4↓+H2O D、向Fe(NO3)2和NaBr混合溶液中滴加稀盐酸:6Br ﹣+2NO3﹣+8H+═3Br2+2NO↑+4H2O10. 阿伏加德罗常数用NA表示,下列叙述正确的是( )①22gT2O含有电子数为10NA
②0.44gC3H8中含有的σ键总数目为0.1NA
③1mol Na2O2与CO2完全反应时转移电子数为2NA
④28g 硅晶体中含有2NA个Si﹣Si键
⑤11.2LCl2通入足量氢氧化钠溶液中充分反应,转移的电子数等于0.5NA
⑥200mL,1mol/L Al2(SO4)3溶液中,Al3+和SO42﹣离子数的总和是NA
⑦在常温常压下,0.1mol铁与0.1mol Cl2充分反应,转移的电子数为0.3NA
⑧O2和O3的混合物共6.4g,其中所含原子数一定为0.4NA .
A、①②③⑤⑧ B、②④⑥⑦⑧ C、①③⑤⑥⑦ D、①②④⑧11. 将一定量的氯气通入300mL浓度为1mol/L的浓NaOH溶液中恰好完全反应,加热少许时间后溶液中形成NaCl、NaClO及NaClO3的共存体系.下列判断不正确的是( )A、n(Na+):n(Cl﹣)可能为7:3 B、n(NaCl):n(NaClO):n(NaClO3)可能为11:1:2 C、参加反应氯气物质的量为0.15mol D、反应中转移电子物质的量n的范围:0.15mol<n<0.25mol12. 三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42﹣可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室.下列叙述正确的是( )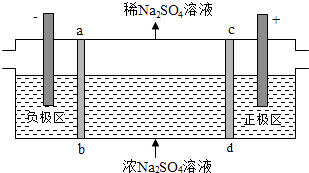 A、通电后中间隔室的SO42﹣离子向正极迁移,正极区溶液pH增大 B、该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品 C、负极反应为2H2O﹣4e﹣=O2+4H+ , 负极区溶液pH降低 D、当电路中通过1mol电子的电量时,会有0.5mol的O2生成13. 某无色溶液中可能含有①Na+②Ba2+③Cl﹣④Br﹣⑤SO32﹣⑥SO42﹣离子中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下.
A、通电后中间隔室的SO42﹣离子向正极迁移,正极区溶液pH增大 B、该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品 C、负极反应为2H2O﹣4e﹣=O2+4H+ , 负极区溶液pH降低 D、当电路中通过1mol电子的电量时,会有0.5mol的O2生成13. 某无色溶液中可能含有①Na+②Ba2+③Cl﹣④Br﹣⑤SO32﹣⑥SO42﹣离子中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下.步骤操作现象(1)用pH试纸检验溶液的pH大于7;(2)向溶液中滴加氯水,再加入CCl4振荡,静置CCl4层呈橙色;(3)向所得水溶液中加入Ba(NO3)2溶液和稀HNO3有白色沉淀产生;(4)过滤,向滤液中加入AgNO3溶液和稀HNO3有白色沉淀产生.
下列结论正确的是( )
A、肯定含有的离子是①④⑤ B、肯定没有的离子是②⑥ C、不能确定的离子是① D、不能确定的离子是③⑤14. 如图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是( )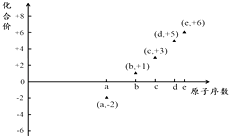 A、31d和33d属于同种核素 B、气态氢化物的稳定性:a>d>e C、工业上常用电解法制备单质b和c D、a和b形成的化合物不可能含共价键15. 三氟化氮(NF3)是一种无色、无味的气体,它是微电子工业技术的关键原料之一,可由氨气和氟气反应得到:4NH3+3F2═NF3+3NH4F.在潮湿的空气中,NF3能与水蒸气发生氧化还原反应,其反应的产物有HF、NO和HNO3 . 下列说法正确的是( )A、制取NF3的反应中,氧化剂与还原剂的物质的量之比为3:1 B、在NF3与H2O的反应中,H2O作还原剂 C、若在制取NF3的反应中有0.5 mol NH3参加反应,转移电子的物质的量为3 mol D、NF3在空气中一旦泄漏,不易于发现16. 我国知名企业比亚迪公司开发了具有多项专利的锂钒氧化物二次电池,其成本较低,对环境无污染,能量密度远远高于其他材料电池,电池总反应为V2O5+xLi LixV2O5 . 下列说法中正确的是( )A、电池在放电时,Li+向负极移动 B、锂在放电时做正极,充电时为阳极 C、该电池充电时阳极的反应为LixV2O5﹣xe﹣═V2O5+xLi+ D、V2O5只是锂发生反应的载体,不参与电池反应17. 在某稀硝酸的溶液中,加入5.6g铁粉充分反应后,铁粉全部溶解,放出NO气体,溶液质量增加3.2g,所得溶液中Fe2+和Fe3+物质的量之比为( )A、1:1 B、2:1 C、3:2 D、4:118. 电解100mL含c(H+)=0.3mol/L的下列溶液,当电路中通过0.04mol电子时,理论上析出金属质量最大的是( )A、0.10mol∕L Ag+ B、0.20mol∕L Cu2+ C、0.20mol∕L Zn2+ D、0.20mol∕LPb2+
A、31d和33d属于同种核素 B、气态氢化物的稳定性:a>d>e C、工业上常用电解法制备单质b和c D、a和b形成的化合物不可能含共价键15. 三氟化氮(NF3)是一种无色、无味的气体,它是微电子工业技术的关键原料之一,可由氨气和氟气反应得到:4NH3+3F2═NF3+3NH4F.在潮湿的空气中,NF3能与水蒸气发生氧化还原反应,其反应的产物有HF、NO和HNO3 . 下列说法正确的是( )A、制取NF3的反应中,氧化剂与还原剂的物质的量之比为3:1 B、在NF3与H2O的反应中,H2O作还原剂 C、若在制取NF3的反应中有0.5 mol NH3参加反应,转移电子的物质的量为3 mol D、NF3在空气中一旦泄漏,不易于发现16. 我国知名企业比亚迪公司开发了具有多项专利的锂钒氧化物二次电池,其成本较低,对环境无污染,能量密度远远高于其他材料电池,电池总反应为V2O5+xLi LixV2O5 . 下列说法中正确的是( )A、电池在放电时,Li+向负极移动 B、锂在放电时做正极,充电时为阳极 C、该电池充电时阳极的反应为LixV2O5﹣xe﹣═V2O5+xLi+ D、V2O5只是锂发生反应的载体,不参与电池反应17. 在某稀硝酸的溶液中,加入5.6g铁粉充分反应后,铁粉全部溶解,放出NO气体,溶液质量增加3.2g,所得溶液中Fe2+和Fe3+物质的量之比为( )A、1:1 B、2:1 C、3:2 D、4:118. 电解100mL含c(H+)=0.3mol/L的下列溶液,当电路中通过0.04mol电子时,理论上析出金属质量最大的是( )A、0.10mol∕L Ag+ B、0.20mol∕L Cu2+ C、0.20mol∕L Zn2+ D、0.20mol∕LPb2+三、填空题:
-
19. 工业上制取冰晶石(Na3AlF6)的化学方程式如下:2Al(OH)3+12HF+3Na2CO3=2Na3AlF6+3CO2↑+9H2O
根据题意完成下列填空:
(1)、在上述反应的反应物和生成物中,属于非极性分子的电子式 ,属于弱酸的电离方程式
(2)、反应物中有两种元素在元素周期表中位置相邻,下列能判断它们的金属性或非金属性强弱的是(选填编号).a.气态氢化物的稳定性 b.最高价氧化物对应水化物的酸性
c.单质与氢气反应的难易 d.单质与同浓度酸发生反应的快慢.
20. X,Y,Z,W为原子序数依次增大的四种短周期主族元素,X的最外层电子数比内层电子数多1,Y是短周期元素中金属性最强的元素,Z的最外层电子数与次外层电子数之比为3:4.(1)、Z元素在周期表中的位置;W的最高价氧化物对应水化物的化学式为(2)、隔绝空气加热,Y单质可与X的氧化物反应制备X单质,该反应的化学方程式为(3)、0.2mol 化合物Z2W2与水反应转移电子的物质的量为0.3mol,生成一种能使品红褪色的气体,该反应过程中只有一种元素化合价发生变化,该反应的化学方程式 .21. MnO2是一种重要的催化剂.某研究性学习小组设计了将粗MnO2(含有较多的 MnO和MnCO3)样品转化为纯MnO2的实验,其流程如下: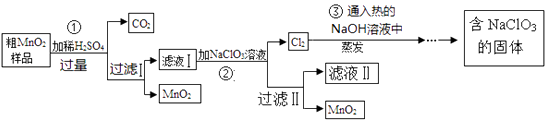 (1)、检验操作A所得的MnO2是否洗涤干净的方法是 .(2)、第②步反应的离子反应方程式为 .(3)、第③步蒸发操作必需的仪器有铁架台(含铁圈)、、、玻璃棒.(4)、上述流程中可用于循环使用的物质是(填化学式).(5)、MnO2不仅可作催化剂还可作氧化剂,写出1个用二氧化锰作氧化剂的化学反应方程式 .(6)、若粗MnO2样品的质量为24.28g,第①步反应后,经过滤得到18.35g MnO2 , 并收集到0.672LCO2(标准状况下),则样品中所含的MnO质量为 g.22. 工业上常通过高温分解FeSO4的方法制备Fe2O3 , 为检验FeSO4高温分解的产物,并进行有关探究实验,回答下列问题:
(1)、检验操作A所得的MnO2是否洗涤干净的方法是 .(2)、第②步反应的离子反应方程式为 .(3)、第③步蒸发操作必需的仪器有铁架台(含铁圈)、、、玻璃棒.(4)、上述流程中可用于循环使用的物质是(填化学式).(5)、MnO2不仅可作催化剂还可作氧化剂,写出1个用二氧化锰作氧化剂的化学反应方程式 .(6)、若粗MnO2样品的质量为24.28g,第①步反应后,经过滤得到18.35g MnO2 , 并收集到0.672LCO2(标准状况下),则样品中所含的MnO质量为 g.22. 工业上常通过高温分解FeSO4的方法制备Fe2O3 , 为检验FeSO4高温分解的产物,并进行有关探究实验,回答下列问题:实验一:高温分解FeSO4 , 利用如图1所示的实验装置进行实验.
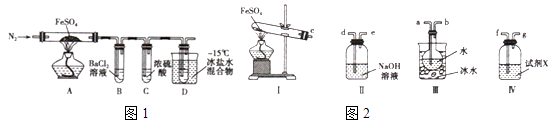
已知:①SO2熔点为﹣72℃,沸点为﹣10℃②SO3熔点为﹣16.8℃,沸点为44.8℃
(1)、连接装置,检验气密性良好,放入药品,通入一段时间N2然后加热,通入N2的目的是(2)、隔绝空气加热至650℃,看到B中有白色沉淀,D试管中有无色液体,硬质玻璃管中的固体变为 , 同时有两种无色气体生成,写出该反应的化学方程式(3)、反应完毕后,停止加热冷却后,取硬质玻璃管中固体,加盐酸,反应的离子方程式是 , 将反应后所得溶液滴入D试管中,溶液变为浅绿色,该反应的离子方程式是(4)、有人认为该实验装置存在一定的缺陷,再增加一个装置即可弥补该缺陷,请指出添加的仪器位置及药品 .实验二 探究高温分解 FeSO4生成的气体
(5)、用如图2所示装置设计实验,验证高温分解FeSO4生成的气态物质①按气流方向连接各仪器,用字母表示接口的连接顺序:c﹣
②试剂X的名称是
③充分反应后,利用装置 III中圆底烧瓶内混合物测定已分解的FeSO4 的质量,向圆底烧瓶中逐渐滴入氯化钡溶液,直到沉淀完全;然后过滤混合物,在过滤器上将沉淀洗净后,烘干并冷却至室温,称重.若最终得到沉淀的质量为Wg,则已分解的FeSO4的质量 g.
23. 开发新能源是解决环境污染的重要举措,其中甲醇、甲烷是优质的清洁燃料,可制作燃料电池.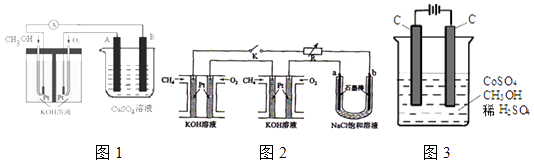 (1)、已知:
(1)、已知:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1=﹣1274.0kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2=﹣566.0kJ/mol ③H2O(g)=H2O(l)△H3=﹣44kJ/mol. 甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为: .
(2)、可利用甲醇燃烧反应设计一个燃料电池.如图1,用Pt作电极材料,用氢氧化钾溶液作电解质溶液,在两个电极上分别充入甲醇和氧气.①写出燃料电池负极的电极反应式 .
②若利用该燃料电池提供电源,与图2右边烧杯相连,在铁件表面镀铜,则铁件应是极(填”A”或”B”);当铁件的质量增重6.4g时,燃料电池中消耗氧气的标准状况下体积为 L.
(3)、某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验若每个电池甲烷通入量为1L(标准状况),且反应完全,则理论上通过电解池的电量为(法拉第常数F=9.65×104C/mol),最多能产生的氯气体积为 L(标准状况).(4)、电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+ , 然后将甲醇氧化成CO2和H+(用石墨烯除去Co2+)现用如图3所示装置模拟上述过程,则Co2+在阳极的电极反应式为除去甲醇的离子方程式为 .