2017年山东省泰安市肥城市中考化学三模试卷
试卷更新日期:2017-03-14 类型:中考模拟
一、选择题
-
1. 下列过程中没有发生化学变化的是( )A、用食醋除去水壶内的水垢 B、风力发电 C、煤分解得到煤焦油等 D、炸药爆炸开山修路2. 如图为空气成分示意图(按体积计算),其中“a”代表的是( )
 A、氧气 B、氮气 C、二氧化碳 D、稀有气体3.
A、氧气 B、氮气 C、二氧化碳 D、稀有气体3.学校食堂提供了下列5种食物:

小亮为自己安排的午餐食谱中,较合理的是( )
A、①②③ B、①④⑤ C、①③⑤ D、③④⑤4. 如图所示物品所使用的主要材料属于合金的是( )A、 橡胶轮胎
B、
橡胶轮胎
B、 木雕作品
C、
木雕作品
C、 艺术瓷瓶
D、
艺术瓷瓶
D、 青铜摆件
5. 将一根洁净的铁钉放入稀硫酸中,下列预测可能不正确的是( )A、铁钉表面将产生气泡 B、铁钉表面将很快出现铁锈 C、溶液由无色变为浅绿色 D、溶液质量将增加6. 下列有关化学用语中数字“2”的意义的说法,错误的是( )
青铜摆件
5. 将一根洁净的铁钉放入稀硫酸中,下列预测可能不正确的是( )A、铁钉表面将产生气泡 B、铁钉表面将很快出现铁锈 C、溶液由无色变为浅绿色 D、溶液质量将增加6. 下列有关化学用语中数字“2”的意义的说法,错误的是( )①2HCl ②Mg2+③CO2④ ⑤O2﹣⑥H2O2 .
A、表示分子个数的是① B、表示离子所带电荷数的是②⑤ C、表示化合价数值的是④ D、表示一个分子中含有某种原子个数的是①③⑥7. 如图是钠元素和氯元素在元素周期表中的信息和有关的4种粒子结构示意图,下列说法正确的是( )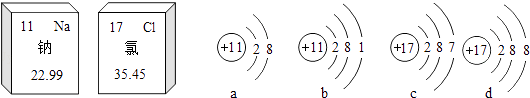 A、钠、氯都属于金属元素 B、氯化钠是由a,d两种粒子构成的 C、氯的相对原子质量是35.45g D、a表示的是一种阴离子8. 如图实验操作或说法中,不正确的是( )A、
A、钠、氯都属于金属元素 B、氯化钠是由a,d两种粒子构成的 C、氯的相对原子质量是35.45g D、a表示的是一种阴离子8. 如图实验操作或说法中,不正确的是( )A、 可用于分离二氧化锰和水
B、
可用于分离二氧化锰和水
B、 说明该装置气密性良好
C、
说明该装置气密性良好
C、 可用于做反应容器
D、
可用于做反应容器
D、 滴管用毕即插回
9. 农作物缺磷时会引起生长迟缓、产量降低,必须施用适量磷肥.过磷酸钙[Ca(H2PO4)2和CaSO4的混合物]是常用的磷肥.其中磷的化合价为( )A、+2 B、+3 C、+4 D、+510. 下列对课本中的原理、图表、数据的使用,叙述不正确的是( )A、根据质量守恒定律,可确定参加反应的各物质的质量比 B、根据“酸、碱和盐溶解性表”,可以帮助判断复分解反应能否发生 C、根据金属活动性顺序,可以判断金属能否与稀盐酸、稀硫酸发生置换反应 D、根据物质溶解度曲线图,可确定该物质在某一温度时溶液中溶质与溶剂的质量关系11. 第31届夏季奥林匹克运动会,将于2016年8月5日﹣21日在巴西的里约热内卢举行,采集圣火的方式是在赫拉神庙前利用凹面镜几种阳光来引燃火种,下列说法不正确的是( )A、阳光为火种的燃烧提供了热量,使其达到着火点 B、火炬燃烧时,化学能转化为热能和光能 C、强风和大雨下火炬仍可以保持燃烧,是因为火炬燃烧的不受燃烧的条件影响 D、火炬内装的燃料丙烷(C3H8)属于化合物12. “超临界水”是指当气压和温度达到一定值时,水的液态和气态完全交融在一起的液体,下面有关“超临界水”的说法正确的是( )A、它是混合物 B、它的化学式为H4O2 C、它的分子之间有间隔 D、它的性质和水完全不同13. 比较、推理是化学学习常用的方法,以下是根据一些反应事实推导出的影响化学反应的因素,其中推理不合理的是( )
滴管用毕即插回
9. 农作物缺磷时会引起生长迟缓、产量降低,必须施用适量磷肥.过磷酸钙[Ca(H2PO4)2和CaSO4的混合物]是常用的磷肥.其中磷的化合价为( )A、+2 B、+3 C、+4 D、+510. 下列对课本中的原理、图表、数据的使用,叙述不正确的是( )A、根据质量守恒定律,可确定参加反应的各物质的质量比 B、根据“酸、碱和盐溶解性表”,可以帮助判断复分解反应能否发生 C、根据金属活动性顺序,可以判断金属能否与稀盐酸、稀硫酸发生置换反应 D、根据物质溶解度曲线图,可确定该物质在某一温度时溶液中溶质与溶剂的质量关系11. 第31届夏季奥林匹克运动会,将于2016年8月5日﹣21日在巴西的里约热内卢举行,采集圣火的方式是在赫拉神庙前利用凹面镜几种阳光来引燃火种,下列说法不正确的是( )A、阳光为火种的燃烧提供了热量,使其达到着火点 B、火炬燃烧时,化学能转化为热能和光能 C、强风和大雨下火炬仍可以保持燃烧,是因为火炬燃烧的不受燃烧的条件影响 D、火炬内装的燃料丙烷(C3H8)属于化合物12. “超临界水”是指当气压和温度达到一定值时,水的液态和气态完全交融在一起的液体,下面有关“超临界水”的说法正确的是( )A、它是混合物 B、它的化学式为H4O2 C、它的分子之间有间隔 D、它的性质和水完全不同13. 比较、推理是化学学习常用的方法,以下是根据一些反应事实推导出的影响化学反应的因素,其中推理不合理的是( )序号
化 学 反 应 事 实
影响化学反应的因素
A
铁丝在空气中很难燃烧,而在氧气中能剧烈燃烧
反应物浓度
B
水要在通电的条件才能分解,而双氧水只要加入二氧化锰就迅速分解
催化剂
C
碳在常温下不与氧气发生反应,而在高温时能与氧气反应
反应温度
D
铜片在空气中很难燃烧,钠米铜粉在空气中较易燃烧
反应物的接触面积
A、A B、B C、C D、D14.a、b两种物质的溶解度曲线如图所示,下列说法不正确的是( )
 A、要使接近饱和的b溶液转化为饱和溶液,可采用蒸发溶液的方法 B、t2℃时,两种物质的饱和溶液中溶质质量分数a>b C、将t2℃时a的饱和溶液降温至t1℃,溶液质量不变 D、将t2℃时a、b的饱和溶液分别降温至t1℃,两溶液的溶质质量分数相等15. “绿色化学”是当今社会提出的一个新概念.在“绿色化学工艺”中,理想状态是反应中原子全部转化为欲制得的产物,即原子的利用率为100%.在用C3H4(丙炔)合成C5H8O2(2﹣甲基丙烯酸甲酯)的过程中,欲使原子的利用率达到最高,在催化剂作用下还需要的其他反应物是( )A、CO和CH3OH B、CO2和H2O C、C和C2H3OH D、CH3OH和H216. 氨基钠(NaNH2)是合成维生素A的原料.工业上将钠于97~100℃熔融,向反应容器中缓慢通入无水的液氨(NH3),再加热至350~360℃生成氨基钠和氢气.下列说法中,不正确的是( )A、钠可能与水反应 B、钠的熔点比铁的熔点低 C、维生素A中一定含有钠元素 D、反应的化学方程式为:2Na+2NH3 2NaNH2+H2↑17.
A、要使接近饱和的b溶液转化为饱和溶液,可采用蒸发溶液的方法 B、t2℃时,两种物质的饱和溶液中溶质质量分数a>b C、将t2℃时a的饱和溶液降温至t1℃,溶液质量不变 D、将t2℃时a、b的饱和溶液分别降温至t1℃,两溶液的溶质质量分数相等15. “绿色化学”是当今社会提出的一个新概念.在“绿色化学工艺”中,理想状态是反应中原子全部转化为欲制得的产物,即原子的利用率为100%.在用C3H4(丙炔)合成C5H8O2(2﹣甲基丙烯酸甲酯)的过程中,欲使原子的利用率达到最高,在催化剂作用下还需要的其他反应物是( )A、CO和CH3OH B、CO2和H2O C、C和C2H3OH D、CH3OH和H216. 氨基钠(NaNH2)是合成维生素A的原料.工业上将钠于97~100℃熔融,向反应容器中缓慢通入无水的液氨(NH3),再加热至350~360℃生成氨基钠和氢气.下列说法中,不正确的是( )A、钠可能与水反应 B、钠的熔点比铁的熔点低 C、维生素A中一定含有钠元素 D、反应的化学方程式为:2Na+2NH3 2NaNH2+H2↑17.如表方案不能达到实验目的是( )




证明分子不断运动
除去二氧化碳中含有的一氧化碳
证明锌比铁的金属活动性强
证明黄铜的硬度比纯铜大
A、A B、B C、C D、D18. 煤燃烧产生的废气中含有SO2 , 用NaOH,Na2SO3溶液可将90%以上的SO2吸收、涉及的反应有:①2NaOH+SO2═Na2SO3+H2O ②Na2SO2+SO2+H2O═2NaHSO3③NaHSO3+NaOH═Na2SO3+H2O 下列说法中,不正确的是( )A、NaHSO3属于酸 B、可循环使用的物质是Na2SO3 C、反应②发生的是化合反应 D、反应①说明SO2与CO2有相似的化学性质19.右图所示,某河旁甲、乙、丙、丁四座化工厂排放的工业废水中分别含有碳酸钠、氯化铜、氢氧化钠、盐酸中的一种.某同学对①、②、③、④处水质监测时记录了以下现象.根据现象推断,甲、乙、丙、丁四座化工厂排放工业废水的成分,错误的是( )
①
②
③
④
记录现象
无色溶液
蓝色浑浊
浑浊消失
产生气泡
 A、甲:碳酸钠 B、乙:氯化铜 C、丙:盐酸 D、丁:碳酸钠20.
A、甲:碳酸钠 B、乙:氯化铜 C、丙:盐酸 D、丁:碳酸钠20.如表各选项与如图所示曲线相符的是( )
序号
横坐标
纵坐标
A
向一定量稀硫酸中加入锌粉的质量
溶液中氢元素的质量
B
向一定量的氢氧化钠和碳酸钠混合溶液中加入稀盐酸的质量
产生气体的质量
C
向一定量的澄清石灰水中加入碳酸钠溶液的质量
生成沉淀的质量
D
在一定温度下,向一定量不饱和硝酸钾溶液中加入硝酸钾固体的质量
溶液中溶质的质量分数
 A、A B、B C、C D、D
A、A B、B C、C D、D二、解答题
-
21. 学习化学可以帮助我们解决许多生产生活中的问题.现有四种物质①葡萄糖②碳酸钠③硝酸铵④碳酸钙,请 选择相应的物质回答下列问题(填序号).(1)、用于生产洗涤剂的是;(2)、欲除去氯化钙溶液中含有的少量盐酸,在不用酸碱指示剂的条件下,应加入的试剂是 .(3)、人体主要的供能物质是 .(4)、溶于水后温度降低的物质 .22. “碳循环”是自然界中重要的一类物质转化,CO2在转化中起着非常重要的作用,如图1是这种作用的具体体现之一.
 (1)、自然界中“碳循环”的“碳”是指(选填“单质”“元素”“原子”)(2)、某有机物R在空气中完全燃烧的化学方程式为:R+3O2 2CO2+3H2O,则R的化学式为(3)、煤的燃烧会产生大量CO2 , 通过煤的综合利用可获得多种产品,有很多用途,其中焦炭广泛应用于炼铁,下列说法正确的是(填序号).
(1)、自然界中“碳循环”的“碳”是指(选填“单质”“元素”“原子”)(2)、某有机物R在空气中完全燃烧的化学方程式为:R+3O2 2CO2+3H2O,则R的化学式为(3)、煤的燃烧会产生大量CO2 , 通过煤的综合利用可获得多种产品,有很多用途,其中焦炭广泛应用于炼铁,下列说法正确的是(填序号).a.煤是复杂的混合物,主要含碳元素
b.煤加工成焦炭的变化属于物理变化
c.煤燃烧排放的二氧化硫,二氧化氮是形成酸雨的主要物质.
(4)、科学家用NaOH溶液喷淋吸收CO2(如图2),对该方法的叙述正确的是( ). A、该方法中包含分解反应,置换反应等 B、物质是①是Na2CO3溶液 C、操作①是蒸发浓缩,降温结晶 D、整个过程至少有两种物质可以循环利用.23. 化学是一门研究物质的科学,我们一般从物质的存在、性质、制备、用途等方面研究一种物质或一类物质,以金属为例,请你参与其中回答相关问题.
A、该方法中包含分解反应,置换反应等 B、物质是①是Na2CO3溶液 C、操作①是蒸发浓缩,降温结晶 D、整个过程至少有两种物质可以循环利用.23. 化学是一门研究物质的科学,我们一般从物质的存在、性质、制备、用途等方面研究一种物质或一类物质,以金属为例,请你参与其中回答相关问题. (1)、如图4金属制品中,利用金属的物理性质是(至少两条).(2)、亮亮做家务时接触到一袋脱氧剂(主要成分是还原铁粉),拆开后看到还原铁粉已生锈,铁生锈的原因是 , 废旧钢铁表面的铁锈可用盐酸除去,其原理是(写化学方程式).(3)、利用废旧电池铜帽(含Cu、Zn)制取海绵铜(Cu),并得到硫酸锌溶液,主要流程如图1(反应条件略去).已知:2Cu+2H2SO4+O2 2CuSO4+2H2O
(1)、如图4金属制品中,利用金属的物理性质是(至少两条).(2)、亮亮做家务时接触到一袋脱氧剂(主要成分是还原铁粉),拆开后看到还原铁粉已生锈,铁生锈的原因是 , 废旧钢铁表面的铁锈可用盐酸除去,其原理是(写化学方程式).(3)、利用废旧电池铜帽(含Cu、Zn)制取海绵铜(Cu),并得到硫酸锌溶液,主要流程如图1(反应条件略去).已知:2Cu+2H2SO4+O2 2CuSO4+2H2O①A﹣E中含铜、锌两种元素的物质有(填字母序号).
②我国早在西汉时期,就有“曾青得铁则化为铜”的记述,该反应的化学方程式可表示为
(4)、炼铁产生的废渣中含有大量CuS,及少量铁和铁的化合物,工业上以该废渣为原料生产CuCl2的流程图如图2所示:①在Ⅱ中CuS、NaCl和O2在高温条件下反应生成了CuCl2和Na2SO4 , 其反应的化学方程式是 .
②Ⅲ的操作名称是 , 分离混合物的一般思路,首先分析混合物的组成成分,寻找各成分的差异,然后利用其差异选择合适方法进行分离,该方法就是利用混合物中不同成分差异进行分离的方法.
(5)、等质量的A、B两种金属分别与等质量溶质质量分数的稀盐酸充分反应,反应产生气体的质量与反应时间的关系如图3所示,若A、B为Mg、Zn中的一种,则A是 , 反应结束后只有一种金属剩余,则剩余金属为 .24.如图中A、B、C、D、E是初中化学常见的五种不同类别的物质,E是导致温室效应的一种气体,图中“﹣”表示 相连物质能发生化学反应,“→”表示两种物质间的转化关系(部分反应物及反应条件省略).
 (1)、写出物质E的一种用途;(2)、物质C与E反应的化学方程式是;(3)、写出图中一个属于中和反应的化学方程式;(4)、物质B中含有的阳离子为 , A与B反应类型为25.
(1)、写出物质E的一种用途;(2)、物质C与E反应的化学方程式是;(3)、写出图中一个属于中和反应的化学方程式;(4)、物质B中含有的阳离子为 , A与B反应类型为25.“微观与宏观相联系”是化学独特的思维方式,从宏观进入微观,探索物质变化实质.请结合图示完成下列问题:
 (1)、物质的三态变化,主要是由于( ).
(1)、物质的三态变化,主要是由于( ).
A、微粒大小发生变化 B、微粒质量发生变化 C、变成了新微粒 D、微粒间的间隔发生改变(2)、醋酸(CH3COOH)是一种常见的酸,具有酸的通性例如:醋酸与氢氧化钠溶液反应生成醋酸钠和水,化学方程式为:CH3COOH+NaOH=CH3COONa+H2O.写出该反应的微观实质 , 醋酸与盐酸一样,能与活泼金属反应生成氢气,请写出醋酸与金属锌反应的化学方程式 .(3)、物质组成和结构决定其性质,性质决定其用途.过氧化氢是一种常见杀菌消毒剂,其原因是过氧化氢分子中含有一种叫做“过氧基’,(如图中虚线框标出的部分)的结构.据此推测如图1②﹣④的物质中,可用作杀菌消毒剂的是(填序号)(4)、胃酸过多须服用抗酸药.如表为两种抗酸药的有效成分及其构成微粒:抗胃酸药
复方氢氧化镁片
铝碳酸镁片
有效成分
Mg(OH)2
AlMg(OH)3CO3
构成微粒
Mg2+、OH﹣
Al3+、Mg2+、OH﹣、CO32﹣
由于抗酸药有效成分不同,起抗酸作用(即消耗胃液中盐酸)的微粒也有差异.铝碳酸镁与盐酸反应为:AlMg(OH)3CO3+5HCl═MgCl2+AlCl3+4H2O+CO2↑.则铝碳酸镁起抗酸作用的微粒是、 (填微粒符号).
(5)、一定条件下,甲和乙反应生成丙和丁(四 种物质均由分子构成),反应前后微观示意图如图2.下列说法正确的是 (填选项)A、反应前后共有4种原子 B、该反应有单质生成 C、反应前后元素化合价都不变 D、化学变化中分子和原子均可再分 E、该化学反应中,甲、丁两种分子的个数比是2:3.三、解答题
-
26.
对比归纳是学习化学的重要方法,请你参与下列探究活动并回答问题:
 (1)、实验一:探究影响碳燃烧剧烈燃烧程度的因素.
(1)、实验一:探究影响碳燃烧剧烈燃烧程度的因素.如图:分别将硫在空气和氧气中燃烧.
硫在氧气里燃烧比在空气里燃烧更剧烈,说明了影响硫燃烧剧烈程度的因素是
(2)、实验二:探究二氧化碳能否与氢氧化钠反应.如图是小鹏同学设计的对比实验,用于证明二氧化碳和氢氧化钠能否反应,小燕同学认为该实验设计不符合对比实验的基本原则,她的理由是 .
(3)、实验三:探究影响物质溶解性的因素.小意同学做了如图所示A试管和B试管的对比实验,发现B中固体可溶,A中几乎不可溶,该对比实验说明了影响物质溶解性的因素是 .
27. 某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验.(1)、小明发现燃烧产物的质量大于反应物镁条的质量,产生这一现象的原因 .(2)、于是小明同学按如图装置改进了该实验,验证了质量守恒定律,却发现产物中还有少量黄色固体.

【提出问题】黄色固体是什么呢?
【查阅资料】①氧化镁为白色固体;②镁能与氮气剧烈反应生成黄色的氮化镁(Mg3N2);③氮化镁可与水剧烈反应产生氮气,该气体能使湿润的红色石蕊试纸变蓝.
【做出猜想】黄色固体是Mg3N2;
【实验探究】请设计实验,验证猜想.
实验操作
实验现象及结论
【反思与交流】空气中N2的含量远大于O2的含量,而镁条在空气中燃烧生成的MgO却远多于Mg3N2 , 为什么呢?请给出合理的解释 .
(3)、该兴趣小组又做了镁条与盐溶液反应的实验,发现均能产生H2 , 实验现象如下.实验序号
实验1
实验2
实验3
与镁条反应的溶液
NH4Cl
NaCl
Na2SO4
H2O
实验现象
有大量气泡产生
有较多气泡产生
有少量气泡产生
气泡较少
加热后,实验现象
气泡明显增多可闻到氮味
气泡增多
气泡增多
气泡增多
上表中,用水进行实验的目的是 .
根据上表中的实验现象,请写出两条结论,并分析可能的原因(不分析原因,不得分):①;② .
28. 某校化学兴趣小组的同学开展了测定Na2CO3和NaCl的固体混合物中Na2CO3质量分数的探究实验.他们设计了如下方案: (1)、方案一:气体分析法.
(1)、方案一:气体分析法.(i)如图1所示(铁夹夹持的仪器是注射器),把该混合物与足量稀硫酸反应后,测定产生CO2的体积,检查该装置的气密性的方法是 .
(ii)有同学提出以图2代替图1中的收集装置,则所测CO2气体的体积(填“偏大”、“偏小”或“不变”),理由是 , 广口瓶内原有的空气对实验结果(填“有”或“没有”)影响.
(iii)有同学用图3装置进行测定CO2的质量(碱石灰的成分是CaO和NaOH的混合物).
该装置导致实验结果偏大的可能原因是
A、装置内残留的CO2气体不能全部排出.
B、产生的CO2气体中混有氯化氢气体,同时被碱石灰吸收.
C、产生的CO2气体中混有水蒸气,同时被碱石灰吸收.
D、球形干燥管与空气相通,也会吸收空气中的CO2和H2O.
(2)、方案二:沉淀分析法 (如图4所示).则:(i)确定CaCl2溶液是否过量的方法是 .
(ii)该方法发生反应的化学方程式为 .
(3)、方案三:盐酸滴定法(如图5所示)(i)用已知浓度盐酸滴加到一定质量的混合物,根据消耗盐酸溶液的体积来测定碳酸钠的含量,在实验过程中判断斥所滴加的稀盐酸恰好与碳酸钠反应的方法是 .
(ii)晓红同学通过实验测定了一些数据,试根据下面的实验数据计算Na2CO3的质量分数.称取Na2CO3和NaaCl固体混合物10g,与足量稀盐酸反应后蒸发干燥得到10.55g固体.该
固体混合物中Na2CO3质量分数为 .
29. “中东呼吸综合征”病毒与“非典”病毒类似,加强自身防护是抵御病毒的重要方法,过氧乙酸消毒液是常用的一种消毒剂,请根据图示中的信息回答下列问题: (1)、过氧乙酸的相对分子质量为 .(2)、过氧乙酸中碳元素的质量分数为;(计算结果精确至0.1%)(3)、若用10kg0.4%的过氧乙酸溶液进行喷雾消毒,需此消毒液 kg,水 kg.30. 为测定某纯碱样品(含少量硫酸钠杂质)中碳酸钠的质量分数,某化学兴趣小组进行以下实验.取一定质量的样品放置于烧杯中.向烧杯中滴加一定溶质质量分数的稀盐酸,实验测得烧杯中物质的总质量与加入稀盐酸的质量的关系如图所示.求:
(1)、过氧乙酸的相对分子质量为 .(2)、过氧乙酸中碳元素的质量分数为;(计算结果精确至0.1%)(3)、若用10kg0.4%的过氧乙酸溶液进行喷雾消毒,需此消毒液 kg,水 kg.30. 为测定某纯碱样品(含少量硫酸钠杂质)中碳酸钠的质量分数,某化学兴趣小组进行以下实验.取一定质量的样品放置于烧杯中.向烧杯中滴加一定溶质质量分数的稀盐酸,实验测得烧杯中物质的总质量与加入稀盐酸的质量的关系如图所示.求: (1)、所取样品的质量是 g.(2)、样品中碳酸钠的质量分数是(精确到0.1%).(3)、所用稀盐酸的溶质质量分数(写出具体的计算过程).
(1)、所取样品的质量是 g.(2)、样品中碳酸钠的质量分数是(精确到0.1%).(3)、所用稀盐酸的溶质质量分数(写出具体的计算过程).