第16讲:原电池及其应用
试卷更新日期:2018-10-25 类型:一轮复习
一、单选题
-
1. 燃料电池是一种将化学反应产生的能量直接转化为电能的装置,你认为下列燃料电池比较适合宇宙飞船上使用的是( )A、CH4—O2燃料电池 B、C2H5OH—O2燃料电池 C、H2—O2燃料电池 D、CO—O2燃料电池2. 下列装置属于原电池装置的是( )A、
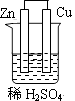 B、
B、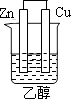 C、
C、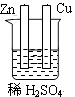 D、
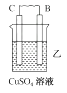
D、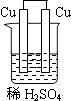 3. 铜-锌原电池如图所示,电解质溶液为硫酸铜溶液,电池工作一段时间后,下列说法错误的是( )
3. 铜-锌原电池如图所示,电解质溶液为硫酸铜溶液,电池工作一段时间后,下列说法错误的是( )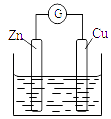 A、锌电极上的反应为Zn-2e-=Zn2+ B、电子从锌电极经过硫酸铜溶液流向铜电极 C、溶液中的SO42-向锌电极移动 D、铜电极质量增加4. 锂-空气电池的工作原理如图所示。其中多孔电极材料选用纳米多孔金时, 该电池表现出良好的循环性能。电池反应为: 2Li+O2=Li2O2。 下列说法错误的是( )
A、锌电极上的反应为Zn-2e-=Zn2+ B、电子从锌电极经过硫酸铜溶液流向铜电极 C、溶液中的SO42-向锌电极移动 D、铜电极质量增加4. 锂-空气电池的工作原理如图所示。其中多孔电极材料选用纳米多孔金时, 该电池表现出良好的循环性能。电池反应为: 2Li+O2=Li2O2。 下列说法错误的是( )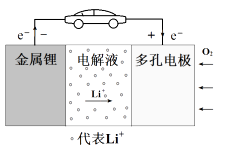 A、该电池的电解液常用锂盐的有机溶液 B、电池工作时,外电路中流过 0.01 mol 电子,负极材料减重 0.07g C、电池工作时,正极反应可能经过两个过程: Li++O2+e-=LiO2 Li++LiO2+e-=Li2O2 D、电池充电时间越长,电池中 Li2O2越多5. 为延长舰船服役寿命可采用的电化学防腐的方法有①舰体与直流电源相连②舰体上镶嵌某种金属块。下列有关说法正确的是( )A、方法①中舰体应连电源的正极 B、方法②中镶嵌金属块可以是锌 C、方法①为牺牲阳极的阴极保护法 D、方法②为外加电流的阴极保护法6. 化学与生产、生活、社会密切相关。下列说法中错误的是( )A、“硫黄姜”又黄又亮,可能是在用硫黄熏制的过程中产生的SO2所致 B、铁在潮湿的空气中放置,易发生化学腐蚀而生锈 C、绿色化学的核心是从源头上消除工业生产对环境的污染 D、用CO2合成聚碳酸酯可降解塑料,可实现“碳”的循环利用7. 在日常生活中,我们经常看到铁制品生锈、铝制品表面出现白斑等众多的金属腐蚀现象。可以通过下列装置所示实验进行探究。下列说法正确的是( )
A、该电池的电解液常用锂盐的有机溶液 B、电池工作时,外电路中流过 0.01 mol 电子,负极材料减重 0.07g C、电池工作时,正极反应可能经过两个过程: Li++O2+e-=LiO2 Li++LiO2+e-=Li2O2 D、电池充电时间越长,电池中 Li2O2越多5. 为延长舰船服役寿命可采用的电化学防腐的方法有①舰体与直流电源相连②舰体上镶嵌某种金属块。下列有关说法正确的是( )A、方法①中舰体应连电源的正极 B、方法②中镶嵌金属块可以是锌 C、方法①为牺牲阳极的阴极保护法 D、方法②为外加电流的阴极保护法6. 化学与生产、生活、社会密切相关。下列说法中错误的是( )A、“硫黄姜”又黄又亮,可能是在用硫黄熏制的过程中产生的SO2所致 B、铁在潮湿的空气中放置,易发生化学腐蚀而生锈 C、绿色化学的核心是从源头上消除工业生产对环境的污染 D、用CO2合成聚碳酸酯可降解塑料,可实现“碳”的循环利用7. 在日常生活中,我们经常看到铁制品生锈、铝制品表面出现白斑等众多的金属腐蚀现象。可以通过下列装置所示实验进行探究。下列说法正确的是( )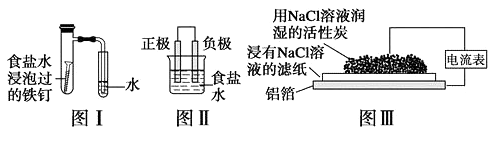 A、按图Ⅰ装置实验,为了更快更清晰地观察到液柱上升,可采用下列方法:用酒精灯加热具支试管 B、图Ⅱ是图Ⅰ所示装置的原理示意图,图Ⅱ的正极材料是铁 C、铝制品表面出现白斑可以通过图Ⅲ装置进行探究,Cl-由活性炭区向铝箔表面区迁移,并发生电极反应:2Cl--2e-=Cl2↑ D、图Ⅲ装置的总反应为4Al+3O2+6H2O=4Al(OH)3 , 生成的Al(OH)3进一步脱水形成白斑8. 图中烧杯中盛的是天然水,铁腐蚀的速率由快到慢的顺序是( )
A、按图Ⅰ装置实验,为了更快更清晰地观察到液柱上升,可采用下列方法:用酒精灯加热具支试管 B、图Ⅱ是图Ⅰ所示装置的原理示意图,图Ⅱ的正极材料是铁 C、铝制品表面出现白斑可以通过图Ⅲ装置进行探究,Cl-由活性炭区向铝箔表面区迁移,并发生电极反应:2Cl--2e-=Cl2↑ D、图Ⅲ装置的总反应为4Al+3O2+6H2O=4Al(OH)3 , 生成的Al(OH)3进一步脱水形成白斑8. 图中烧杯中盛的是天然水,铁腐蚀的速率由快到慢的顺序是( )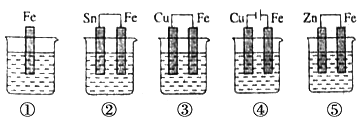 A、⑤>②>①>③>④ B、⑤>②>③>④>① C、④>③>②>①>⑤ D、④>③>⑤>②>①9. 某科研小组公司开发了Li-SO2Cl2军用电池,其示意图如下图所示,已知电池总反应为:2Li+ SO2Cl2= 2LiCl+SO2↑。下列叙述中错误的是( )
A、⑤>②>①>③>④ B、⑤>②>③>④>① C、④>③>②>①>⑤ D、④>③>⑤>②>①9. 某科研小组公司开发了Li-SO2Cl2军用电池,其示意图如下图所示,已知电池总反应为:2Li+ SO2Cl2= 2LiCl+SO2↑。下列叙述中错误的是( )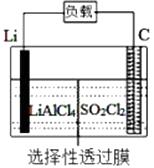 A、电池工作时负极材料是Li,发生氧化反应 B、电池工作时电子流向:锂电极→导线→负载→碳棒 C、电池工作时,外电路流过0.2 mol电子,标准状况下生成4.48 L气体 D、电池工作过程中,石墨电极反应式为SO2Cl2+2e-=2Cl-+SO2↑10. 手持技术的氧电化学传感器可用于测定O2含量,下图为某种氧电化学传感器的原理示意图。已知在测定O2含量过程中,电解质溶液的质量保持不变。一定时间内,若通过传感器的待测气体为aL(标准状况),某电极增重了bg。下列说法正确的是( )
A、电池工作时负极材料是Li,发生氧化反应 B、电池工作时电子流向:锂电极→导线→负载→碳棒 C、电池工作时,外电路流过0.2 mol电子,标准状况下生成4.48 L气体 D、电池工作过程中,石墨电极反应式为SO2Cl2+2e-=2Cl-+SO2↑10. 手持技术的氧电化学传感器可用于测定O2含量,下图为某种氧电化学传感器的原理示意图。已知在测定O2含量过程中,电解质溶液的质量保持不变。一定时间内,若通过传感器的待测气体为aL(标准状况),某电极增重了bg。下列说法正确的是( )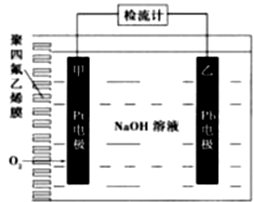 A、Pt上发生氧化反应 B、Pb上发生的电极反应式为Pb-2e-+2OH-=Pb(OH)2 C、反应过程中转移OH-的物质的量为0.25bmol D、待测气体中氧气的体积分数为0.7b/a11. 将等质量的两份锌粉a、b分别加入到足量的稀硫酸中,同时向a中加少量CuSO4溶液,下图中产生H2的体积V(L)与时间t(min)的关系,其中正确的是( )A、
A、Pt上发生氧化反应 B、Pb上发生的电极反应式为Pb-2e-+2OH-=Pb(OH)2 C、反应过程中转移OH-的物质的量为0.25bmol D、待测气体中氧气的体积分数为0.7b/a11. 将等质量的两份锌粉a、b分别加入到足量的稀硫酸中,同时向a中加少量CuSO4溶液,下图中产生H2的体积V(L)与时间t(min)的关系,其中正确的是( )A、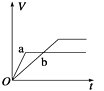 B、
B、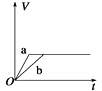 C、
C、 D、
D、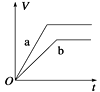 12. 氢氧燃料电池以KOH溶液为电解质溶液,下列有关该电池的叙述不正确的是( )A、正极反应式为:O2+2H2O+4e﹣═4OH﹣ B、工作一段时间后,电解液中KOH的物质的量浓度不变 C、该燃料电池的总反应方程式为:2H2+O2═2H2O D、氢氧燃料电池的能源利用率比氢气燃烧的能量利用率大13. 最近科学家利用下图装置成功地实现了CO2和H2O合成CH4 , 下列叙述错误的是( )
12. 氢氧燃料电池以KOH溶液为电解质溶液,下列有关该电池的叙述不正确的是( )A、正极反应式为:O2+2H2O+4e﹣═4OH﹣ B、工作一段时间后,电解液中KOH的物质的量浓度不变 C、该燃料电池的总反应方程式为:2H2+O2═2H2O D、氢氧燃料电池的能源利用率比氢气燃烧的能量利用率大13. 最近科学家利用下图装置成功地实现了CO2和H2O合成CH4 , 下列叙述错误的是( )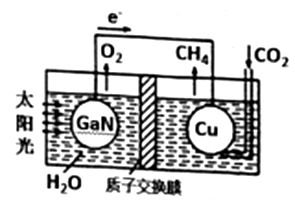 A、电池工作时,实现了将太阳能转化为电能 B、铜电极为正极,电极反应式为CO2+8eˉ+8H+=CH4+2H2O C、电池内H+透过质子交换膜从右向左移动 D、为提高该人工光合系统的工作效率,可向装置中加入少量稀硫酸14. 为了强化安全管理,某油库引进了一台空气中汽油含量的测量仪,其工作原理如图所示 (用强酸性溶液作电解质溶液)。下列说法中错误的是( )
A、电池工作时,实现了将太阳能转化为电能 B、铜电极为正极,电极反应式为CO2+8eˉ+8H+=CH4+2H2O C、电池内H+透过质子交换膜从右向左移动 D、为提高该人工光合系统的工作效率,可向装置中加入少量稀硫酸14. 为了强化安全管理,某油库引进了一台空气中汽油含量的测量仪,其工作原理如图所示 (用强酸性溶液作电解质溶液)。下列说法中错误的是( )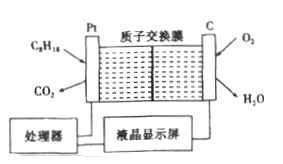 A、石量电极作正极,电极表面有物质被还原 B、铂电极的电极反应式为: C8H18+16H2O-50e-=8CO2+50H+ C、H+由质子交换膜左侧向右侧迁移 D、标况下每消耗5.6 L O2电路中通过1mol 电子,经过电解质形成闭合回路
A、石量电极作正极,电极表面有物质被还原 B、铂电极的电极反应式为: C8H18+16H2O-50e-=8CO2+50H+ C、H+由质子交换膜左侧向右侧迁移 D、标况下每消耗5.6 L O2电路中通过1mol 电子,经过电解质形成闭合回路二、填空题
-
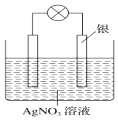
15. 某学习小组依据氧化还原反应:2Ag++Cu═Cu2++2Ag设计成的原电池如图所示,则负极发生的电极反应为;当反应进行到一段时间后取出电极材料,测得某一电极增重了5.4g,则该原池反应共转移了的电子数目是 .
 16. 铁处于Ⅰ、Ⅱ、Ⅲ三种不同的环境中如图所示,则铁被腐蚀的速率由慢到快的顺序是(填序号) .
16. 铁处于Ⅰ、Ⅱ、Ⅲ三种不同的环境中如图所示,则铁被腐蚀的速率由慢到快的顺序是(填序号) .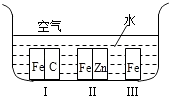
三、综合题
-
17. 下图所示水槽中试管内有一枚铁钉,放置数天后观察:
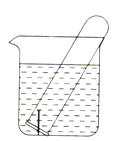 (1)、铁钉在逐渐生锈,则铁钉的腐蚀属于腐蚀。(2)、若试管内液面上升,则原溶液呈性,发生腐蚀,正极反应式为。(3)、若试管内液面下降,则原溶液呈性,正极反应式为。18. Zn—MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。(1)、该电池的负极材料是。电池工作时,电子流向(填“正极”或“负极”)。(2)、若ZnCl2—NH4Cl混合溶液中含有杂质Cu2+ , 会加速其电极的腐蚀,其主要原因是。欲除去Cu2+ , 最好选用下列试剂中的(填字母)。
(1)、铁钉在逐渐生锈,则铁钉的腐蚀属于腐蚀。(2)、若试管内液面上升,则原溶液呈性,发生腐蚀,正极反应式为。(3)、若试管内液面下降,则原溶液呈性,正极反应式为。18. Zn—MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。(1)、该电池的负极材料是。电池工作时,电子流向(填“正极”或“负极”)。(2)、若ZnCl2—NH4Cl混合溶液中含有杂质Cu2+ , 会加速其电极的腐蚀,其主要原因是。欲除去Cu2+ , 最好选用下列试剂中的(填字母)。A.NaOH B.Zn
C.Fe D.NH3·H2O
19. 氢气是未来最理想的能源。科学家最近研制出利用太阳能产生激光,并在二氧化钛(TiO2)表面作用使海水分解得到氢气的新技术:2H2O 2H2↑+O2↑,制得的氢气可用于制作燃料电池。试回答下列问题:(1)、分解海水时,实现了光能转化为能。生成的氢气用于制作燃料电池时,实现了化学能转化为能。分解海水的反应属于反应(填“放热”或“吸热”)。(2)、某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质, A极上发生的电极反应为2H2+2O2--4e-=2H2O,则A极是电池的极,电子从该极(填“流入”或“流出”)。B极电极反应式为。20. 如下图所示,可形成氢氧燃料电池。通常氢氧燃料电池有酸式(当电解质溶液为硫酸时)和碱式[当电解质溶液为NaOH(aq)或KOH(aq)时]两种。试回答下列问题: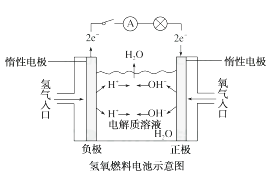 (1)、酸式电池的电极反应:负极 , 正极;电池总反应:;电解质溶液pH的变化(填“变大”、“变小”或“不变”)。(2)、碱式电池的电极反应:负极 , 正极;电池总反应:;电解质溶液pH的变化(填“变大”、“变小”或“不变”)。21. 由A、B、C、D四种金属按下表中装置进行实验。
(1)、酸式电池的电极反应:负极 , 正极;电池总反应:;电解质溶液pH的变化(填“变大”、“变小”或“不变”)。(2)、碱式电池的电极反应:负极 , 正极;电池总反应:;电解质溶液pH的变化(填“变大”、“变小”或“不变”)。21. 由A、B、C、D四种金属按下表中装置进行实验。装置
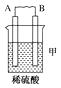
现象
二价金属A
不断溶解
C的质量增加
A上有气体产生
根据实验现象回答下列问题:
(1)、装置甲中负极的电极反应式是。(2)、装置乙中正极的电极反应式是。(3)、装置丙中溶液的pH(填“变大”“变小”或“不变”)。(4)、四种金属活动性由强到弱的顺序是。22. 水钴矿中除SiO2外,还有9.24% CoO、2.78% Fe2O3、0.96% MgO、0.084%CaO。
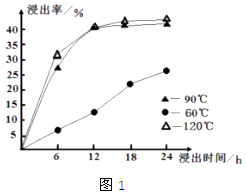
 (1)、在一定浓度的 溶液中,钴的浸出率随时间、温度的变化如图1所示 考虑生产成本和效率,最佳的浸出时间为小时,最佳的浸出温度为(2)、请配平下列除铁的化学方程式:
(1)、在一定浓度的 溶液中,钴的浸出率随时间、温度的变化如图1所示 考虑生产成本和效率,最佳的浸出时间为小时,最佳的浸出温度为(2)、请配平下列除铁的化学方程式:_ _Fe2(SO4)3+H2O +Na2CO3 =Na2Fe6(SO4)4(OH)12↓+Na2SO4 +CO2↑
(3)、“除钙、镁”的原理反应为: ; 已知 ,加入过量NaF溶液反应完全后过滤,则滤液中 .(4)、“沉淀”中含杂质离子主要有 、 、和;“操作X”包括和。(5)、某锂离子电池正极是 ,含 导电固体为电解质 充电时, 还原为Li,并以原子形式嵌入电池负极材料碳 中 如图2所示 电池反应为 ,写出该电池放电时的正极反应式 .