第15讲:反应热 盖斯定律
试卷更新日期:2018-10-25 类型:一轮复习
一、单选题
-
1. 下列说法中正确的是( )
A、“冰,水为之,而寒于水”说明相同质量的冰和水比较,冰的能量更高 B、“蜡炬成灰泪始干”中“泪”的主要成分是水 C、“南朝四百八十寺,多少楼台烟雨中”的“烟雨”是由飘浮在空气中的固体小颗粒形成的 D、“钻石恒久远,一颗永流传”说明常温下钻石的化学性质比较稳定2. 已知:△G=△H-T△S,当△G<0,反应能自发进行,△G>0反应不能自发进行。下列说法中正确的是( )A、非自发反应在任何条件下都不能发生 B、熵增加且放热的反应一定是自发反应 C、自发反应一定是熵增加的反应,非自发反应一定是熵减小或不变的反应 D、凡是放热反应都是能自发进行的反应,而吸热反应都是非自发进行的反应3. 下列装置中,都伴随有能量变化,其中是由化学能转变为电能的是( )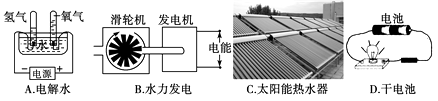 A、A B、B C、C D、D4. 一定条件下,在水溶液中1molCl-、ClOx-(x=1,2,3,4)的能量(kJ)相对大小如图所示。下列有关说法正确的是( )
A、A B、B C、C D、D4. 一定条件下,在水溶液中1molCl-、ClOx-(x=1,2,3,4)的能量(kJ)相对大小如图所示。下列有关说法正确的是( )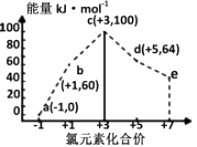 A、a、b、c、d、e中,c最稳定 B、b→a+c反应的活化能为反应物能量减生成物能量 C、b→a+d反应的热化学方程式为:3ClO-(aq)=ClO3-(aq)+2Cl-(aq)ΔH=+116kJ·mol-1 D、一定温度下,Cl2与NaOH溶液反应生成的产物有a、b、d,溶液中a、b、d的浓度之比可能为11∶1∶25. 已知: ①C6H12O6(s)=2C2H5OH(l)+2CO2(g) △H1
A、a、b、c、d、e中,c最稳定 B、b→a+c反应的活化能为反应物能量减生成物能量 C、b→a+d反应的热化学方程式为:3ClO-(aq)=ClO3-(aq)+2Cl-(aq)ΔH=+116kJ·mol-1 D、一定温度下,Cl2与NaOH溶液反应生成的产物有a、b、d,溶液中a、b、d的浓度之比可能为11∶1∶25. 已知: ①C6H12O6(s)=2C2H5OH(l)+2CO2(g) △H1②6CO2(g)+6H2O(g)=C6H12O6(s)+6O2 △H2
③2H2O(g)=2H2(g)+O2(g) △H3
④2CO2(g)+6H2(g)=C2H5OH(l)+3H2O △H4
下列有关说法正确的是( )
A、H2的燃烧热为 B、反应①使用催化剂,△H1将减小 C、标准状况下,反应②生成1.12LO2 , 转移的电子数为0.1×6.02×1023 D、2△H4=△H1+△H2-6△H36. 已知C2H2 (g) + O2 (g) → 2CO2 (g) + H2O (g)+1256 kJ,下列说法正确的是( )A、1 份乙炔完全燃烧可放热1256 kJ B、反应中乙炔做还原剂、被还原 C、乙炔完全燃烧时,生成2 mol液态水,所放热量小于2512 kJ D、若有10 mol电子发生转移,则需消耗2.5 mol O27. 下列变化过程中Q>0的是( )A、CH3COOH CH3COO- + H+ + Q B、CaCO3(s)→ CaO(s)+ CO2(g)+ Q C、S2- + H2O HS- + OH- + Q D、S(g)→S(l)+ Q8. 对H2在O2中燃烧的反应,下列说法不正确的是 ( )A、该反应为吸热反应 B、该反应为放热反应 C、断裂H—H键吸收能量 D、生成H—O键放出能量9. 某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( ) A、该反应为放热反应 B、催化剂能改变反应的焓变 C、逆反应的活化能大于正反应的活化能 D、催化剂能降低反应的活化能10. 已知H+(aq)+OH﹣(aq)=H2O(l)△H=﹣57.3kJ/mol,向50mL 2mol/L的NaOH溶液中加入1mol/L的某种酸恰好完全反应,测得加入酸的体积与反应放出热量的关系如下图所示(不考虑热量的散失),则该酸可能是( )
A、该反应为放热反应 B、催化剂能改变反应的焓变 C、逆反应的活化能大于正反应的活化能 D、催化剂能降低反应的活化能10. 已知H+(aq)+OH﹣(aq)=H2O(l)△H=﹣57.3kJ/mol,向50mL 2mol/L的NaOH溶液中加入1mol/L的某种酸恰好完全反应,测得加入酸的体积与反应放出热量的关系如下图所示(不考虑热量的散失),则该酸可能是( ) A、醋酸(CH3COOH) B、盐酸 C、草酸(HOOC﹣COOH) D、硫酸11. 通过以下反应均可获取O2。下列有关说法不正确的是 ( )
A、醋酸(CH3COOH) B、盐酸 C、草酸(HOOC﹣COOH) D、硫酸11. 通过以下反应均可获取O2。下列有关说法不正确的是 ( )①光催化分解水制氧气:2H2O(l)=2H2(g) + O2(g) ΔH1=+571.6 kJ·mol-1
②过氧化氢分解制氧气:2H2O2(l)=2H2O(l) + O2(g) ΔH2=-196.4 kJ·mol-1
③一氧化氮分解制氧气:2NO(g)=N2(g) + O2(g) ΔH3=-180.5 kJ·mol-1
A、反应①是人们获取H2的途径之一 B、反应②、③都是化学能转化为热能 C、反应H2O2(l)=H2O(g)+ O2(g)的ΔH=-285.8kJ·mol-1 D、反应2H2(g)+2NO(g)=N2(g)+2H2O(l)的ΔH=-752.1 kJ·mol-112. 参照反应Br+H2→HBr+H的能量随反应过程变化的示意图(如下图所示),下列叙述中正确的是( )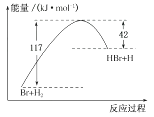 A、反应物具有的总能量大于生成物具有的总能量 B、正反应为吸热反应 C、该反应的逆反应是吸热过程 D、从图中可以看出,HBr的能量一定高于H2的能量13. 下列各组变化中,化学反应的△H前者小于后者的一组是( )
A、反应物具有的总能量大于生成物具有的总能量 B、正反应为吸热反应 C、该反应的逆反应是吸热过程 D、从图中可以看出,HBr的能量一定高于H2的能量13. 下列各组变化中,化学反应的△H前者小于后者的一组是( )①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1;CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H2;
②S(s)+O2(g)═SO2(g)△H1;S(g)+O2(g)═SO2(g)△H2;
③2H2(g)+O2(g)═2H2O(l)△H1;H2(g)+ O2(g)═H2O(l)△H2;
④CaCO3(s)═CaO(s)+CO2(g)△H1;CaO(s)+H2O(l)═Ca(OH)2(s)△H2 .
A、①② B、②③ C、①③ D、③④14. 如图为反应2H2(g)+O2(g)═2H2O(g)的能量变化示意图.下列说法正确的是( )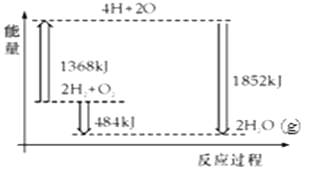 A、H2(g)和O2(g)反应生成H2O(g ),这是吸热反应 B、2mol H2和1mol O2转化为4mol H、2mol O原子的过程中放出热量 C、2mol H2(g)和1mol O2(g)反应生成2mol H2O(g),共放出484kJ能量 D、4mol H、2mol O生成2mol H2O(g),共放出484kJ能量
A、H2(g)和O2(g)反应生成H2O(g ),这是吸热反应 B、2mol H2和1mol O2转化为4mol H、2mol O原子的过程中放出热量 C、2mol H2(g)和1mol O2(g)反应生成2mol H2O(g),共放出484kJ能量 D、4mol H、2mol O生成2mol H2O(g),共放出484kJ能量二、填空题
-
15. 拆开1mol H﹣H键,1mol N﹣H键,1mol N≡N键分别需要吸收的能量为436kJ,391kJ,946kJ.则1mol N2完全反应生成NH3热量(填“吸收”或“放出”) kJ.16. 根据最新“人工固氮”的研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应:
N2(g)+3H2O(l)=2NH3(g)+1.5O2(g),△H.
已知:N2(g)+3H2(g)=2NH3(g)△H=a kJ/mol,
2H2(g)+O2(g)=2H2O(l)△H=b kJ/mol,
则N2(g)+3H2O(l)=2NH3(g)+1.5O2(g)的△H=kJ/mol(用含a、b的式子表示).
17. 工业上可利用CO2和H2生成甲醇,热化学方程式如下:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=Q1kJ•mol﹣1
又查资料得知:①CH3OH(l)+ O2(g)⇌CO2(g)+H2(g)△H=Q2kJ•mol﹣1
②H2O(g)=H2O(I)△H=Q3kJ•mol﹣1
则表示甲醇的燃烧热的热化学方程式为 .
18.用Cl2生产某些含氯有机物时会产生副产物HCl.利用反应A,可实现氯的循环利用.
反应A:4HCl(g)+O2(g) Cl2 (g)+2H2O (g)
已知:Ⅰ.反应A中,4mol HCl被氧化,放出115.6kJ的热量.
Ⅱ.①H2O的电子式是 .
②反应A的热化学方程式是 .
③断开1mol H﹣O 键与断开 1mol H﹣Cl 键所需能量相差约为 kJ,H2O中H﹣O 键比HCl中H﹣Cl键(填“强”或“弱”) .

三、实验探究题
-
19. 为探究测定中和热的实验,小明利用50mL 0.50mol•L﹣1盐酸与50mL 0.55mol•L﹣1NaOH溶液,在如图所示的装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热(中和热数值为57.3kJ/mol).
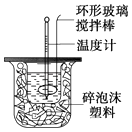 (1)、写出实验所进行的中和反应的热化学方程式 .(2)、实验装置中,烧杯间填满碎纸条的作用为 .(3)、该实验中,使用浓度略大于盐酸的NaOH溶液的原因是 , 若改用60mL 0.50mol•L﹣1盐酸跟50mL 0.55mol•L﹣1 , NaOH溶液进行反应,所求中和热的数值(填“相等”或“不相等”),理由是 .(4)、小明利用上述装置做实验,测得中和热的数值偏低,请你分析可能的原因是 .
(1)、写出实验所进行的中和反应的热化学方程式 .(2)、实验装置中,烧杯间填满碎纸条的作用为 .(3)、该实验中,使用浓度略大于盐酸的NaOH溶液的原因是 , 若改用60mL 0.50mol•L﹣1盐酸跟50mL 0.55mol•L﹣1 , NaOH溶液进行反应,所求中和热的数值(填“相等”或“不相等”),理由是 .(4)、小明利用上述装置做实验,测得中和热的数值偏低,请你分析可能的原因是 .A.测量盐酸的温度后,温度计没有用水冲洗干净 B.做本实验的当天室温较高
C.将量筒中的NaOH(aq)倒入小烧杯时动作迟缓 D.在量取盐酸时仰视读数
E.大烧杯的盖板中间小孔太大.
四、综合题
-
20. 过度排放CO2会造成“温室效应”,为了减少煤燃烧对环境造成的污染,煤的气化是高效、清洁利用煤炭的重要途径.煤综合利用的一种途径如图所示.
 (1)、已知C(s)+H2O(g)═CO(g)+H2(g)△H1=+131.3kJ•mol﹣1 , C(s)+2H2O(g)═CO2(g)+2H2(g)△H2=+90kJ•mol﹣1 . 则一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式是 .(2)、用如图原电池装置可以完成过程⑤的转化,该装置b电极的电极反应式是 .
(1)、已知C(s)+H2O(g)═CO(g)+H2(g)△H1=+131.3kJ•mol﹣1 , C(s)+2H2O(g)═CO2(g)+2H2(g)△H2=+90kJ•mol﹣1 . 则一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式是 .(2)、用如图原电池装置可以完成过程⑤的转化,该装置b电极的电极反应式是 . (3)、在压强为0.1MPa条件下,容积为V L的密闭容器中a mol CO与2a mol H2在催化剂作用下反应生成甲醇:CO(g)+2H2(g)⇌CH3OH(g),CO的平衡转化率与温度、压强的关系如下图所示,则:
(3)、在压强为0.1MPa条件下,容积为V L的密闭容器中a mol CO与2a mol H2在催化剂作用下反应生成甲醇:CO(g)+2H2(g)⇌CH3OH(g),CO的平衡转化率与温度、压强的关系如下图所示,则:①p1p2(填“>”、“<”或“=”).
②在其他条件不变的情况下,向容器中再增加a mol CO与2a mol H2 , 达到新平衡时,CO的平衡转化率(填“增大”、“减小”或“不变”).

③在p1下,100℃时,CO(g)+2H2(g)⇌CH3OH(g)反应的平衡常数为(用含a、V的代数式表示).
(4)、右上图表示CO2与H2反应生成CH3OH和H2O的过程中能量(单位为kJ•mol﹣1)的变化:关于该反应的下列说法中,正确的是 (填编号).
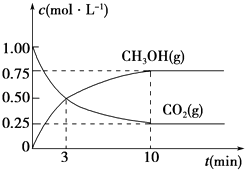
A、△H>0,△S>0 B、△H>0,△S<0 C、△H<0,△S<0 D、△H<0,△S>0(5)、为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3mol H2 , 一定条件下发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化的曲线如图所示:①从反应开始到平衡,CO2的平均反应速率v(CO2)= .
②下列措施中能使化学平衡向正反应方向移动的是(填编号).
A.升高温度
B.将CH3OH(g)及时液化移出
C.选择高效催化剂
D.再充入1mol CO2和3mol H2 .
21. 反应A(g)+B(g) C(g)+D(g)过程中的能量变化如图所示,回答下列问题。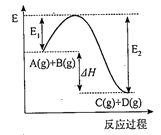 (1)、该反应是反应(填“吸热”或“放热”)。(2)、△H=。(3)、反应体系中加入催化剂对反应热是否有影响?(填“有影响”“无影响”)。(4)、升高温度,该反应的平衡常数K 将(填“增大”“减小”或“不变”)。22. 化学反应过程中发生物质变化的同时,常常伴有能量的变化,这种能量的变化常以热能的形式表现出来,叫做反应热.由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等.(1)、下列△H表示物质燃烧热的是;表示物质中和热的是 . (填“△H1”、“△H2”和“△H3”等)
(1)、该反应是反应(填“吸热”或“放热”)。(2)、△H=。(3)、反应体系中加入催化剂对反应热是否有影响?(填“有影响”“无影响”)。(4)、升高温度,该反应的平衡常数K 将(填“增大”“减小”或“不变”)。22. 化学反应过程中发生物质变化的同时,常常伴有能量的变化,这种能量的变化常以热能的形式表现出来,叫做反应热.由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等.(1)、下列△H表示物质燃烧热的是;表示物质中和热的是 . (填“△H1”、“△H2”和“△H3”等)A.2H2(g)+O2(g)=2H2O(l)△H1
B.C(s)+1/2O2(g)=CO(g)△H2
C.CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H3
D.C(s)+O2(g)=CO2(g)△H4
E.C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l)△H5
F.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H6
G.2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l)△H7
(2)、已知在101kPa、273K时,15g乙烷燃烧生成CO2和液态水,放出akJ的热量,下列热化学方程式正确的是 .A、C2H6(g)+ O2(g)=2CO2(g)+3H2O(l)△H=+2akJ/mol B、C2H6(g)+ /2O2(g)=2CO2(g)+3H2O(g)△H=﹣2akJ/mol C、2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l)△H=﹣4akJ/mol D、2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g)△H=﹣4akJ/mol(3)、进一步研究表明,化学反应的能量变化(△H)与反应物和生成物的键能有关(键能可以简单地理解为断开1mol化学键时所需吸收的能量),如表是部分化学键的键能数据:化学键
P﹣P
P﹣O
O═O
P═O
键能KJ/mol
197
360
499
a
已知白磷(P4)的燃烧热为2378.0kJ/mol,白磷完全燃烧的产物(P4O10)的结构如图所示,则如表中a= .
 (4)、在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ.则表示甲醇燃烧热的热化学方程式为 .
(4)、在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ.则表示甲醇燃烧热的热化学方程式为 .
-