第14讲:元素周期表和元素周期律
试卷更新日期:2018-10-25 类型:一轮复习
一、单选题
-
1. 四种短周期元素X、Y、Z和W在周期表中的位置如图所示,原子序数之和为48。下列说法不正确的是( )
 A、原子半径(r)大小比较r(X)>r(Y) B、X和W可形成共价化合物XW3 C、W的非金属性比Z的强,所以W氢化物的沸点比Z的高 D、Z的最低价单核阴离子的失电子能力比Y的强2. 短周期主族元素 X、Y、Z、W 原子序数依次增大,X 是地壳中含量最多的元素,Y 原子的最外层只有一个电子,Z 位于元素周期表ⅢA族,W 与X属于同一主族。下列说法正确的是( )A、原子半径:r(W) > r(Z) > r(Y) B、由X、Y 组成的化合物中均不含共价键 C、Y 的最高价氧化物的水化物的碱性比Z的弱 D、X 的简单气态氢化物的热稳定性比W的强3. 下列有关物质性质的比较,结论正确的是( )A、溶解度:Na2CO3<NaHCO3 B、热稳定性:HCl<PH3 C、沸点:C2H5SH<C2H5OH D、碱性:LiOH<Be(OH)24. 同一短周期元素X、Y、Z、W形成的最高价含氧酸的酸性依次增强,下列有关叙述正确的是( )
A、原子半径(r)大小比较r(X)>r(Y) B、X和W可形成共价化合物XW3 C、W的非金属性比Z的强,所以W氢化物的沸点比Z的高 D、Z的最低价单核阴离子的失电子能力比Y的强2. 短周期主族元素 X、Y、Z、W 原子序数依次增大,X 是地壳中含量最多的元素,Y 原子的最外层只有一个电子,Z 位于元素周期表ⅢA族,W 与X属于同一主族。下列说法正确的是( )A、原子半径:r(W) > r(Z) > r(Y) B、由X、Y 组成的化合物中均不含共价键 C、Y 的最高价氧化物的水化物的碱性比Z的弱 D、X 的简单气态氢化物的热稳定性比W的强3. 下列有关物质性质的比较,结论正确的是( )A、溶解度:Na2CO3<NaHCO3 B、热稳定性:HCl<PH3 C、沸点:C2H5SH<C2H5OH D、碱性:LiOH<Be(OH)24. 同一短周期元素X、Y、Z、W形成的最高价含氧酸的酸性依次增强,下列有关叙述正确的是( )
A、单质沸点:X<Y<Z<W B、气态氢化物的稳定性:X>Y>Z>W C、原子序数:X>Y>Z>W D、最高正价:X<Y<Z<W5. W、X、Y、Z均为短周期元素且原子序数依次增大,元素X和Z同族。盐YZW与浓盐酸反应,有黄绿色气体产生,此气体同冷烧碱溶液作用,可得到YZW的溶液。下列说法正确的是A、原子半径大小为W<X<Y<Z B、X的氢化物水溶液酸性强于Z的 C、Y2W2与ZW2均含有非极性共价键 D、标准状况下W的单质状态与X的相同6. 下表是部分短周期主族元素的相关信息。下列说法错误的是( )元素编号
元素性质或原子结构
X
周期序数=主族序数=原子序数
Y
原子最外层电子数为a,次外层电子数为b
Z
原子L层电子数为a+b,M层电子数为a-b
M
是地壳中含量最多的金属元素
W
位于第三周期,最外层电子数是电子层数的2倍
A、上述五种元素分布在三个不同周期 B、最简单氢化物的稳定性:Y>Z C、M、W的最高价氧化物对应的水化物之间不能发生化学反应 D、Y、M、W分别形成的单核离子中,M形成的离子半径最小7. 短周期主族元素a、b、c、d原子序数依次增大,b元素的一种同位素可用于考古年代鉴定。甲、乙分别是元素b、d的单质,通常甲为固体,乙为气体,0.001mol/L的丙溶液pH=3;W、X、Y均是由这些元素构成的二元化台物,Y是形成酸雨的主要物质之一。上述物质的转化关系如图,下列说法正确的是( )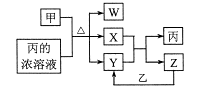 A、原子半径:b B、a、c、d形成的化台物一定是共价化合物 C、W、X、Y中X的熔沸点最高 D、Y、Z均可用排水法收集8. 四种短周期元素在周期表中的位置如图,其中只有M为金属元素,下列说法错误的是( )
A、原子半径:b B、a、c、d形成的化台物一定是共价化合物 C、W、X、Y中X的熔沸点最高 D、Y、Z均可用排水法收集8. 四种短周期元素在周期表中的位置如图,其中只有M为金属元素,下列说法错误的是( ) A、简单氢化物沸点:X<Z B、最高价氧化物对应水化物的酸性:X>Y C、化合物熔点:Y2Z5<M2Z3 D、简单离子的半径:M<Z9. 已知34Se、35Br位于同一周期,根据元素在周期表中的位置,判断下列说法正确的是( )A、离子还原性:Cl−>Br− B、气态氢化物的稳定性:H2S>H2Se C、原子半径:Cl>Br>Se D、酸性:H2SeO4>HBrO4>HClO410. 元素R、X、T、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断错误的是( )
A、简单氢化物沸点:X<Z B、最高价氧化物对应水化物的酸性:X>Y C、化合物熔点:Y2Z5<M2Z3 D、简单离子的半径:M<Z9. 已知34Se、35Br位于同一周期,根据元素在周期表中的位置,判断下列说法正确的是( )A、离子还原性:Cl−>Br− B、气态氢化物的稳定性:H2S>H2Se C、原子半径:Cl>Br>Se D、酸性:H2SeO4>HBrO4>HClO410. 元素R、X、T、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断错误的是( )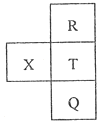 A、非金属性:X<R B、简单离子半径:X2-<Q- C、R与Q的原子序数相差16 D、气态氢化物的稳定性:HT<HR11. V、W、X、Y、Z五种短周期主族元素,原子序数依次增大,X的最外层电子数是内层电子数的三倍,W的气态氢化物和最高价氧化物对应的水化物反应生成一种盐,Y是同周期中原子半径最大的元素,Z的原子序数等于V、W、X的原子序数之和。下列错误的是( )A、简单离子的半径:W>X>Y B、V、X可形成原子个数比为1∶1、2∶1的化合物 C、简单气态氢化物的热稳定性X<W D、X、Z同主族, Y、Z同周期
A、非金属性:X<R B、简单离子半径:X2-<Q- C、R与Q的原子序数相差16 D、气态氢化物的稳定性:HT<HR11. V、W、X、Y、Z五种短周期主族元素,原子序数依次增大,X的最外层电子数是内层电子数的三倍,W的气态氢化物和最高价氧化物对应的水化物反应生成一种盐,Y是同周期中原子半径最大的元素,Z的原子序数等于V、W、X的原子序数之和。下列错误的是( )A、简单离子的半径:W>X>Y B、V、X可形成原子个数比为1∶1、2∶1的化合物 C、简单气态氢化物的热稳定性X<W D、X、Z同主族, Y、Z同周期二、填空题
-
12. 元素金属性的强弱,可以从它的单质与水或酸反应置换氢的程度,以及它的最高价氧化物的水化物的强弱来判断.元素非金属性的强弱,可以从它的最高价氧化物的水化物的强弱,或它的单质跟H2生成气态氢化物的及氢化物的来判断.13. 下列结论错误的是(多选)
①粒子半径:S2﹣>S ②氢化物的稳定性:HF>H2S>SiH4
③离子的还原性:S2﹣>Cl﹣>Br﹣>I﹣ ④还原性:HF>HCl>H2S
⑤酸性:H2SO4>H3PO4>H2CO3>HClO ⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K ⑧沸点:NH3>PH3>AsH3
⑨mXa+与nYb﹣核外电子排布相同,得m+a=n﹣b.
14. 元素周期表的第三周期元素,从左到右(稀有气体除外),原子半径逐渐;元素的金属性逐渐 , 非金属性逐渐 . 该周期元素中,除稀有气体外,原子半径最大的是;最高价氧化物对应的水化物碱性最强的是;最高价氧化物对应的水化物呈两性的是;最高价氧化物对应的水化物酸性最强的是 .15. 碱金属元素原子最外层的电子数都是1个,在化学反应中它们容易(填“得到”或“失去”) 1个电子;碱金属元素中金属性最强的是(Fr除外),原子半径最小的是 . 卤素原子最外层的电子数都是个,在化学反应中它们容易 1个电子;卤化氢的还原性从上到下逐渐 .三、综合题
-
16. 原子序数由小到大排列的四种短周期元素X、Y、Z、W的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。M元素与X同主族,与W同周期。(1)、M元素是(填元素符号)。(2)、Z、W形成的气态氢化物的稳定性为>。(填化学式)(3)、写出M2Z2的电子式: , 写出M2Z2与水反应的离子方程式:。(4)、由X、Y、Z、W四种元素中的三种组成一种强酸,该强酸的稀溶液能与铜反应,离子方程式为。(5)、由X、Y、Z、W四种元素组成一种离子化合物A,已知:①1 mol A能与足量NaOH浓溶液反应生成标准状况下44.8L气体。②A能与盐酸反应产生气体B,该气体能与氯水反应。则A是(填化学式)。写出气体B与氯水反应的离子方程式:。17. 下表列出了①~⑨九种元素在周期表中的位置。
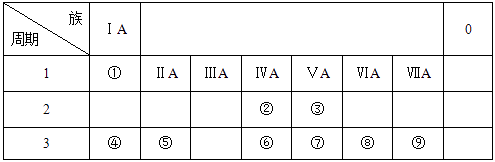
请按要求回答下列问题:
(1)、⑧的原子结构示意图是;(2)、③、⑤、⑦三种元素的原子半径由大到小的顺序是 (填元素符号);(3)、元素②的气态氢化物比元素⑥的气态氢化物的稳定性较 (填 “强”或“弱”);(4)、④和⑨两种元素组成的化合物与AgNO3溶液反应的离子方程式是。18. X、Y、Z、M、W、Q、R是7种短周期元素,其原子半径及主要化合价如下:元素代号
X
Y
Z
M
W
Q
R
原子半径/nm
0.186
0.143
0.104
0.099
0.070
0.066
0.032
主要化合价
+1
+3
+6,﹣2
+7,﹣1
+5,﹣3
﹣2
+1
完成下列填空:
(1)、上述元素中,金属性最强的在周期表中的位置是;X、Y、Q各自形成的简单离子中,离子半径由大到小的顺序是(填离子符号)。W和R按原子个数比1﹕4构成的阳离子所含的化学键是。
(2)、表中所列4种第三周期元素的最高价氧化物的水化物碱性最弱的是(填化学式),其电离方程式为。
(3)、M与Z相比,非金属性较强的是(填元素名称),请从原子结构的角度说明理由。(4)、在稀硫酸中,KMnO4和H2O2能发生氧化还原反应,反应方程式如下: KMnO4+
KMnO4+  H2O2+
H2O2+  H2SO4 →
H2SO4 →  K2SO4+
K2SO4+  MnSO4+
MnSO4+  O2↑+
O2↑+  H2O
H2O请配平 , 当有0.5 mol H2O2参加此反应,电子转移的个数为。
19. 下图中反应①是制备SiH4的一种方法,其副产物MgCl2·6NH3是优质的镁资源。回答下列问题: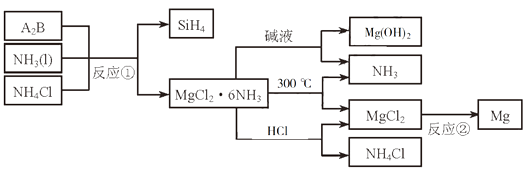 (1)、MgCl2·6NH3所含元素的简单离子半径由小到大的顺序(H-除外): , Mg在元素周期表中的位置: , Mg(OH)2的电子式:。(2)、A2B的化学式为。反应②的必备条件是。上图中可以循环使用的物质有。(3)、在一定条件下,由SiH4和CH4反应生成H2和一种固体耐磨材料(写化学式)。(4)、为实现燃煤脱硫,向煤中加入浆状Mg(OH)2 , 使燃烧产生的SO2转化为稳定的Mg化合物,写出该反应的化学方程式:。(5)、用Mg制成的格氏试剂(RMgBr)常用于有机合成,例如制备醇类化合物的合成路线如下:
(1)、MgCl2·6NH3所含元素的简单离子半径由小到大的顺序(H-除外): , Mg在元素周期表中的位置: , Mg(OH)2的电子式:。(2)、A2B的化学式为。反应②的必备条件是。上图中可以循环使用的物质有。(3)、在一定条件下,由SiH4和CH4反应生成H2和一种固体耐磨材料(写化学式)。(4)、为实现燃煤脱硫,向煤中加入浆状Mg(OH)2 , 使燃烧产生的SO2转化为稳定的Mg化合物,写出该反应的化学方程式:。(5)、用Mg制成的格氏试剂(RMgBr)常用于有机合成,例如制备醇类化合物的合成路线如下: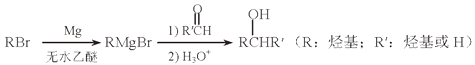
依据上述信息,写出制备
 所需醛的可能结构简式:。
所需醛的可能结构简式:。