第13讲:原子结构与电子式
试卷更新日期:2018-10-25 类型:一轮复习
一、单选题
-
1. 下列图①②③原子结构模型中依次符合卢瑟福、道尔顿、汤姆生的观点的是( )
 A、①②③ B、③①② C、③②① D、②①③2. Si是制造量子计算机的理想材料,这里的“28”是指该原子的( )A、质子数 B、中子数 C、电子数 D、质量数3. 短周期元素中,A元素原子最外层电子数是次外层电子数的2倍;B元素原子最外层电子数是其内层电子总数的3倍;C元素原子M层电子数等于其L层电子数的一半;D元素原子最外层有1个电子,D的阳离子与B的阴离子电子层结构相同,则4种元素原子序数关系中正确的是( )A、C>D>B>A B、D>B>A>C C、A>D>C>B D、B>A>C>D4. 某元素Mn+核外共有x个电子,该原子质量数为a,则该原子核内含有的中子数为( )A、a﹣x+n B、a+x+n C、a﹣n+x D、a﹣x﹣n5. 已知R2+有b个中子,核外有a个电子,表示R原子符号正确的是( )A、 B、 C、 D、6. 我国科学家合成镅的一种新同位素23595Am,与铀23592U比较,下列叙述中正确的是( )A、它们互为同位素 B、原子核中的中子数相同 C、具有相同的质子数 D、23595Am比23592U少3个中子7. 核内中子数为N的R2+离子,质量数为A,则n g它的氧化物中所含质子的物质的量是( )
A、①②③ B、③①② C、③②① D、②①③2. Si是制造量子计算机的理想材料,这里的“28”是指该原子的( )A、质子数 B、中子数 C、电子数 D、质量数3. 短周期元素中,A元素原子最外层电子数是次外层电子数的2倍;B元素原子最外层电子数是其内层电子总数的3倍;C元素原子M层电子数等于其L层电子数的一半;D元素原子最外层有1个电子,D的阳离子与B的阴离子电子层结构相同,则4种元素原子序数关系中正确的是( )A、C>D>B>A B、D>B>A>C C、A>D>C>B D、B>A>C>D4. 某元素Mn+核外共有x个电子,该原子质量数为a,则该原子核内含有的中子数为( )A、a﹣x+n B、a+x+n C、a﹣n+x D、a﹣x﹣n5. 已知R2+有b个中子,核外有a个电子,表示R原子符号正确的是( )A、 B、 C、 D、6. 我国科学家合成镅的一种新同位素23595Am,与铀23592U比较,下列叙述中正确的是( )A、它们互为同位素 B、原子核中的中子数相同 C、具有相同的质子数 D、23595Am比23592U少3个中子7. 核内中子数为N的R2+离子,质量数为A,则n g它的氧化物中所含质子的物质的量是( )
A、 (A-N+8) mol B、 (A-N+10) mol C、(A-N+2) mol D、 (A-N+6) mol8. 下列说法中,正确的是( )A、18O原子核内的中子数为8 B、16O2和18O2的化学性质几乎相同 C、H216O与H218O质子数不同 D、H2和D2属于同位素9. 下列说法正确的是( )A、同一元素各核素的质量数不同,但它们的化学性质几乎完全相同 B、任何元素的原子都是由核外电子和核内中子、质子组成的 C、钠原子失去一个电子后,它的电子数与氖原子相同,所以变成氖原子 D、4018Ar、4019K、4020Ca的质量数相同,所以它们是互为同位素10. 下列各组微粒中,核外电子总数相等的是( )A、Na+和Li+ B、CO和CO2 C、H2O和H3O+ D、NO和CO11. 下列说法正确的是( )A、MgCl2的形成过程可表示为·Mg·+2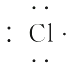 →Mg2+
→Mg2+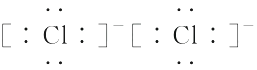 B、H2O分子的结构式可表示为H—O—H
C、NaOH是离子化合物,所以不含共价键
D、Na2S的电子式为Na
B、H2O分子的结构式可表示为H—O—H
C、NaOH是离子化合物,所以不含共价键
D、Na2S的电子式为Na 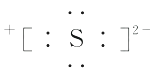 12. 下列表示电子式的形成过程正确的是( )A、
12. 下列表示电子式的形成过程正确的是( )A、 B、
B、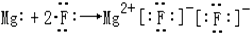 C、
C、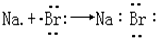 D、
D、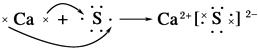 13. 下列化学用语使用正确的是( )A、NH4Cl的电子式:
13. 下列化学用语使用正确的是( )A、NH4Cl的电子式: B、用电子式表示氯化氢分子的形成过程:
B、用电子式表示氯化氢分子的形成过程:  C、氧化钠的电子式:
C、氧化钠的电子式: 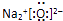 D、R2+离子核外有a个电子,b个中子,R原子表示为: R
D、R2+离子核外有a个电子,b个中子,R原子表示为: R
二、填空题
-
14. 在60g碳中,所含碳原子的最外层电子数目共为 , 质子的总数目为 .15. 核内中子数为N的R2+ , 质量数为A,则ng它的同价态氧化物中所含电子的物质的量为 .16. 用电子式表示下列物质的形成过程:
MgCl2
K2O:
H2O
HCl: .
17. Ⅰ.用ZAX表示原子:(1)阳离子AXn+中共有x个电子,则该阳离子中含有的中子数目为 .
(2)A2﹣原子核内有x个中子,其质量数为m,则n g A2﹣所含电子的物质的量为
Ⅱ.有①816O、817O、818O ②H2、D2、T2 ③石墨、金刚石 ④11H、12H、13H四组微粒或物质.回答下列问题:
(1)互为同位素的是 (填编号).
(2)由①和④中微粒结合形成的水分子种类有 种.
Ⅲ.下列物质中:①N2 ②MgCl2 ③NH4Cl ④CH4 ⑤CO2 ⑥Ne ⑦H2S ⑧KOH ⑨Na2O2 ⑩K2O
只存在共价键的是 ;属于离子化合物,但含有共价键的是
三、综合题
-
18. 金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属M和Ca,并含有3.5%(质量分数)CaO.(1)、Ca原子结构示意图(2)、Ca与最活跃的非金属元素A形成化合物D,D的沸点比A与Si形成的化合物E的沸点 (填高或低),用电子式表示D的形成过程(3)、将钙线试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n . 则M位于元素周期表中的位置是:(4)、取1.6g钙线试样,与水充分反应,生成224mL H2(标准状况),再向溶液中通入适量的CO2 , 最多能得到CaCO3 g