江苏省苏州第十中学2017-2018学年高一上学期化学期中考试试卷
试卷更新日期:2018-10-22 类型:期中考试
一、单项选择题
-
1. 海洋是一个巨大的宝藏,期待着人们的开发和利用。下列物质不经过化学变化就能从海水中获得的是()A、食盐 B、单质溴 C、烧碱 D、单质镁2. 下列各组物质按酸、碱、盐分类顺次排列,正确的是()A、硫酸、纯碱、胆矾 B、次氯酸、烧碱、明矾 C、硝酸、乙醇、醋酸钠 D、磷酸、熟石灰、苛性钠3. 下列物质,属于电解质的是( )A、 溶液 B、 C、 D、蔗糖4. 在容量瓶上无需有的标记是()A、刻度线 B、浓度 C、温度 D、规格(容量)5. 下列实验操作中不正确的是()A、蒸发操作时,应残留少许液体,停止加热,再利用余热使水分完全蒸干 B、蒸馏操作时,应使温度计水银球与蒸馏烧瓶的支管口水平 C、分液操作时,分液漏斗内下层液体从下口放出,上层液体从上口倒出 D、萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大。6. 判断下列有关化学基本概念的依据正确的是()A、溶液与胶体: 本质差别是能否产生丁达尔效应 B、纯净物与混合物: 是否仅含有一种元素 C、氧化还原反应与非氧化还原反应: 本质差别为是否有电子转移 D、电解质与非电解质: 物质本身的导电性7. 以用下列实验装置进行相应实验,能达到实验目的的是()
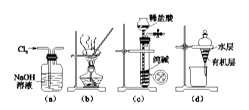 A、用图a所示装置除去 中含有的少量 B、用图b所示装置蒸干NH4Cl 饱和溶液制备 晶体 C、用图c所示装置制取少量纯净的 气体 D、用图d所示装置分离 萃取碘水后已分层的有机层和水层8. 下列离子方程式不正确的是()A、 B、 C、 D、9. 下列实验操作: ①取液体试剂②取固体试剂③配制一定物质的量浓度的溶液④过滤⑤蒸发。一定要用到玻璃棒的是()
A、用图a所示装置除去 中含有的少量 B、用图b所示装置蒸干NH4Cl 饱和溶液制备 晶体 C、用图c所示装置制取少量纯净的 气体 D、用图d所示装置分离 萃取碘水后已分层的有机层和水层8. 下列离子方程式不正确的是()A、 B、 C、 D、9. 下列实验操作: ①取液体试剂②取固体试剂③配制一定物质的量浓度的溶液④过滤⑤蒸发。一定要用到玻璃棒的是()
A、①②③ B、②③④ C、①②⑤ D、 ③④⑤10. 下列变化中,必须要加入氧化剂才能实现的是()A、 B、 C、 D、11. “脚印”、“笑脸”、“五环”等焰火让北京奥运会开幕式更加辉煌壮观,这些五彩缤纷的焰火与元素的焰色反应有关,下列说法不正确的是()A、用洁净的铂丝蘸取少量待测液在酒精灯火焰上灼烧并观察焰色 B、 与 在灼烧时火焰颜色相同 C、焰色反应一定发生化学变化 D、可以用焰色反应来鉴别 和12. 下列四种化学操作名称从左到右分别是()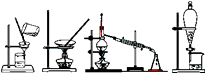 A、过滤、蒸发、蒸馏、萃取分液 B、过滤、蒸馏、蒸发、萃取分液 C、蒸发、蒸馏、过滤、萃取分液 D、萃取、蒸馏、蒸发、过滤分液13. 2010 年诺贝尔化学奖授予在“钯催化交叉偶联反应”领域作出突出贡献的三位化学家。下列有关钯原子( )的说法错误的是( )A、原子序数为46 B、质子数为46 C、电子数为46 D、中子数为4614. 下列溶液与20mL 1 NaNO3溶液中NO3-物质的量浓度相等的是()A、10mL 1 溶液 B、5mL 0.8 溶液 C、10mL 2 溶液 D、10mL 0.5 溶液15. 下列对于某些离子的检验及结论正确的是()A、某溶液,加入稀盐酸产生无色气体,将气体通入澄清石灰水,溶液变浑浊,则一定含有 B、某溶液,加入氢氧化钠溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝,则一定含有 C、某溶液,滴入BaCl2溶液,再滴加稀盐酸,产生白色沉淀,则一定含有 D、某溶液,进行焰色反应,火焰呈黄色,则溶液中一定无16. 为有效降低汽车尾气中 、 等有害气体的排放,需要在汽车尾气系统中装置催化转化器,使 和 发生如下反应: ,下列关于该反应的说法正确的是( )
A、过滤、蒸发、蒸馏、萃取分液 B、过滤、蒸馏、蒸发、萃取分液 C、蒸发、蒸馏、过滤、萃取分液 D、萃取、蒸馏、蒸发、过滤分液13. 2010 年诺贝尔化学奖授予在“钯催化交叉偶联反应”领域作出突出贡献的三位化学家。下列有关钯原子( )的说法错误的是( )A、原子序数为46 B、质子数为46 C、电子数为46 D、中子数为4614. 下列溶液与20mL 1 NaNO3溶液中NO3-物质的量浓度相等的是()A、10mL 1 溶液 B、5mL 0.8 溶液 C、10mL 2 溶液 D、10mL 0.5 溶液15. 下列对于某些离子的检验及结论正确的是()A、某溶液,加入稀盐酸产生无色气体,将气体通入澄清石灰水,溶液变浑浊,则一定含有 B、某溶液,加入氢氧化钠溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝,则一定含有 C、某溶液,滴入BaCl2溶液,再滴加稀盐酸,产生白色沉淀,则一定含有 D、某溶液,进行焰色反应,火焰呈黄色,则溶液中一定无16. 为有效降低汽车尾气中 、 等有害气体的排放,需要在汽车尾气系统中装置催化转化器,使 和 发生如下反应: ,下列关于该反应的说法正确的是( )
A、该反应属于置换反应 B、该反应中 发生氧化反应 C、该反应中的还原剂是 D、反应中每生成1mol ,转移的电子数为17. 设 表示阿伏加德罗常数的数值,下列叙述中正确的是( )A、0.1 溶液中Na+的数目为0.2 B、标准状况下,18 g 的 中含有的电子数为10 C、标准状况下,11.2L的 中所含的分子数为0.5 D、2.4g 金属镁变为镁离子失去的电子数为0.118. 在氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质。下列实验现象和结论一致且正确的是( )A、加入 溶液产生白色沉淀,说明有 离子存在 B、溶液呈黄绿色,且有刺激性气味,说明有 分子存在 C、加入有色布条,一会儿有色布条褪色,说明溶液中有 存在 D、加入饱和 溶液,产生大量气泡,说明有 分子存在19. 下列有关金属钠的说法中,不正确的是( )A、钠应保存在煤油中 B、钠与氧气反应的产物与反应条件有关 C、钠只有在加热条件下才能与氯气反应 D、钠在反应中易失去电子,表现出还原性20. 下列各组离子,在溶液中能大量共存的是()
A、 B、 C、 D、21. 下列离子方程式书写正确的是()A、稀氨水与稀盐酸反应: B、Fe与稀硫酸反应: C、过氧化钠与水反应: D、醋酸与氢氧化钠溶液反应:22. 海带中含碘元素,从海带中提取碘有如下步骤通入足量Cl2将海带焙烧成灰后加水搅拌加 振荡用分液漏斗分液 过滤。合理的操作顺序是()
A、①②③④⑤ B、 ②⑤①③④ C、 ①③⑤②④ D、 ②①③⑤④23. 是一种化工原料,可以制备一系列物质(如下图),下列说法正确的是()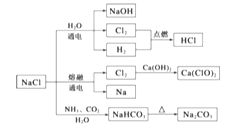 A、25摄氏度, 在水中的溶解度比 的大 B、常温下干燥的 能用钢瓶贮存,所以 不与铁反应 C、 是漂白粉的有效成分 D、上图所示转化反应都是氧化还原反应
A、25摄氏度, 在水中的溶解度比 的大 B、常温下干燥的 能用钢瓶贮存,所以 不与铁反应 C、 是漂白粉的有效成分 D、上图所示转化反应都是氧化还原反应二、非选择题
-
24. 实验室欲配制0.5 的 溶液500mL 有以下仪器:
烧杯100m1量筒10m1容量瓶 500m1容量瓶 玻璃棒⑥托盘天平(带砝码)
(1)、配制时,必须使用的仪器有(填代号),还缺少的仪器是。该试验中两次用到玻璃棒,其作用分别是 , 。
(2)、使用容量瓶前必须进行的一步操作是。(3)、配制溶液时,一般可以分为以下几个步骤: ①称量②计算③溶解④摇匀⑤转移⑥洗涤⑦定容⑧冷却。其正确的操作顺序为。
(4)、在配制过程中,其他操作都正确的,下列操作会引起误差偏高的是。①没有洗涤烧杯和玻璃棒
②未等 溶液冷却至窒温就转移到容量中
③容量瓶不干燥,含有少量蒸馏水
④定容时俯视刻度线
⑤定容时仰视刻度线
25. 实验室可以用 固体和浓盐酸反应制取少量 ,装置如下图所示。请回答下列问题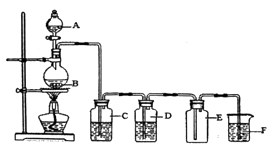 (1)、实验前检查整套装置气密性的方法(2)、C中选用的试剂是饱和食盐水,其作用是
(1)、实验前检查整套装置气密性的方法(2)、C中选用的试剂是饱和食盐水,其作用是D中选用的试剂是 , 其作用是
装置F中的试剂是氢氧化钠溶液,其作用是(用离子方程式表示)。
(3)、B 中发生的化学反应方程式为:该反应中的氧化剂是(填化学式),被氧化的元素是(填元素名称)。
该反应中氧化剂和还原剂的物质的量之比为。
氧化性:MnO2 Cl2 (填“>”、“<”或“=”)。
(4)、每生成标准状况下1.12L ,反应中转移电子的物质的量为。26. 在100mL碳酸钠和硫酸钠的混合溶液中,加入足量的氯化钡溶液,生成白色沉淀4.3g。把沉淀用足量的稀硝酸溶解,再将产生的气体通入足量澄清石灰水中,结果生成了1.0g白色沉淀,求100m1混合溶液中碳酸钠和硫酸钠的物质的量浓度?