湖南省怀化市2017-2018学年高三上学期化学期中考试试卷
试卷更新日期:2018-10-18 类型:期中考试
一、单选题
-
1. “靑蒿一握,以水二升渍,绞取汁”,以此获取靑蒿素用到的分离方法是( )
A、过滤 B、蒸馏 C、蒸发 D、分液2. 既能用浓硫酸又能用碱石灰干燥的气体是( )A、Cl2 B、SO2 C、NO D、NH33. 生活离不开“柴米油盐酱醋茶”,以下有关说法正确的是( )A、柴草是目前主要的新能源 B、用汽油清洗衣物上的油渍利用了乳化原理 C、加碘食盐中加入了I2 D、食醋可用于清洗热水瓶中的水垢4. 下列仪器能用酒精灯火焰直接加热的是( )①试管 ②集气瓶 ③蒸发皿 ④量筒 ⑤烧杯 ⑥燃烧匙
A、①②⑤ B、①③⑥ C、①④⑤⑥ D、②③⑤⑥5. 下列物质的水溶液呈碱性的是( )A、KAlO2 B、KClO4 C、NaHSO4 D、NH4NO36. 下列有关金属的说法中正确的是( )A、生铁比纯铁抗腐蚀能力更强 B、青铜、不锈钢、硬铝都是合金 C、性质越活泼的金属越早被人类冶炼和使用 D、单质铝在空气中比较耐腐蚀,所以铝是不活泼金属7. X、Y、Z、W是4种短周期主族元素,在周期表中的相对位罝如右图,已知Z的单质可用作半导体材料,则以下说法正确的是( ) A、X的气态氢化物的水溶液呈酸性 B、X原子的半径小于Y原子的半径 C、Z的氧化物是生产玻璃的原料之一 D、W单质的水溶液久罝不会变质8. 下列说法正确的是( )A、能使酚酞试液变红的溶液不一定是碱溶液 B、凡需加热的反应一定是吸热反应 C、反应速率越快,反应现象越明显 D、水解反应是放热反应9. 已知:A(g)+B(g)=C(g)+D(l) △H <0,下列图示能表示该反应能量变化的是 (图中E表示能量)( )
A、X的气态氢化物的水溶液呈酸性 B、X原子的半径小于Y原子的半径 C、Z的氧化物是生产玻璃的原料之一 D、W单质的水溶液久罝不会变质8. 下列说法正确的是( )A、能使酚酞试液变红的溶液不一定是碱溶液 B、凡需加热的反应一定是吸热反应 C、反应速率越快,反应现象越明显 D、水解反应是放热反应9. 已知:A(g)+B(g)=C(g)+D(l) △H <0,下列图示能表示该反应能量变化的是 (图中E表示能量)( )
A、 B、
B、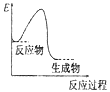 C、
C、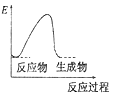 D、
D、 10. 以下说法正确的是( )A、酸雨是pH小于7的雨水 B、H2O与D2O互为同位素 C、滴定管装标准液前应先用标准液润洗2~3次 D、SO2使酸性KMnO4溶液褪色,体现了SO2漂白性11. 一定温度下,在2L固定容积的密闭容器中发生反应:2N2O5(g) 4NO2(g)+O2(g) △H>0,反应物和部分生成物的物质的量随反应时间变化的曲线如图所示,则下列叙述正确的是( )
10. 以下说法正确的是( )A、酸雨是pH小于7的雨水 B、H2O与D2O互为同位素 C、滴定管装标准液前应先用标准液润洗2~3次 D、SO2使酸性KMnO4溶液褪色,体现了SO2漂白性11. 一定温度下,在2L固定容积的密闭容器中发生反应:2N2O5(g) 4NO2(g)+O2(g) △H>0,反应物和部分生成物的物质的量随反应时间变化的曲线如图所示,则下列叙述正确的是( )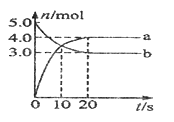 A、曲线b表示NO2的物质的量随反应时间的变化 B、10 s时,正反应速率小于逆反应速率 C、20 s时,正反应速率等于逆反应速率 D、0-20s内平均反应速率v(N2O5)=0.1 mol·L-1·s-112. 常温下,下列各组离子在指定溶液中能大量共存的是( )A、c(H+)/c(OH-)=1012的水溶液中:NH4+、Al3+、NO3-、Cl- B、水电离出的c(H+)=10-l2mol/L 的溶液中:Ca2+、K+、Cl-、HCO3- C、能使甲基橙呈红色的溶液中:Fe2+、NO3-、SO42-、Na+ D、c(Fe3+)=0.1mol/L 的溶液中:K+、ClO-、SO42-、SCN-13. 在配制一定物质的量浓度的盐酸溶液时,下列操作可使所配溶液浓度偏高的是( )A、未将洗涤烧杯和玻璃棒的溶液移入容量瓶 B、用量筒量取浓盐酸时,仰视读数 C、定容时水加多了,加多的水用滴管吸出 D、溶解搅拌时造成液体溅出14. 下列四组热化学方程式,△H1>△H2的是( )
A、曲线b表示NO2的物质的量随反应时间的变化 B、10 s时,正反应速率小于逆反应速率 C、20 s时,正反应速率等于逆反应速率 D、0-20s内平均反应速率v(N2O5)=0.1 mol·L-1·s-112. 常温下,下列各组离子在指定溶液中能大量共存的是( )A、c(H+)/c(OH-)=1012的水溶液中:NH4+、Al3+、NO3-、Cl- B、水电离出的c(H+)=10-l2mol/L 的溶液中:Ca2+、K+、Cl-、HCO3- C、能使甲基橙呈红色的溶液中:Fe2+、NO3-、SO42-、Na+ D、c(Fe3+)=0.1mol/L 的溶液中:K+、ClO-、SO42-、SCN-13. 在配制一定物质的量浓度的盐酸溶液时,下列操作可使所配溶液浓度偏高的是( )A、未将洗涤烧杯和玻璃棒的溶液移入容量瓶 B、用量筒量取浓盐酸时,仰视读数 C、定容时水加多了,加多的水用滴管吸出 D、溶解搅拌时造成液体溅出14. 下列四组热化学方程式,△H1>△H2的是( )①C(s)+O2(g)=CO2(g) △H1 C(s)+ O2(g)=CO(g) △H2
②S(s)+O2(g)=SO2(g) △H1 S(g)+O2(g)=SO2(g) △H2
③CaCO3(s)=CaO(s)+CO2(g) △H1 CaO(s)+H2O(l)=Ca(OH)2(s) △H2
④HCl+NaOH=NaCl+H2O △H1 HCl+NH3·H2O=NH4Cl+H2O △H2
A、①③ B、①④ C、②③ D、②④15. 下列说法正确的是( )A、1L0.1mol·L-1的氨水中含有的NH3与NH4+之和为0.1NA B、标准状况下,2.24LCCl4中含有的C—Cl键数为0.4NA C、l0.0mL18 mol·L-1浓硫酸与足量铜反应,生成SO2的分子数为0.09NA D、标准状况下,Na2O2与足量CO2反应生成2.24LO2 , 转移电子数为0.2NA16. 下列反应的离子方程式正确的是( )A、碳酸氢钠溶液与过量的澄清石灰水反应:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O B、酸性KMnO4溶液与H2O2反应:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O C、硫酸溶液与氢氧化钡溶液混合:H++SO42-+Ba2++OH-=BaSO4↓+ H2O D、氯气溶于水:Cl2+ H2O 2H++Cl-+ClO-17. 已知反应:①Cl2+2KBr=2KCl+Br2 , ②KClO3+6HCl=3Cl2↑+KCl+3H2O。据此判断下列说法正确的是( )A、上述两个反应都是置换反应 B、①中KCl是氧化产物,KBr发生还原反应 C、反应②中还原剂与氧化剂的物质的量之比为5: 1 D、氧化性由强到弱的顺序为:Br2>Cl2>KClO318. 通过下列实验操作及现象不能推出相应结论的是( )选项
实验操作
现象
结论
A
将Na2O2粉末用脱脂棉包裹,向其中吹入CO2
粉末变白,脱脂棉剧烈燃烧
Na2O2与CO2的反应是放热反应
B
向Fe(NO3)3溶液中通入SO2 , 再 滴加BaCl2溶液
产生白色沉淀
氧化性: NO3->Fe3+
C
向2支盛有5 mL相同浓度稀氨水的试管中分别加入5滴0.1mol/L相同浓度的CuCl2溶液 和CaCl2溶液
一支试管中产生蓝色沉淀,另一支无明显现象
Ksp[Cu(OH)2]<
Ksp[Ca(OH)2]
D
|将浓硫酸滴在棉花上
棉花变黑
浓硫酸有脱水性
A、A B、B C、C D、D19. 电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如下图所示,其中阴极和阳极均为惰性气体电极。测得同温同压下,气体甲与气体乙的体积比约为1:2,以下说法正确的是( )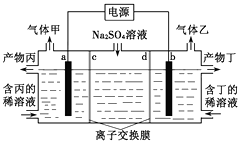 A、a极与电源的负极相连 B、产物丁为硫酸溶液 C、离子交换膜d为阴离子交换膜(允许阴离子通过) D、b电极反立式为2H2O+2e-=2OH-+H2↑20. 向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各离子的物质的量变化如下图所示。
A、a极与电源的负极相连 B、产物丁为硫酸溶液 C、离子交换膜d为阴离子交换膜(允许阴离子通过) D、b电极反立式为2H2O+2e-=2OH-+H2↑20. 向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各离子的物质的量变化如下图所示。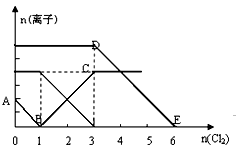
则有关说法错误的是( )
A、线段BC代表Fe3+物质的量的变化 B、原混合溶液中n(FeBr2)=3mol C、通入2mol Cl2反应的离子方程式为:2Fe2++6I-+4Cl2=2Fe3++3I2+8Cl- D、原溶液中 n(Fe2+): n(I-): n(Br-)=2 : 1 : 321. 温度为t℃时,在10mL1.0 mol·L-1的盐酸中,逐滴滴入x mol·L-1的氨水,随着氨水逐渐加入,溶液中的pH变化曲线如图所示(忽略混合时溶液体积的变化,c点时溶液的温度为常温)。则下列有关判断正确的是( )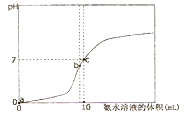 A、b点,c(NH4+)>c(Cl-)>c(H+)>c(OH-) B、a点,水的电离程度最大 C、x=1.0 D、c点时,c(NH3·H2O)=0.5(x-1) mol·L-1
A、b点,c(NH4+)>c(Cl-)>c(H+)>c(OH-) B、a点,水的电离程度最大 C、x=1.0 D、c点时,c(NH3·H2O)=0.5(x-1) mol·L-1二、综合题
-
22. 亚硝酸钠(NaNO2)是一种重要的工业盐,也常用于鱼类、肉类等食品的染色和防腐,易溶于水,微溶于乙醇。某化学兴趣小组对亚硝酸钠与硫酸反应的气体产物成分及NaNO2性质进行如下探究:

已知:①NO+NO2+2OH-=2NO2-+H2O;
②气体液化的温度:NO2:21℃,NO:152℃。
(1)、仪器a的名称是。(2)、若要验证A中反应生成的气体产物成分且又不能污染环境,仪器的连接顺序为(用字母序号从左→右表示):A、C、、、。
(3)、B中NaOH溶液的作用是。(4)、反应前打开弹簧夹,通入一段时间氮气,其目的是;关闭弹簧夹,打开分液漏斗活寒,滴入70%硫酸后,A中产生红棕色气体。(5)、①确认A反应产生的气体中含有NO的现象是:。②A中反应的化学反应方程式为。
(6)、利用所提供的试剂(NaNO2溶液、KMnO4溶液、KI溶液、稀硫酸、淀粉溶液)设计实验,证明酸性条件下NaNO2具有氧化性。23. 铝是重要的金属材料,铝土矿(主要成分Al2O3另含少量的SiO2、Fe2O3等)是工业上制铝的原料。实验室模拟工业上以铝土矿为原料制取铵明矾晶体[NH4Al(SO4)2·12H2O]的工艺流程如下图所示: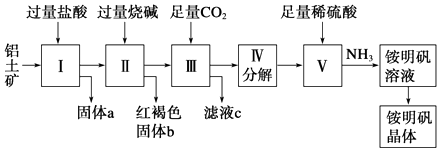
请回答下列问题:
(1)、为提高铝土矿与盐酸的反应速率,可采取的措施有(写两条)。(2)、固体a的主要成分为(写化学式)。(3)、II中烧碱过量的原因是。(4)、写出III中主要反应的离子方程式。(5)、制取铵明矾溶液的化学方程式为;由铵明矾溶液制取铵明矾晶体的实验操作依次为(填操作名称)、、过滤、洗涤。(6)、设计实验证明铵明矾溶液中含有NH4+。24. A、B、C、D、E五种短周期元素的原子序数依次增大;A、B两元素原子最外层电子数之和等于C元素原子最外层电子数;B元素形成的某种单质是自然界中最硬的物质;A与D可以形成原子个数比分别为1:1和2 : 1的两种液态化合物;E的气态氧化物能使品红溶液褪色,加热品红恢复红色。请回答:(1)、E的原子结构示意图为。(2)、可以验证B与E两元素非金属性强弱的方法是(填写字母序号)。A.比较这两种元素的气态氢化物的沸点
B.比较这两种元素的最高价氧化物对应水化物的酸性
C.比较只有这两种元素所形成的简单化合物中元素的化合价
(3)、写出由A、C两种元素组成的原子个数比为2:1的化合物的电子式。(4)、写出由A、B、C、D四种元素组成的离子个数比为1:1的化合物的化学式。(5)、A分别与B、C、D形成的最简单化合物的稳定性由强到弱的顺序为(用化学式表示)。(6)、胶态磁流体在医学上有重要的用途,而纳米级Fe3O4是磁流体中的重要粒子,其制备过程简述如下:①将化合物CA3通入等物质的量的FeSO4、Fe2(SO4)3混合溶液中,生成两种碱,写出该反应的总离子方程式。
②上述反应得到的两种碱在一定条件下继续作用得到Fe3O4 , 写出该反应的化学方程式。
(7)、将8.4gFe加入某浓度的C的最高价氧化物对应水化物的溶液中,充分反应后,Fe无剩余(且滴加KSCN溶液无明显现象),生成标况下的CD和CD2两种气体共4.032L,其中含 CDmol。25. 汽车尾气中通常含有NxOy和CO等大气污染物,科学家寻找高效催化剂实现了汽车尾气的转化进而减少汽车尾气对大气的污染。(1)、已知:①CO的燃烧热△H1=-283kJ·mol-1 ②N2(g)+O2(g) =2NO(g) △H2 =+183kJ·mol-1由此写出NO和CO反应的热化学反应方程式。
(2)、一定温度下,向2L密闭容器中充入4.0mo1NO2和4.0molCO,在催化剂作用下发生反应 4CO(g)+2NO2(g) N2(g)+4CO2(g) △H<0,测得相关数据如下:0 min
5 min
10 min
15 min
20 min
c(NO2)/ mol·L-1
2.0
1.7
1.56
1.5
1.5
C(N2)/ mol·L-1
0
0.15
0.22
0.25
0.25
①5〜10min,用N2的浓度变化表示的反应速率为。
②以下表述能说明该反应己达到平衡状态的是。
A.气体颜色不再变化
B.气体密度不再变化
C.气体平均相对分子质量不再变化
③20 min时,保持温度不变,继续向容器中加入1.0mol NO2和1.0molCO,在t1时刻反应再次达到平衡,则NO2的转化率比原平衡 (填“增大”、“减小”或“不变)。
④该温度下反应的化学平衡常数K= (保留两位有效数字)。
(3)、CO、空气与过量KOH溶液可构成燃料电池(石墨为电极):①写出该电池的负极反应式;
②常温下,用该燃料电池电解(惰性电极)1L饱和食盐水(足量),当两极共生成4.48L (折算为标准状况)气体时电解池溶液的pH=。(忽略溶液的体积变化,已知1g2=0.3,lg5=0.7)