2015-2016学年湖北省襄阳市枣阳二中高一下学期期中化学试卷
试卷更新日期:2017-03-09 类型:期中考试
一、单选题
-
1. 已知胆矾溶于水时溶液的温度降低,胆矾分解的热化学方程式为:CuSO4•5HO2(s)═CuSO4(s)+5H2O(I)1J/mol,室温时若将1mol无水CuSO4溶液时放热Q2J,则( )A、Q1>Q2 B、Q1<Q2 C、Q1=Q2 D、无法比较2. 根据下列热化学方程式,判断氢化物的稳定性顺序正确的是( )
N2(g)+ H2(g)=NH3(g)△H=﹣46.19kJ•mol﹣1
H2(g)+ Cl2(g)=HCl(g)△H=﹣92.36kJ•mol﹣1
I2(g)+ H2(g)=HI(g)△H=﹣4.74kJ•mol﹣1 .
A、HCl>NH3>HI B、HI>HCl>NH3 C、HCl>HI>NH3 D、NH3>HI>HCl3. SF6是一种优良的绝缘气体,分子结构中只存在S﹣F键.已知:1mol S(s)转化为气态硫原子吸收能量280kJ,断裂1mol F﹣F、S﹣F键需吸收的能量分别为160kJ、330kJ.则S(s)+3F2(g)═SF6(g)的反应热△H为( )A、﹣1780kJ/mol B、﹣1220 kJ/mol C、﹣450 kJ/mol D、+430 kJ/mol4. 右图是反应CO(g)+2H2(g)═CH3OH(g)进行过程中的能量变化曲线.下列相关说法正确的是( )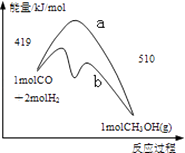 A、该反应是吸热反应 B、使用催化剂后反应热减小 C、热化学方程式为CO(g)+2H2(g)═CH3OH(g)△H=﹣510 kJ•mol﹣1 D、曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化5. 测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.某兴趣小组的实验数值结果大于57.3kJ•mol﹣1(中和热),原因可能是( )
A、该反应是吸热反应 B、使用催化剂后反应热减小 C、热化学方程式为CO(g)+2H2(g)═CH3OH(g)△H=﹣510 kJ•mol﹣1 D、曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化5. 测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.某兴趣小组的实验数值结果大于57.3kJ•mol﹣1(中和热),原因可能是( ) A、实验装置中小烧杯杯中低于大烧杯杯口 B、用浓硫酸代替了稀硫酸 C、分多次把NaOH溶液倒入盛有硫酸的小烧杯中 D、用温度计测定NaOH溶液起始温度后未洗涤,直接测定H2SO4溶液的温度6. 下列关于吸热反应和放热反应的说法正确的是( )A、需加热才能发生的反应一定是吸热反应 B、任何放热反应在常温条件一定能发生 C、反应物和生成物分别具有的总能量决定了反应是放热反应还是吸热反应 D、当△H<0时表明反应为吸热反应7. 已知:①H2O(g)=H2O(l)△H1=﹣a kJ•mol﹣1
A、实验装置中小烧杯杯中低于大烧杯杯口 B、用浓硫酸代替了稀硫酸 C、分多次把NaOH溶液倒入盛有硫酸的小烧杯中 D、用温度计测定NaOH溶液起始温度后未洗涤,直接测定H2SO4溶液的温度6. 下列关于吸热反应和放热反应的说法正确的是( )A、需加热才能发生的反应一定是吸热反应 B、任何放热反应在常温条件一定能发生 C、反应物和生成物分别具有的总能量决定了反应是放热反应还是吸热反应 D、当△H<0时表明反应为吸热反应7. 已知:①H2O(g)=H2O(l)△H1=﹣a kJ•mol﹣1②C2H5OH(g)=C2H5OH(l)△H2=﹣b kJ•mol﹣1
③C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g)△H3=﹣c kJ•mol﹣1
根据盖斯定律判断:若使46g液态无水酒精完全燃烧,最后恢复到室温,则放出的热量为( )
A、(b﹣a﹣c)Kj B、(3a﹣b+c )kJ C、(a﹣3b+c)kJ D、(b﹣3a﹣c)kJ8. 已知:2CO(g)+O2(g)=2CO2(g)△H=﹣566kJ•mol﹣12Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g)△H=﹣452kJ•mol﹣1
根据以上热化学方程式判断,下列说法正确的是( )
A、 图可表示由CO生成CO2的反应过程和能量关系
B、CO的燃烧热为566 kJ/mol
C、Na2O2(s)+CO2(s)=Na2CO3(s)+ O2(g)△H=﹣226 kJ/mol
D、CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为2×6.02×1023
9. 下列依据热化学方程式得出的结论正确的是( )A、已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 B、氢气的燃烧热为285.5 kJ•mol﹣1 , 则水分解的热化学方程式2H2O(l)=2H2(g)+O2(g)△H=+285.5 kJ•mol﹣1 C、已知稀溶液中,H+(aq)+OH﹣(aq)=H2O(l)△H=﹣57.3 kJ•mol﹣1 , 则浓硫酸与稀NaOH溶液反应生成1 mol水时放出的热量为57.3 kJ D、密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量.则Fe(s)+S(s)=FeS(s)△H=﹣95.6 kJ•mol﹣110. 下列说法不正确的是( )A、电解池的反应属于自发过程 B、化学反应热效应数值与参加反应的物质多少有关 C、化学反应过程中的能量变化除了热能外,也可以是光能、电能等 D、热化学方程式中的化学计量数只表示物质的量,可以是分数11. 一定温度下,在三个体积约为1.0L的恒容密闭容器中发生反应:2CH3OH(g)⇌CH3OCH3(g)+H2O(g)
图可表示由CO生成CO2的反应过程和能量关系
B、CO的燃烧热为566 kJ/mol
C、Na2O2(s)+CO2(s)=Na2CO3(s)+ O2(g)△H=﹣226 kJ/mol
D、CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为2×6.02×1023
9. 下列依据热化学方程式得出的结论正确的是( )A、已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 B、氢气的燃烧热为285.5 kJ•mol﹣1 , 则水分解的热化学方程式2H2O(l)=2H2(g)+O2(g)△H=+285.5 kJ•mol﹣1 C、已知稀溶液中,H+(aq)+OH﹣(aq)=H2O(l)△H=﹣57.3 kJ•mol﹣1 , 则浓硫酸与稀NaOH溶液反应生成1 mol水时放出的热量为57.3 kJ D、密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量.则Fe(s)+S(s)=FeS(s)△H=﹣95.6 kJ•mol﹣110. 下列说法不正确的是( )A、电解池的反应属于自发过程 B、化学反应热效应数值与参加反应的物质多少有关 C、化学反应过程中的能量变化除了热能外,也可以是光能、电能等 D、热化学方程式中的化学计量数只表示物质的量,可以是分数11. 一定温度下,在三个体积约为1.0L的恒容密闭容器中发生反应:2CH3OH(g)⇌CH3OCH3(g)+H2O(g)容器编号
温度(℃)
起始物质的量(mol)
平衡物质的量(mol)
CH3OH(g)
CH3OCH3(g)
H2O(g)
I
387
0.20
0.080
0.080
Ⅱ
387
0.40
Ⅲ
207
0.20
0.090
0.090
下列说法正确的是( )
A、该反应的正方应为吸热反应 B、若起始时向容器I中充入CH3OH 0.1mol、CH3OCH3 0.15mol和H2O 0.10mol,则反应将向正反应方向进行 C、容器I中反应达到平衡所需时间比容器Ⅲ中的长 D、达到平衡时,容器I中的CH3OH体积分数比容器Ⅱ中的小12. 对于可逆反应:2A(g)+B(g)⇌2C(g)△H<0,下列各图中正确的是( )A、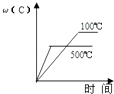 B、
B、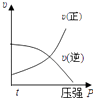 C、
C、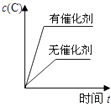 D、
D、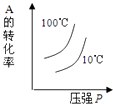 13. 将KO2放入密闭的真空容器中,一定条件下,发生反应:4KO2(s)⇌2K2O(s)+3O2(g),达到平衡后,保持温度不变,缩小容器体积,重新达到平衡.下列说法正确的是( )A、容器压强增大 B、氧气浓度不变 C、KO2的量保持不变 D、平衡常数增大14. 经一定时间后,可逆反应aA+bB⇌cC中物质的含量A%和C%随温度的变化曲线如图所示.下列说法正确的是( )
13. 将KO2放入密闭的真空容器中,一定条件下,发生反应:4KO2(s)⇌2K2O(s)+3O2(g),达到平衡后,保持温度不变,缩小容器体积,重新达到平衡.下列说法正确的是( )A、容器压强增大 B、氧气浓度不变 C、KO2的量保持不变 D、平衡常数增大14. 经一定时间后,可逆反应aA+bB⇌cC中物质的含量A%和C%随温度的变化曲线如图所示.下列说法正确的是( ) A、该反应在T1、T3温度时达到化学平衡 B、该反应在T2温度时达到化学平衡 C、该反应的逆反应是放热反应 D、升高温度,平衡会向正反应方向移动15. 对于可逆反应N2(g)+3H2(g)⇌2NH3(g)△H<0,下列研究目的和示意图相符的是( )
A、该反应在T1、T3温度时达到化学平衡 B、该反应在T2温度时达到化学平衡 C、该反应的逆反应是放热反应 D、升高温度,平衡会向正反应方向移动15. 对于可逆反应N2(g)+3H2(g)⇌2NH3(g)△H<0,下列研究目的和示意图相符的是( )A
B
C
D
研究目的
压强对反应的影响(P2>P1)
温度对反应的影响
平衡体系增加N2对反应的影响
催化剂对反应的影响
图示



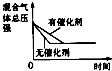 A、A B、B C、C D、D16. 一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示.下列判断正确的是( )
A、A B、B C、C D、D16. 一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示.下列判断正确的是( ) A、在0﹣50min之间,pH=2 和 pH=7 时 R 的降解百分率相等 B、溶液酸性越强,R 的降解速率越小 C、R的起始浓度越小,降解速率越大 D、在 20﹣25min之间,pH=10 时 R 的平均降解速率为 0.04mol•L﹣1•min﹣117. 某恒温恒容的容器中,建立如下平衡:2X(g)⇌Y(g),在相同条件下,若分别再向容器中通入一定量的X气体或Y气体,重新达到平衡后,容器内X的体积分数比原平衡时( )A、都增大 B、都减小 C、前者增大后者减小 D、前者减小后者增大18. 一定温度下,在三个体积约为1.0L的恒容密闭容器中发生反应:2CH3OH(g)═CH3OCH3(g)+H2O(g)
A、在0﹣50min之间,pH=2 和 pH=7 时 R 的降解百分率相等 B、溶液酸性越强,R 的降解速率越小 C、R的起始浓度越小,降解速率越大 D、在 20﹣25min之间,pH=10 时 R 的平均降解速率为 0.04mol•L﹣1•min﹣117. 某恒温恒容的容器中,建立如下平衡:2X(g)⇌Y(g),在相同条件下,若分别再向容器中通入一定量的X气体或Y气体,重新达到平衡后,容器内X的体积分数比原平衡时( )A、都增大 B、都减小 C、前者增大后者减小 D、前者减小后者增大18. 一定温度下,在三个体积约为1.0L的恒容密闭容器中发生反应:2CH3OH(g)═CH3OCH3(g)+H2O(g)下列说法正确的是( )
容器
编号
温度(℃)
起始物质的量(mol)
平衡物质的量(mol)
CH3OH(g)
CH3OCH3(g)
H2O(g)
I
387
0.20
0.080
0.080
Ⅱ
387
0.40
Ⅲ
207
0.20
0.090
0.090
A、该反应的正方应为吸热反应 B、达到平衡时,容器I中的CH3OH体积分数比容器Ⅱ中的小 C、容器I中反应达到平衡所需时间比容器Ⅲ中的长 D、若起始时向容器I中充入CH3OH 0.1mol、CH3OCH30.15mol和H2O 0.10mol,则反应将向正反应方向进行19. 印染工业常用亚氯酸钠(NaClO2)漂白织物.亚氯酸钠在溶液中可生成ClO2、HClO2、 ,其中HClO2是漂白剂的有效成分,ClO2是有毒气体.各组分含量随pH变化如图所示,由图可知,使用该漂白剂的最佳pH为( ) A、3.0 B、4.0~4.5 C、6.5~7.0 D、9.020. 低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:2NH3(g)+NO(g)+NO2(g) 2N2(g)+3H2O(g)△H<0在恒容的密闭容器中,下列有关说法正确的是( )A、平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 B、平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小 C、单位时间内消耗NO和N2的物质的量比为1:2时,反应达到平衡 D、其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大21. 还原沉淀法是处理含铬(含Cr2O72﹣和CrO42﹣)工业废水的常用方法,过程如下:
A、3.0 B、4.0~4.5 C、6.5~7.0 D、9.020. 低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:2NH3(g)+NO(g)+NO2(g) 2N2(g)+3H2O(g)△H<0在恒容的密闭容器中,下列有关说法正确的是( )A、平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 B、平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小 C、单位时间内消耗NO和N2的物质的量比为1:2时,反应达到平衡 D、其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大21. 还原沉淀法是处理含铬(含Cr2O72﹣和CrO42﹣)工业废水的常用方法,过程如下:CrO42﹣ Cr2O72﹣ Cr3+ Cr(OH)3↓
已知转化过程中的反应为:2CrO42﹣(aq)+2H+(aq)═Cr2O72﹣(aq)+H2O(1).转化后所得溶液中铬元素含量为28.6g/L,CrO42﹣有10/11转化为Cr2O72﹣ . 下列说法不正确的是( )
A、转化过程中,增大c(H+),平衡向正反应方向移动,CrO42﹣的转化率提高 B、常温下Ksp[Cr(OH)3]=1×10﹣32 , 要使处理后废水中c(Cr3+)降至1×10﹣5mol/L,应调溶液的pH=5 C、若用绿矾(FeSO4•7H2O)(M=278)作还原剂,处理1L废水,至少需要917.4g D、常温下转化反应的平衡常数K=104 , 则转化后所得溶液的pH=122. 温室下,用0.1mol•L﹣1NaOH溶液分别滴定体积均为20mL浓度均为0.1mol•L﹣1HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化图,下列说法不正确的是( ) A、HX为弱酸 B、M点c(HX)﹣c(X﹣)>c(OH﹣)﹣c(H+) C、将P点和N点的溶液为混合,呈酸性 D、向N点溶液中通入HCl至pH=7:c(Na+)>c(HX)=c(Cl﹣)>c(X﹣)23. 一定温度下,水溶液中H+和OH﹣的浓度变化曲线如图,下列说法正确的是( )
A、HX为弱酸 B、M点c(HX)﹣c(X﹣)>c(OH﹣)﹣c(H+) C、将P点和N点的溶液为混合,呈酸性 D、向N点溶液中通入HCl至pH=7:c(Na+)>c(HX)=c(Cl﹣)>c(X﹣)23. 一定温度下,水溶液中H+和OH﹣的浓度变化曲线如图,下列说法正确的是( )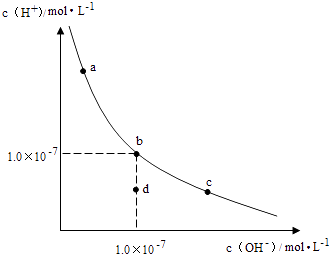 A、升高温度,可能引起由c向b的变化 B、该温度下,水的离子积常数为1.0×10﹣13 C、该温度下,加入FeCl3可能引起由b向a的变化 D、该温度下,稀释溶液可能引起由c向d的变化24. 下列图示与对应的叙述相符的是( )A、
A、升高温度,可能引起由c向b的变化 B、该温度下,水的离子积常数为1.0×10﹣13 C、该温度下,加入FeCl3可能引起由b向a的变化 D、该温度下,稀释溶液可能引起由c向d的变化24. 下列图示与对应的叙述相符的是( )A、 图中可以看出反应A(g)=C(g)的△H=(E1﹣E4)kJ•mol﹣1
B、
图中可以看出反应A(g)=C(g)的△H=(E1﹣E4)kJ•mol﹣1
B、 图中表示一定条件下进行的反应2SO2+O2═2SO3各成分的物质的量变化,t2时刻改变的条件可能是扩大了容器的体积
C、
图中表示一定条件下进行的反应2SO2+O2═2SO3各成分的物质的量变化,t2时刻改变的条件可能是扩大了容器的体积
C、 图中表示将CO2通入NaOH的稀溶液中,随着CO2的通入,溶液中水电离出的c(H+)变化关系
D、
图中表示将CO2通入NaOH的稀溶液中,随着CO2的通入,溶液中水电离出的c(H+)变化关系
D、 图中曲线表示用0.1000mol/L NaOH溶液分别滴定浓度相同的三种一元酸,由此可判断HX的酸性最强
25. 常温下,下列关于电解质溶液的说法正确的是( )A、将pH=4 CH3COOH溶液加水稀释10倍,溶液中各种离子浓度均减小 B、用 CH3COOH溶液滴定等物质的量浓度的NaOH溶液至中性,V(CH3COOH溶液)<V(NaOH溶液) C、向0.2 mol•L﹣1的盐酸溶液中加入等体积0.1 mol•L﹣1NH3•H2O溶液:c(Cl﹣)+c(OH﹣)═c(H+)+c(NH3•H2O) D、在含0.1mol NaHSO4溶液中:c(H+)═c(SO42﹣)+c(OH﹣)26. pH=2的X,Y,Z三种酸的溶液各1mL,分别加水稀释到1 000mL,其pH与溶液体积(V)的变化关系如图所示,下列说法错误的是( )
图中曲线表示用0.1000mol/L NaOH溶液分别滴定浓度相同的三种一元酸,由此可判断HX的酸性最强
25. 常温下,下列关于电解质溶液的说法正确的是( )A、将pH=4 CH3COOH溶液加水稀释10倍,溶液中各种离子浓度均减小 B、用 CH3COOH溶液滴定等物质的量浓度的NaOH溶液至中性,V(CH3COOH溶液)<V(NaOH溶液) C、向0.2 mol•L﹣1的盐酸溶液中加入等体积0.1 mol•L﹣1NH3•H2O溶液:c(Cl﹣)+c(OH﹣)═c(H+)+c(NH3•H2O) D、在含0.1mol NaHSO4溶液中:c(H+)═c(SO42﹣)+c(OH﹣)26. pH=2的X,Y,Z三种酸的溶液各1mL,分别加水稀释到1 000mL,其pH与溶液体积(V)的变化关系如图所示,下列说法错误的是( ) A、X是强酸,Y和Z是弱酸 B、稀释前的浓度大小为c(Z)>c(Y)>c(X) C、稀释前电离程度大小为X>Y>Z D、pH=2时,X,Y,Z都是稀溶液27. 已知液氨的性质与水相似,25℃时,NH3+NH3⇌NH +NH ,NH 的平衡浓度为1×10﹣15mol•L﹣1 , 则下列说法中正确的是( )A、在液氨中加入NaNH2可使液氨的离子积变大 B、在液氨中加入NH4Cl可使液氨的离子积减小 C、在此温度下液氨的离子积为1×10﹣17 D、在液氨中放入金属钠,可生成NaNH228. c(OH﹣)相同的氢氧化钠溶液和氨水,分别用蒸馏水稀释至原体积的m倍和n倍,若稀释后两溶液的c(OH﹣)仍相同,则m和n的关系是( )A、m>n B、m=n C、m<n D、不能确定29. 80℃,0.1mol/L NaHB溶液中c(H+)>c(OH﹣),可能正确的关系是( )A、c(Na+)+c(H+)=c(HB﹣)+2c(B2﹣) B、溶液的pH=1 C、c(H+)∙c(OH﹣)=10﹣14 D、c(Na+)=c(H2B)+c(HB﹣)30. 25℃时,用0.0500mol•L﹣1H2C2O4(二元弱酸)溶液滴定25.00mL0.1000mol•L﹣1NaOH溶液所得滴定曲线如图.下列说法正确的是( )
A、X是强酸,Y和Z是弱酸 B、稀释前的浓度大小为c(Z)>c(Y)>c(X) C、稀释前电离程度大小为X>Y>Z D、pH=2时,X,Y,Z都是稀溶液27. 已知液氨的性质与水相似,25℃时,NH3+NH3⇌NH +NH ,NH 的平衡浓度为1×10﹣15mol•L﹣1 , 则下列说法中正确的是( )A、在液氨中加入NaNH2可使液氨的离子积变大 B、在液氨中加入NH4Cl可使液氨的离子积减小 C、在此温度下液氨的离子积为1×10﹣17 D、在液氨中放入金属钠,可生成NaNH228. c(OH﹣)相同的氢氧化钠溶液和氨水,分别用蒸馏水稀释至原体积的m倍和n倍,若稀释后两溶液的c(OH﹣)仍相同,则m和n的关系是( )A、m>n B、m=n C、m<n D、不能确定29. 80℃,0.1mol/L NaHB溶液中c(H+)>c(OH﹣),可能正确的关系是( )A、c(Na+)+c(H+)=c(HB﹣)+2c(B2﹣) B、溶液的pH=1 C、c(H+)∙c(OH﹣)=10﹣14 D、c(Na+)=c(H2B)+c(HB﹣)30. 25℃时,用0.0500mol•L﹣1H2C2O4(二元弱酸)溶液滴定25.00mL0.1000mol•L﹣1NaOH溶液所得滴定曲线如图.下列说法正确的是( )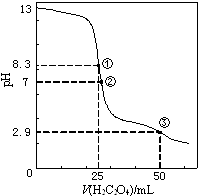 A、点①所示溶液中:c(H+)+c(H2C2O4)+c(HC2O4﹣)=c(OH﹣) B、点②所示溶液中:c(HC2O4﹣)+2c(C2O42﹣)=c(Na+)+c(H+) C、点③所示溶液中:c(Na+)>c(HC2O4﹣)>c(H2C2O4)>c(C2O42﹣) D、滴定过程中可能出现:c(Na+)>c(C2O42﹣)=c(HC2O4﹣)>c(H+)>c(OH﹣)
A、点①所示溶液中:c(H+)+c(H2C2O4)+c(HC2O4﹣)=c(OH﹣) B、点②所示溶液中:c(HC2O4﹣)+2c(C2O42﹣)=c(Na+)+c(H+) C、点③所示溶液中:c(Na+)>c(HC2O4﹣)>c(H2C2O4)>c(C2O42﹣) D、滴定过程中可能出现:c(Na+)>c(C2O42﹣)=c(HC2O4﹣)>c(H+)>c(OH﹣)二、填空题
-
31. 某元素的原子序数为24,试问:(1)、此元素原子的电子总数是个.(2)、它有个电子层,有个能级.(3)、它的价电子构型是 , 它的价电子数是 .(4)、它属于第周期,是 (填主族或副族)(5)、它的未成对电子有个.32. 下表是元素周期表的一部分,回答下列有关问题:
 (1)、写出下列元素符号:① , ⑥ , ⑦ .(2)、画出原子的结构示意图:④ , ⑧ .(3)、在①~12元素中,金属性最强的元素是 , 非金属性最强的元素是 , 最不活泼的元素是 . (均填元素符号)(4)、元素⑦与元素⑧相比,非金属性较强的是(用元素符号表示),下列表述中能证明这一事实的是 .
(1)、写出下列元素符号:① , ⑥ , ⑦ .(2)、画出原子的结构示意图:④ , ⑧ .(3)、在①~12元素中,金属性最强的元素是 , 非金属性最强的元素是 , 最不活泼的元素是 . (均填元素符号)(4)、元素⑦与元素⑧相比,非金属性较强的是(用元素符号表示),下列表述中能证明这一事实的是 .a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(5)、第三周期中原子半径最大的元素是(填序号),跟它同周期原子半径最小的元素是(填序号),它们可以形成(填离子或共价)化合物,用电子式表示其形成过程如下: .(6)、已知某元素原子最外层电子数是其次外层电子数的2倍,该元素可以与⑧形成一种AB4型的化合物,请用电子式表示其形成过程: .33. X,Y,Z,R,M是元素周期表中原子序数依次增大的五种短周期元素,其相关信息如下表:元素
相关信息
X
X的一种核素的原子核中没有中子
Y
Y原子的核外电子占据4个原子轨道
Z
Z的气态氢化物能使湿润的红色石蕊试纸变蓝
R
R是地壳中含量最高的元素
M
M的单质与冷水剧烈反应,生成的强碱中含有电子数相同的阴阳离子
(1)、Y,Z,R的第一电离能从大到小的顺序是(填元素符号)(2)、Z,R的最简单氢化物中稳定性强的是 , 沸点高的是(填化学式)(3)、甲是由上述3种元素组成的常见化合物,常温下pH=3的甲溶液中由水电离c(H+)=10﹣3mol/L,则甲的化学式是 .(4)、直线型分子Y2Z2中所有原子都达到8电子稳定结构,则分子中σ键与π键的个数之比是 .(5)、常温下0.58gY4H10完全燃烧放出29kJ的热量,请写出Y4H10燃烧热的热化学方程式 .