2015-2016学年山东省德州市武城二中高一下学期期末化学模拟试卷(二)
试卷更新日期:2017-03-09 类型:期末考试
一、选择题
-
1. 已知在周期表中第118号元素位于周期表的第七周期0族,预测第114号元素的下列叙述中,错误的是( )A、位于周期表的第七周期第ⅣA族 B、原子的最外层有4个电子 C、肯定是非金属元素 D、常见的化合价有+2和+4价2. 下表是部分短周期元素的原子半径及主要化合价,根据表中信息,判断以下叙述正确的是( )
元素代号
L
M
Q
R
T
原子半径/nm
0.160
0.143
0.086
0.102
0.074
主要化合价
+2
+3
+2
+6、﹣2
﹣2
A、L、R形成的简单离子核外电子数不相等 B、单质与浓度相等的稀盐酸反应的速率为Q>L C、氢化物的稳定性为H2T<H2R D、M与T形成的化合物既能与强酸反应又能与强碱反应3. 下列实验不能达到预期目的是( )序号
实验操作
实验目的
A
Cl2、Br2分别与H2反应
比较氯、溴的非金属性强弱
B
MgCl2、AlCl3溶液中分别通入NH3
比较镁、铝的金属性强弱
C
测定相同浓度H2CO3、H2SO4两溶液的酸性
比较碳、硫的非金属性强弱
D
Fe、Cu分别与盐酸反应
比较铁、铜的金属性强弱
A、A B、B C、C D、D4. 化学能与热能、电能等能相互转化.关于化学能与其他能量相互转化的说法正确的是( ) A、图1所示的装置能将化学能转变为电能 B、图2所示的反应为吸热反应 C、中和反应中,反应物的总能量比生成物的总能量低 D、化学反应中能量变化的主要原因是化学键的断裂与生成5. 实验室里有200mLCH3COOCH2CH3 , 经检验,发现其中溶有少量CH3COOH.如果要除去这些CH3COOH,请选择下列中的有效方法( )A、蒸馏 B、水洗后分液 C、用过量饱和Na2CO3溶液洗涤后分液 D、用过量NaCl溶液洗涤后分液6. 有两种气态烷烃的混合物,在标准状况下其密度为1.16g•L﹣1 , 则关于此混合物组成的说法正确的是( )A、一定有甲烷 B、一定有乙烷 C、可能是甲烷和乙烷的混合物 D、可能是乙烷和丙烷的混合物7. 下列物质中,含有非极性键的共价化合物是( )A、Na2O2 B、CH3CH3 C、NaCl D、N28. 反应A+B→C(放热)分两步进行:①A+B→X(吸热),②X→C(放热).下列示意图中,能正确表示总反应过程中能量变化的是( )A、
A、图1所示的装置能将化学能转变为电能 B、图2所示的反应为吸热反应 C、中和反应中,反应物的总能量比生成物的总能量低 D、化学反应中能量变化的主要原因是化学键的断裂与生成5. 实验室里有200mLCH3COOCH2CH3 , 经检验,发现其中溶有少量CH3COOH.如果要除去这些CH3COOH,请选择下列中的有效方法( )A、蒸馏 B、水洗后分液 C、用过量饱和Na2CO3溶液洗涤后分液 D、用过量NaCl溶液洗涤后分液6. 有两种气态烷烃的混合物,在标准状况下其密度为1.16g•L﹣1 , 则关于此混合物组成的说法正确的是( )A、一定有甲烷 B、一定有乙烷 C、可能是甲烷和乙烷的混合物 D、可能是乙烷和丙烷的混合物7. 下列物质中,含有非极性键的共价化合物是( )A、Na2O2 B、CH3CH3 C、NaCl D、N28. 反应A+B→C(放热)分两步进行:①A+B→X(吸热),②X→C(放热).下列示意图中,能正确表示总反应过程中能量变化的是( )A、 B、
B、 C、
C、 D、
D、 9. 下列关于苯的叙述正确的是( )
9. 下列关于苯的叙述正确的是( ) A、反应①为取代反应,有机产物的密度比水小 B、反应②为氧化反应,反应现象是火焰明亮并带有较多的黑烟 C、反应③为取代反应,有机产物是一种烃 D、反应④1mol苯最多与3molH2发生加成反应,是因为苯分子含有三个碳酸双键10. 下列关于酒精的叙述错误的是( )A、化学名称为乙醇 B、易挥发 C、常用作有机溶剂 D、不能被酸性高锰酸钾氧化11. 如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图.下列说法正确的是( )
A、反应①为取代反应,有机产物的密度比水小 B、反应②为氧化反应,反应现象是火焰明亮并带有较多的黑烟 C、反应③为取代反应,有机产物是一种烃 D、反应④1mol苯最多与3molH2发生加成反应,是因为苯分子含有三个碳酸双键10. 下列关于酒精的叙述错误的是( )A、化学名称为乙醇 B、易挥发 C、常用作有机溶剂 D、不能被酸性高锰酸钾氧化11. 如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图.下列说法正确的是( ) A、X和R在同一周期 B、原子半径:W>R>X C、气态氢化物的稳定性:Y>X D、X,Z形成的化合物中只有离子键12. 下列说法不正确的是( )A、使用催化剂,可以加快反应速率 B、可逆反应A(g)⇌B(g)+C(g),增大压强正反应速率和逆反应速率增大 C、对达到平衡的一个放热的可逆反应,若降低温度正反应速率减小,逆反应速率增大 D、参加反应物质的性质是决定化学反应速率的主要因素13. 在塑料袋中放一个成熟的苹果,再放些青香蕉,将袋口密封.两天后,发现青香蕉成熟了.导致青香蕉成熟的物质是成熟苹果释放出的( )A、C2H4 B、CH3COOH C、C6H6 D、CH3CH2OH14. a、b、c、d、e为元素周期表前3周期中的部分元素,它们在元素周期表中的相对位置如图所示.下列叙述正确的是( )
A、X和R在同一周期 B、原子半径:W>R>X C、气态氢化物的稳定性:Y>X D、X,Z形成的化合物中只有离子键12. 下列说法不正确的是( )A、使用催化剂,可以加快反应速率 B、可逆反应A(g)⇌B(g)+C(g),增大压强正反应速率和逆反应速率增大 C、对达到平衡的一个放热的可逆反应,若降低温度正反应速率减小,逆反应速率增大 D、参加反应物质的性质是决定化学反应速率的主要因素13. 在塑料袋中放一个成熟的苹果,再放些青香蕉,将袋口密封.两天后,发现青香蕉成熟了.导致青香蕉成熟的物质是成熟苹果释放出的( )A、C2H4 B、CH3COOH C、C6H6 D、CH3CH2OH14. a、b、c、d、e为元素周期表前3周期中的部分元素,它们在元素周期表中的相对位置如图所示.下列叙述正确的是( ) A、b元素除0价外,只有一种化合价 B、五种元素中,c元素的性质最稳定 C、d气态氢化物溶于水,溶液显碱性 D、e元素最高价氧化物对应的水化物和不同量的氢氧化钠反应,可能生成三种盐15. 下列说法中正确的是( )A、纯净物中一定存在化学键 B、阴、阳离子间通过静电引力而形成的化学键叫做离子键 C、只有金属元素和非金属元素化合时才能形成离子键 D、离子化合物中可能含共价键,共价化合物中不含离子键16. 诗句“春蚕到死丝方尽,蜡炬成灰泪始干”中“丝”和“泪”分别指( )A、纤维素、油脂 B、蛋白质、烃类 C、淀粉、油脂 D、蛋白质、油脂17. 根据原子结构及元素周期律的知识,下列推断正确的是( )A、同主族元素含氧酸的酸性随核电荷数的增加而减弱 B、核外电子排布相同的微粒化学性质也相同 C、Cl﹣ , S2﹣ , Ca2+ , K+半径逐渐减小 D、 与 得电子能力相同18. 下列各个装置中能组成原电池的是( )A、
A、b元素除0价外,只有一种化合价 B、五种元素中,c元素的性质最稳定 C、d气态氢化物溶于水,溶液显碱性 D、e元素最高价氧化物对应的水化物和不同量的氢氧化钠反应,可能生成三种盐15. 下列说法中正确的是( )A、纯净物中一定存在化学键 B、阴、阳离子间通过静电引力而形成的化学键叫做离子键 C、只有金属元素和非金属元素化合时才能形成离子键 D、离子化合物中可能含共价键,共价化合物中不含离子键16. 诗句“春蚕到死丝方尽,蜡炬成灰泪始干”中“丝”和“泪”分别指( )A、纤维素、油脂 B、蛋白质、烃类 C、淀粉、油脂 D、蛋白质、油脂17. 根据原子结构及元素周期律的知识,下列推断正确的是( )A、同主族元素含氧酸的酸性随核电荷数的增加而减弱 B、核外电子排布相同的微粒化学性质也相同 C、Cl﹣ , S2﹣ , Ca2+ , K+半径逐渐减小 D、 与 得电子能力相同18. 下列各个装置中能组成原电池的是( )A、 B、
B、 C、
C、 D、
D、 19. 实验是化学研究的基础,关于下列各实验装置图的叙述中,正确的是( )
19. 实验是化学研究的基础,关于下列各实验装置图的叙述中,正确的是( )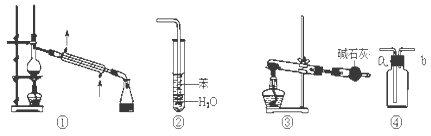 A、装置①常用于分离沸点不同的液体混合物 B、装置②用于吸收氨气,能够防止倒吸 C、以NH4Cl为原料,装置③可制备少量NH3 D、装置④a口进气可收集Cl2、NO等气20. 下列与有机物结构、性质相关的叙述中,正确的是( )A、甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 B、粮食酿造的酒一定温度下密封存放时间越长香味越浓,是因为有酯生成 C、乙醇、乙酸均能与Na反应放出H2 , 二者分子中官能团相同 D、石油化工中的分馏、裂化、裂解都是通过化学反应来获得轻质油、气体烯烃21. 某小组为研究电化学原理,设计如图装置.下列叙述不正确的是( )
A、装置①常用于分离沸点不同的液体混合物 B、装置②用于吸收氨气,能够防止倒吸 C、以NH4Cl为原料,装置③可制备少量NH3 D、装置④a口进气可收集Cl2、NO等气20. 下列与有机物结构、性质相关的叙述中,正确的是( )A、甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 B、粮食酿造的酒一定温度下密封存放时间越长香味越浓,是因为有酯生成 C、乙醇、乙酸均能与Na反应放出H2 , 二者分子中官能团相同 D、石油化工中的分馏、裂化、裂解都是通过化学反应来获得轻质油、气体烯烃21. 某小组为研究电化学原理,设计如图装置.下列叙述不正确的是( ) A、a 和 b 不连接时,铁片上会有金属铜析出 B、a 和 b 用导线连接时,铜片上发生的反应为:Cu2++2e﹣═Cu C、无论a和b是否连接,铁片均会溶解 D、a和b用导线连接后,Fe片上发生还原反应,溶液中的Cu2+向铜电极移动22. 下列物质的电子式书写正确的是( )A、N2的电子式:
A、a 和 b 不连接时,铁片上会有金属铜析出 B、a 和 b 用导线连接时,铜片上发生的反应为:Cu2++2e﹣═Cu C、无论a和b是否连接,铁片均会溶解 D、a和b用导线连接后,Fe片上发生还原反应,溶液中的Cu2+向铜电极移动22. 下列物质的电子式书写正确的是( )A、N2的电子式: B、Na2O2的电子式:
B、Na2O2的电子式:  C、CO2的电子式:
C、CO2的电子式:  D、NH4Cl的电子式:
D、NH4Cl的电子式:  23. 元素性质呈周期性变化的根本原因是( )A、核外电子排布呈周期性变化 B、元素的相对原子质量逐渐增大 C、核电荷数逐渐增大 D、元素化合价呈周期性变化
23. 元素性质呈周期性变化的根本原因是( )A、核外电子排布呈周期性变化 B、元素的相对原子质量逐渐增大 C、核电荷数逐渐增大 D、元素化合价呈周期性变化二、解答题
-
24. 海洋资源的利用具有广阔前景(1)、如图是从海水中提取镁的简单流程.

工业上常用于沉淀Mg2+的试剂A是 , Mg(OH)2转化为MgCl2的离子方程式是 .
(2)、海带灰中富含以I﹣形式存在的碘元素,实验室提取I2的途径如下所示:干海带 海带灰 滤液 I2
①灼烧海带至灰烬时所用的主要仪器名称是 .
②反应结束后,加入CCl4作萃取剂,采用萃取﹣分液的方法从碘水中提取碘,主要操作步骤如图:

甲、乙、丙3步实验操作中,不正确的是(填“甲”、“乙”或“丙”).
25. A是化学实验室中常见的有机物,它易溶于水并有特殊香味,B的产量可衡量一个国家石油化工发展的水平,并能进行如图所示的多种反应. (1)、写出A的化学式(2)、写出下列反应的化学方程式
(1)、写出A的化学式(2)、写出下列反应的化学方程式反应①:
反应③:
反应④:
(3)、比较反应①与钠和水反应的现象有什么相同和不同相同点:
不同点: .
26. 某温度下,在2L容器中3种物质间进行反应,X,Y,Z的物质的量随时间的变化曲线如图.反应在t1 min时到达平衡,如图所示: (1)、该反应的化学方程式是 .(2)、①若上述反应中X,Y,Z分别为NH3、H2、N2 , 且已知1mol 氨气分解成氮气和氢气要吸收46kJ的热量,则至t1 min时,该反应吸收的热量为;在此t1 min时间内,用H2表示反应的平均速率v(H2)为 .
(1)、该反应的化学方程式是 .(2)、①若上述反应中X,Y,Z分别为NH3、H2、N2 , 且已知1mol 氨气分解成氮气和氢气要吸收46kJ的热量,则至t1 min时,该反应吸收的热量为;在此t1 min时间内,用H2表示反应的平均速率v(H2)为 .