第12讲:氮及其化合物
试卷更新日期:2018-10-12 类型:一轮复习
一、单选题
-
1. 下列气体不能用排空气法收集而要用排水法收集的是( )A、NO2 B、H2 C、NH3 D、NO2. 关于氮族元素的说法中正确的是( )A、最高正价都是+5价,最低负价都是﹣3价 B、随着原子序数的增大,原子半径逐渐增大 C、单质的熔、沸点随着原子序数的增大而增大 D、所形成的气态氢化物,以BiH3最不稳定3. 将一铁、铜混合物粉末平均分成三等份,分别加入到同浓度、不同体积的稀硝酸中,充分反应后,收集到NO气体的体积及剩余固体的质量如表 (设反应前后溶液的体积不变,气体体积已换算为标准状况时的体积):
实验序号
稀硝酸的体积/mL
剩余固体的质量/g
NO的体积/L
1
100
17.2
2.24
2
200
8.00
4.48
3
400
0
V
下列说法正确的是( )
A、表中V=7.84 L B、原混合物粉末的质量为25.6 g C、原混合物粉未中铁和铜的物质的量之比为2:3 D、实验3所得溶液中硝酸的物质的量浓度为0.875 mol•L﹣14. 雷雨时,空气中的氮气和氧气可生成氮的氧化物,该氧化物进一步反应后遇水变成A、NO2 B、HNO3 C、H2SO4 D、NH3 . H2O5. 下列有关氨和铵盐的说法正确的是( )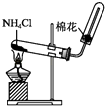 A、氨和铵盐都易溶于水,都能生成NH4+ B、铵态氮肥与碱性物质如草木灰混合施用肥效更高 C、实验室制备氨气的试剂和装置可为如图装置 D、工业上用氨气液化需吸收热量的过程做制冷剂6. 向200 mL 2 mol·L-1 HNO3溶液中,逐渐加入铁粉至过量(假设生成的气体只有一种),在此过程中,n(Fe2+)随n(Fe)变化如右图所示。下列有关说法正确的是( )
A、氨和铵盐都易溶于水,都能生成NH4+ B、铵态氮肥与碱性物质如草木灰混合施用肥效更高 C、实验室制备氨气的试剂和装置可为如图装置 D、工业上用氨气液化需吸收热量的过程做制冷剂6. 向200 mL 2 mol·L-1 HNO3溶液中,逐渐加入铁粉至过量(假设生成的气体只有一种),在此过程中,n(Fe2+)随n(Fe)变化如右图所示。下列有关说法正确的是( )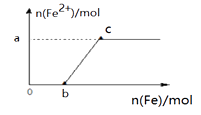 A、当0<n(Fe)≤b时,向所得的溶液中加入KSCN溶液没有血红色出现 B、向c点处的反应液中加入稀盐酸后无明显现象 C、当加入铁粉n mol时(0.1<n<0.15),溶液中n(Fe3+)=(0.3-2n)mol D、图中a=0.15 、b =0.157. 为了检验某固体物质中是否含有NH4+ , 你认为下列试纸和试剂一定用不到的是( )
A、当0<n(Fe)≤b时,向所得的溶液中加入KSCN溶液没有血红色出现 B、向c点处的反应液中加入稀盐酸后无明显现象 C、当加入铁粉n mol时(0.1<n<0.15),溶液中n(Fe3+)=(0.3-2n)mol D、图中a=0.15 、b =0.157. 为了检验某固体物质中是否含有NH4+ , 你认为下列试纸和试剂一定用不到的是( )①蒸馏水 ②NaOH溶液 ③红色石蕊试纸 ④蓝色石蕊试纸 ⑤稀硫酸.
A、①⑤ B、④⑤ C、①③⑤ D、①④⑤8. 将amol铁粉加入到含bmol硝酸溶液中,充分反应后铁粉完全溶解,共收集到c L(标况)的NO、NO2混合气体。下列有关说法不正确的是( )A、若反应后产物中只有Fe2+生成,则 < a< B、若反应后产物中只有Fe3+生成,则b=3a + C、若反应后产物中有Fe2+、Fe3+生成,则 <b<6a D、若反应后溶液中有dmol H+ , 则b=3a+d+9. 对于下列事实的解释错误的是 ( )A、在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性 B、浓硫酸能够干燥氯气、氢气等气体,说明浓硫酸具有吸水性 C、常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应 D、氨水可使酚酞试剂变为红色,说明氨水显碱性10. 研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是()
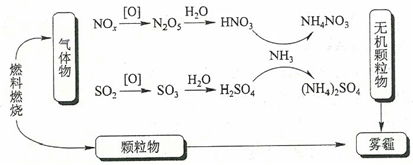
A、雾和霾的分散剂相同 B、雾霾中含有硝酸铵和硫酸铵 C、NH3是形成无机颗粒物的催化剂 D、雾霾的形成与过度施用氮肥有关11. 丰富多彩的颜色变化增添了化学实验的魅力,下列有关反应颜色变化的叙述中正确的是( )①新制氯水久置后→浅黄绿色消失
②Cl2通入石蕊试液中→先变红后褪色
③SO2通入石蕊试液中→先变红后褪色
④SO2通入品红溶液中→红色褪去
⑤氨气通入酚酞溶液中→红色.
A、①②③④ B、②③④⑤ C、①②④⑤ D、全部12. 依据图中氮元素及其化合物的转化关系,判断下列说法不正确的是( )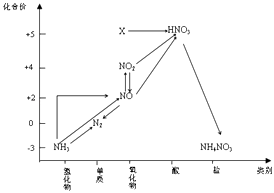 A、X是N2O5 B、可用排空气法收集NO气体 C、工业上以NH3、空气、水为原料生产硝酸 D、由NH3→N2 , 从原理上看,NH3可与NO2反应实现13. 下列各组物质中,气体X和气体Y同时通入盛有溶液Z的洗气瓶中(如图),一定没有沉淀生成的是
A、X是N2O5 B、可用排空气法收集NO气体 C、工业上以NH3、空气、水为原料生产硝酸 D、由NH3→N2 , 从原理上看,NH3可与NO2反应实现13. 下列各组物质中,气体X和气体Y同时通入盛有溶液Z的洗气瓶中(如图),一定没有沉淀生成的是 A、A B、B C、C D、D
A、A B、B C、C D、D二、填空题
-
14. 有一句俗语叫“雷雨发庄稼”,其所包含的化学过程有(用化学方程式表示):
(1) (2) (3)
15. 在浓硝酸中放入铜片:①开始反应的化学方程式为 .
②若铜有剩余,则反应将要结束时的反应的离子方程是:
③待反应停止后,再加入少量的25%的稀硫酸,这时铜片上又有气泡产生,其原因是 .
16. 将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答:(要写计算过程)(1)、NO的体积为L,NO2的体积为L;(保留2位有效数字)(2)、待产生的气体全部释放后,向溶液中加入V mL a mol·L-1的NaOH溶液,恰好使溶液中的Cu2+ 全部转化成沉淀,则原硝酸溶液的浓度为mol·L-1。(列出计算式即可)三、实验探究题
-
17. 某学生利用以下装置探究氯气与氨气之间的反应.其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置.
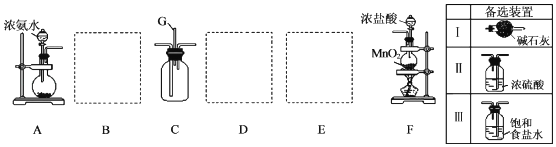
请回答下列问题:
(1)、装置F中发生反应的离子方程式为 .(2)、装置A中的烧瓶内固体可选用(填字母)A.碱石灰 B.生石灰 C.二氧化硅 D.五氧化二磷
(3)、虚线框内应添加必要的除杂装置,请从如图的备选装置中选择,并将编号填入下列空格:B , D , E .
(4)、催化剂存在下,NH3可用来消除NO的污染,生成两种对环境无害的物质.写出该反应的化学方程式:;该反应中每消耗标准状况下8.96LNH3转移电子mol.18. 某化学小组设计如图装置,探究铜和一定量的浓HNO3是否反应是否有NO生成.已知:A试管内空气体积为50mL(标准状况),B广口瓶盛80mL水,硝酸不溶于煤油.请回答下列问题:
 (1)、加入浓HNO3前应先通一段时间N2 , 具体操作为: , 其作用是 .(2)、关闭K1、K2 , 打开K3 , 通过分液漏斗向试管中加入一定量的浓硝酸,然后在硝酸上方加一层煤油,煤油的作用是 , 待铜和硝酸反应完毕后,通过分液漏斗向试管中加煤油直至试管充满.(3)、读取量气管读数时,要先 , 然后再读取读数.(4)、数据分析:①从B中取20mL溶液,恰好中和用去0.1mol/L的NaOH体积为16mL则B中所得硝酸的物质的量浓度为 .
(1)、加入浓HNO3前应先通一段时间N2 , 具体操作为: , 其作用是 .(2)、关闭K1、K2 , 打开K3 , 通过分液漏斗向试管中加入一定量的浓硝酸,然后在硝酸上方加一层煤油,煤油的作用是 , 待铜和硝酸反应完毕后,通过分液漏斗向试管中加煤油直至试管充满.(3)、读取量气管读数时,要先 , 然后再读取读数.(4)、数据分析:①从B中取20mL溶液,恰好中和用去0.1mol/L的NaOH体积为16mL则B中所得硝酸的物质的量浓度为 .②假设只生成NO2 , 通过计算理论上收集到的气体体积为mL (标准状况下).
③实验最终测得气体的体积为130.5mL(标准状况下),与理论值有差异,其理由可能为 .
A.Cu与一定物质的量浓度的HNO3反反应除了生成NO2还生成NO
B.过程中还发生了反应4NO+3O2+2H2O=4HNO3
C.过程中还发生了反应4NO2+O2+2H2O=4HNO3
D.硝酸具有挥发性,对实验有影响.
四、综合题
-
19. A、B、C、D均为中学所学的常见物质且均含有同一种元素,它们之间的转化关系如下图所示(反应条件及其他物质已经略去):
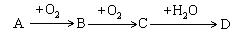
请回答下列问题:
(1)、若常温下A为淡黄色固体单质,D为强酸,则A、D分别为(填写化学式)A: , D: .
写出D→B的化学方程式:
(2)、若A的水溶液能使湿润的红色石蕊试纸变蓝,D的稀溶液能使蓝色的湿润石蕊试纸变红.则A为 , 写出A→B转化的化学方程式: .(3)、D的浓溶液可与铜反应并生成C气体,则该反应的化学方程式为:。20. 以下是氮循环的一部分: (1)、通常状况下,NO2的颜色是;(2)、反应①的化学方程式是;(3)、NO2易溶于水,并和水发生化学反应.该反应中,氧化剂是;(4)、化合物A的化学式是;(5)、治理汽车尾气的一种方法是用催化剂使NO与CO发生反应:2NO+2CO═2CO2+N2 . 当生成2mol N2时,被还原的NO为mol.21. NH3经一系列反应可以得到HNO3和NH4NO3 , 如图1所示.
(1)、通常状况下,NO2的颜色是;(2)、反应①的化学方程式是;(3)、NO2易溶于水,并和水发生化学反应.该反应中,氧化剂是;(4)、化合物A的化学式是;(5)、治理汽车尾气的一种方法是用催化剂使NO与CO发生反应:2NO+2CO═2CO2+N2 . 当生成2mol N2时,被还原的NO为mol.21. NH3经一系列反应可以得到HNO3和NH4NO3 , 如图1所示.
【资料卡片】
i.NH4NO3是一种白色晶体,易溶于水,微溶于乙醇.
ii.在230℃以上时,同时有弱光:2NH4NO3═2N2↑+O2↑+4H2O
iii.在400℃以上时,剧烈分解发生爆炸:4NH4NO3═3N2↑+2NO2+8↑H2O
(1)、如图2将水滴入盛有硝酸铵的试管中,观察到的A处液面上升,B处液面下降,产生该现象的原因 . 一段时间后还能观察到的现象是 .(2)、实验室可以用氯化铵和熟石灰反应来制备氨气,该反应的化学方程式是 , 能否用硝酸铵代替氯化铵,(填“能”或“不能”),理由是 .(3)、从反应类型角度分析在I~IV的转化过程中的共同点是。22. 某校课外活动小组为了探究铜与稀硝酸反应产生的是NO气体,设计了如图所示装置进行实验.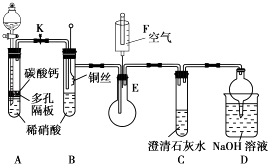 (1)、设计装置A的目的是 , 为达到此目的应进行的操作是;
(1)、设计装置A的目的是 , 为达到此目的应进行的操作是;A中发生反应的化学方程式是 .
(2)、在(1)中的操作后将装置B中的铜丝插入稀硝酸中,并微热,观察到装置B中的现象是;离子方程式 .(3)、装置E和F的作用是;(4)、装置D的作用是 .