第11讲:硫及其化合物
试卷更新日期:2018-10-12 类型:一轮复习
一、单选题
-
1. 下列说法中正确的是( )A、硫是黄色能溶于水的晶体 B、臭氧空洞的形成主要与SO2有关 C、硫在自然界仅以化合态存在 D、硫既能与某些金属反应又能与某些非金属反应2. 对于下列事实的解释错误的是 ( )A、在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性 B、浓硫酸能够干燥氯气、氢气等气体,说明浓硫酸具有吸水性 C、常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应 D、氨水可使酚酞试剂变为红色,说明氨水显碱性3. 下列气体能用浓硫酸干燥的是( )A、SO2 B、SO3 C、HI D、H2S4. 下列实验现象的描述正确的是( )A、木炭在氧气中燃烧产生明亮的黄色火焰 B、磷在氧气中燃烧产生大量的白雾 C、硫在氧气中燃烧发出蓝紫色火焰,生成带刺激性气味的气体 D、硫在空气中燃烧发出淡蓝色火焰,生成无色无味的气体5. 下列反应中能产生二氧化硫的是( )A、氧化铜和稀硫酸反应 B、亚硫酸钠和氧气反应 C、三氧化硫和水反应 D、铜和热的浓硫酸反应6. 利用右图所示装置进行下列实验,能得到相应实验结论的是 ( )
选项
①
②
③
实验结论

A
浓硫酸
Na2SO3
KMnO4溶液褪色
SO2有漂白性
B
浓盐酸
KMnO4
FeBr2溶液变为黄色
氧化性:Cl2 >Br2
C
稀硫酸
碳酸钠
CaCl2溶液无明显变化
CO2不与CaCl2反应
D
浓硫酸
蔗糖
溴水褪色
浓硫酸具有脱水性、吸水性
A、A B、B C、C D、D7. 下列对SO2和SO3的叙述正确的是( )A、通常条件下,都是无色气体,都易溶于水 B、都是酸性氧化物,其水溶液都是强酸 C、都可使品红溶液褪色,加热时红色又能再现 D、都能跟碱溶液反应8. 检验某未知溶液是否含有SO42﹣离子,你认为合理的方法是( )A、先加HNO3再加稀BaCl2溶液 B、先加稀盐酸,再加入BaCl2溶液 C、加入BaCl2溶液 D、加入Ba(NO3)2溶液9. 在一定条件下,将70mL硫化氢气体和90mL氧气混合,点燃并使其反应,再恢复到原来的条件,则生成的SO2气体的体积为( )A、70mL B、60mL C、50mL D、55mL10. 通过一步反应不能直接完成的是( )①N2→NO2②S→SO2 ③NH3→NO④NO→HNO3⑤CuSO4→Cu(NO3)2⑥SiO2→H2SiO3 .
A、①⑥ B、④⑤ C、①④ D、⑤⑥11. 下列物质可用于消毒杀菌的是( )①苯酚 ②硫磺 ③福尔马林 ④双氧水 ⑤次氯酸.
A、①③⑤ B、②④⑤ C、①②④ D、全部12. 将等物质的量的Cl2和SO2通入BaCl2溶液,充分反应后滴入品红溶液,能观察到的现象是:①出现沉淀;②不出现沉淀;③品红溶液褪色;④品红溶液不褪色( )A、①④ B、①③ C、①② D、②④13. 下列有关说法中错误的是( )A、硫化氢的水溶液叫氢硫酸,易被氧化 B、SO2是一种有刺激性气味的有毒气体,易溶于水,是亚硫酸的酸酐 C、pH在5.6~7.0之间的降水通常称为酸雨 D、推广使用低硫煤,并向煤中加生石灰的方法,可减少SO2的排放14. 以SO2为原料,通过下列工艺可制备化工原料H2SO4和清洁能源H2。下列说法中错误的是( )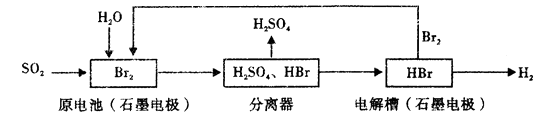 A、该生产工艺中Br2被循环利用 B、在电解过程中,电解槽阴极附近溶液的pH变大 C、原电池中负极发生的反应为SO2+2H2O-2e-=SO42-+4H+ D、该工艺总反应的化学方程式表示为SO2+Br2+2H20=2HBr+H2SO415. 某学习小组设计制取SO2并验证其部分性质的实验装置图如下(夹持装置省略),下列叙述正确的是( )
A、该生产工艺中Br2被循环利用 B、在电解过程中,电解槽阴极附近溶液的pH变大 C、原电池中负极发生的反应为SO2+2H2O-2e-=SO42-+4H+ D、该工艺总反应的化学方程式表示为SO2+Br2+2H20=2HBr+H2SO415. 某学习小组设计制取SO2并验证其部分性质的实验装置图如下(夹持装置省略),下列叙述正确的是( ) A、关闭弹簧夹a,打开弹簧夹b,用酒精灯在三颈烧瓶下微热,若能观察到C中长导管口有明显气泡现象,就能判断装置A,B部分气密性良好 B、A装置中比较理想的反应物质是Na2SO3固体和质量分数为10%的硫酸 C、B装置溶液变红色,说明SO2是酸性氧化物;C装置产生白色沉淀的原因为:BaCl2+SO2+H2O BaSO3↓+2HCl D、取反应后D溶液少许,滴加品红溶液,红色褪去,不能说明SO2具有漂白性16. 右图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法错误的是( )
A、关闭弹簧夹a,打开弹簧夹b,用酒精灯在三颈烧瓶下微热,若能观察到C中长导管口有明显气泡现象,就能判断装置A,B部分气密性良好 B、A装置中比较理想的反应物质是Na2SO3固体和质量分数为10%的硫酸 C、B装置溶液变红色,说明SO2是酸性氧化物;C装置产生白色沉淀的原因为:BaCl2+SO2+H2O BaSO3↓+2HCl D、取反应后D溶液少许,滴加品红溶液,红色褪去,不能说明SO2具有漂白性16. 右图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法错误的是( ) A、该硫酸试剂的物质的量浓度为18.4mol·L-1 B、该硫酸与等体积的水混合所得溶液的质量分数大于49% C、配制200.0mL4.6mol·L-1的稀硫酸需取该硫酸50.0mL D、常温下,将2.7gAl投入足量该硫酸中可得到标准状况下的氢气3.36L
A、该硫酸试剂的物质的量浓度为18.4mol·L-1 B、该硫酸与等体积的水混合所得溶液的质量分数大于49% C、配制200.0mL4.6mol·L-1的稀硫酸需取该硫酸50.0mL D、常温下,将2.7gAl投入足量该硫酸中可得到标准状况下的氢气3.36L二、填空题
-
17. 下列物质:①O2 ②CH3OH ③CH3CH2CH2OH ④O3 ⑤CHCl3 ⑥CH3OCH2CH3⑦612C ⑧CH3CH(OH)CH3 ⑨613C ⑩三氯甲烷.
其中属于同系物的有(填序号,下同),互为同分异构体的有 , 互为同素异形体的有 , 属于同位素的有属于同一物质的有
18. 炽热的木炭跟浓H2SO4反应的化学方程式是 , 浓硫酸的作用是 , 氧化产物与还原产物的物质的量之比为 .19.根据下图所示的实验装置,回答下列问题:
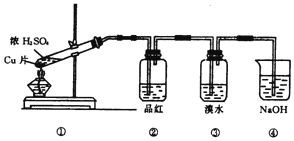
(1)写出铜与浓硫酸反应的化学方程式
(2)证明SO2具有漂白性的现象是 , 再加热该溶液,现象是 .
(3)装置③中的现象是 , 证明SO2具有 .
(4)装置④的作用是 .
(5)若实验后经过处理得到25g CuSO4•5H2O晶体,则被还原的硫酸的质量是 g.
20. 某兴趣小组采用如图2装置制取并探究SO2气体的性质.
①下列实验方案适用于如图2所示装置制取所需SO2的是(填序号)
A.Na2SO3溶液与HNO3B.Na2SO3固体与浓硫酸C.固体硫在纯氧中燃烧
D.铜与浓H2SO4
②组装完仪器后,检查装置气密性的方法是:
③若要证明c中生成的气体是SO2 , d中加入品红溶液后,打开活塞b,反应开始,待d中溶液后,再(填实验的操作)试管d中的溶液,颜色又恢复,证明气体是SO2 .
④指导老师指出应增加一尾气吸收装置,并帮助同学们设计了如图2装置,其中合理的是(填序号).
21.甲、乙、丙三位同学各设计一个实验,结果各自都认为自己的试样中含有SO42﹣ .
甲的实验为:试样A(无色溶液)
 白色沉淀
白色沉淀 沉淀不溶解
沉淀不溶解①乙认为甲的实验不严谨,因为试样A中若含有 离子(仅填一种),也会有此现象.乙的实验为:试样B(无色溶液)
 白色沉淀
白色沉淀 沉淀不溶解
沉淀不溶解②丙认为乙的实验也不严谨,因为试样B中若含有 离子(仅填一种),也会有此现象.丙的实验为:试样C(无色溶液)
 现象Ⅰ
现象Ⅰ 现象Ⅱ
现象Ⅱ若丙方案合理,则回答:
③其中试剂Ⅰ是 , 现象Ⅰ是 ;试剂Ⅱ是 , 现象Ⅱ是 (若认为丙方案不合理,以上四空可以不填).
三、实验探究题
-
22. 某同学为了检验浓硫酸与木炭发生反应产生的所有气体产物,设计了如下反应流程:
 (1)、气体发生装置应该选择下图给出的;
(1)、气体发生装置应该选择下图给出的;
写出浓硫酸和木炭在该装置中发生反应的化学方程式;
(2)、①中无水硫酸铜的作用是;(3)、②中间洗气瓶中试剂为;作用是;(4)、②中两次用到品红溶液,B的作用是;(5)、③中出现的现象是 .23. 某校化学兴趣小组为探究铁与浓硫酸反应,设计了图1、图2所示装置进行实验. (1)、比较两实验装置,图2所示装置的优点是
(1)、比较两实验装置,图2所示装置的优点是①能更好地吸收有毒气体SO2 , 防止其污染环境;
② .
(2)、能说明有SO2气体产生的实验现象是(3)、反应一段时间后,用滴管吸取A试管中的溶液滴入适量水中为试样,试样中所含金属离子的成分有以下三种可能:Ⅰ:只含有Fe3+;Ⅱ:只含有Fe2+;Ⅲ:既有Fe3+又有Fe2+ .
为验证Ⅱ、Ⅲ的可能性,选用如下试剂:
A.稀盐酸 B.稀硫酸 C.KSCN溶液D.KMnO4溶液 E.NaOH溶液 F.淀粉KI溶液G.H2O2溶液
验证Ⅱ:取试样,先滴加少量的(填试剂序号,下同),振荡,再滴加少量的 , 根据溶液颜色的变化可确定假设Ⅱ是否正确.
验证Ⅲ:步骤1.取试样,滴加少量的(填试剂序号),溶液的颜色 , 则试样中含有Fe3+ , 发生反应的离子方程式为 .
步骤2.再取适量的试样滴加少量的(填试剂序号),溶液的颜色变为色,则试样中含有Fe2+ .
四、综合题
-
24. 根据问题填空:(1)、在浓硝酸中放入铜片,开始时反应的化学方程式为;待反应停止后,再加入少量质量分数为25%的稀硫酸,这时铜片上又有气泡产生,其原因是(用离子方程式表示) .(2)、常温下,将铁棒置于浓硫酸中,无明显现象,课本上解释为发生了钝化,但有人认为未发生反应.为验证此过程,某同学经过思考,设计了如下实验:将经浓硫酸处理过的铁棒洗净后置于CuSO4溶液中,若铁棒表面 , 则发生了钝化;若铁棒表面 , 则未发生反应.(3)、制取硫酸铜有两种方法:方法一:2Cu+O2 2CuO,CuO+H2SO4═CuSO4+H2O,方法二:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O,方法一与方法二相比,其优点是(至少答两点): .25. 回答下列有关Na2S溶液的问题.(1)、Na2S溶液盛装在带橡胶塞的试剂瓶中,仔细闻有臭鸡蛋气味,请用离子方程式解释: , .(2)、将Na2S溶液加入AlCl3溶液中,有白色沉淀和臭鸡蛋气味的气体生成,发生的离子反应为: .(3)、将Na2S溶液加入AgCl的浊液中,生成的黑色沉淀是(写化学式).