第10讲:氯及其重要化合物 卤族元素
试卷更新日期:2018-10-12 类型:一轮复习
一、单选题
-
1. 下列方法中,不能用于实验室制取氨的是( )A、在烧瓶中将熟石灰和氯化铵混合,加水调成泥状后加热 B、加热试管中的氯化铵固体 C、将烧瓶中的浓氨水加热 D、将分液漏斗中的浓氨水滴入装有生石灰的烧瓶中2. 为了防止贮存液氯的钢筒被腐蚀,钢筒在装氯之前必须( )A、除去铁锈 B、用盐酸清洗 C、彻底干燥 D、加点铁粉3. 下列关于F、Cl、Br、I性质的比较,不正确的是( )A、单质的颜色随核电荷数的增加而加深 B、单质的熔、沸点随核电荷数的增加而升高 C、单质的氧化性减弱 D、它们的氢化物的稳定性随核电荷数的增加而增强4. 下列有关颜色变化的叙述不正确的是 ( )A、淀粉溶液中滴入碘水﹣﹣变蓝色 B、溴化银见光分解﹣﹣变黑色 C、苯酚溶液中滴入Fe 3+﹣﹣变紫色 D、胆矾空气中久置﹣﹣变白色5. W、X、Y、Z均为短周期元素且原子序数依次增大,元素X和Z同族。盐YZW与浓盐酸反应,有黄绿色气体产生,此气体同冷烧碱溶液作用,可得到YZW的溶液。下列说法正确的是A、原子半径大小为W<X<Y<Z B、X的氢化物水溶液酸性强于Z的 C、Y2W2与ZW2均含有非极性共价键 D、标准状况下W的单质状态与X的相同6. 在4份碘化钾淀粉溶液中,分别加入下列物质,不能使溶液变蓝的是( )A、氯化氯 B、溴水 C、氯气 D、碘的酒精溶液7. 向含有NaBr、NaI的溶液中通入过量的Cl2 , 然后将溶液蒸干,并灼烧固体,最后得到的物质是( )A、NaCl B、NaCl和NaBr C、NaCl和NaI D、NaCl和I28. 下列关于碱金属、卤素的描述正确的是( )A、碱金属在空气中加热均可生成多种氧化物 B、碱金属与水反应,均浮在水面上. C、卤素各单质都能和水剧烈反应. D、卤素单质越活泼,其熔沸点就越低9. 实验室模拟工业漂白液(有效成分为NaClO)脱除废水中氨氮(NH3)的流程如下:
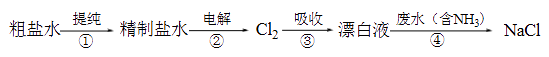
下列分析正确的是( )
A、①中采用蒸馏的方法精制粗盐水 B、②中阳极的主要电极反应:4OH- - 4e- = 2H2O + O2↑ C、③中制备漂白液的反应:Cl2 + OH- = Cl- + HClO D、②、③、④中均发生了氧化还原反应10. 下列有关氯气的叙述,其说法正确的是( )A、在通常情况下氯气比空气重 B、点燃是使氯气和氢气化合的唯一条件 C、氯气跟铁反应生成FeCl2 D、将红热的铜放入氯气中生成蓝色氯化铜11. 制备干燥的氨气所需的药品是( )A、NH4Cl溶液、NaOH溶液、碱石灰 B、浓氨水、NaOH固体、浓硫酸 C、NH4Cl固体、消石灰、碱石灰 D、浓NaOH溶液、NH4C固体、浓硫酸12. 证明某白色固体中含有Cl﹣的正确操作方法是( )A、加入AgNO3溶液和稀硝酸,看是否有白色沉淀生成 B、溶于水后加入AgNO3溶液,看是否有白色沉淀生成 C、加入AgNO3溶液,看是否有白色沉淀生成 D、溶于水后先加入Ba(NO3)2溶液,再加入AgNO3溶液和稀硝酸,看是否有白色沉淀生成13. 实验室制备氯气的装置如下图。图中涉及气体发生、除杂、干燥、收集、尾气处理装置,其中错误的是( )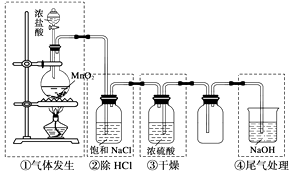 A、① B、② C、③ D、④
A、① B、② C、③ D、④二、填空题
-
14. 1)一种变色眼镜的镜片和普通照相感光胶片中含有卤化银.镜片变化是因为卤化银在光的作用下发生化学反应,其反应式是 ,照相感光胶片曝光的化学反应是 .
(2)在我国干旱严重的华北地区,近年来利用飞机、高炮或火箭等运载工具向过冷支层中播撒碘化银(AgI)或干冰,实现人工增雨(或人工增雪),达到减灾的目的.下列有关人工增雨的评述中,你认为不甚理智的是 .
A.它对农业生产条件和大气环境的改善有一定的效益
B.它使用的碘化银中的重金属元素对土壤造成污染
C.它使用的AgI如换成干冰,可避免重金属元素对土壤的污染
D.它是人类彻底战胜自然的表现,体现了人类的力量是无穷的.
15. 某同学按如图进行实验,在A中放的是干燥的红色布条,在B中放的是湿润的红色布条,在C中盛放的是氢氧化钠溶液,回答下列问题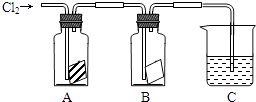
A中现象是 B中现象是
结论是
③若C中盛有的是混有酚酞溶液的氢氧化钠溶液,当通入一定量的氯气时溶液红色褪去,有同学说红色消失的原因有两种可能,请你帮他写出哪两种可能?
a:
b:
请设计实验证明哪种可能正确 .
16. 洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。(1)、工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为(2)、漂白粉的有效成分是(填化式)。(3)、漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为。(4)、反应(1)和反应(3)中,属于氧化还原反应的是(填编号)三、实验探究题
-
17. 硼是第IIIA族元素,单质硼在加热条件下能与多种非金属反应。某同学欲利用氯气和单质硼反应制备三氯化硼。已知BCl3的沸点为12.5 ℃ ,熔点为-107.3 ℃,遇水剧烈反应,生成硼酸和盐酸。该同学选用下图所示的部分装置(可以重复选用)进行实验,请回答下列问题:
 (1)、A中反应的离子方程式为。(2)、图中g管的作用是。(3)、装置的连接顺序依次为A→→→→E→D→F;在E、F装置间连接D装置的作用是。(4)、停止实验时,正确的实验操作是。(5)、若硼酸(H3BO3)为一元弱酸,则其钠盐NaH2BO3为(填“正盐”或“酸式盐”或“碱式盐”)。(6)、实验完成后,某同学向F中(溶液含有0.05mol/LNaClO、 0.05mol/LNaCl、0.1mol/LNa0H)滴加品红溶液,发现溶液褪色。现设计实验探究溶液褪色的原因,请在表中空格处填上数据,完成实验方案。
(1)、A中反应的离子方程式为。(2)、图中g管的作用是。(3)、装置的连接顺序依次为A→→→→E→D→F;在E、F装置间连接D装置的作用是。(4)、停止实验时,正确的实验操作是。(5)、若硼酸(H3BO3)为一元弱酸,则其钠盐NaH2BO3为(填“正盐”或“酸式盐”或“碱式盐”)。(6)、实验完成后,某同学向F中(溶液含有0.05mol/LNaClO、 0.05mol/LNaCl、0.1mol/LNa0H)滴加品红溶液,发现溶液褪色。现设计实验探究溶液褪色的原因,请在表中空格处填上数据,完成实验方案。实验序号
0.1mol/LNaClO溶液/mL
0.1mol/LNaCl溶液/mL
0.2mol/LNaOH溶液/mL
H2O /mL
品红
溶液
现象
①
5.0
0
0
x
4滴
较快褪色
②
0
5.0
5.0
0
4滴
不褪色
③
5.0
0
5.0
0
4滴
缓慢褪色
则x= , 结论:。
四、综合题
-
18. 海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等.(1)、在光照条件下,氯气和氢气反应过程如下:
①Cl2→Cl+Cl
②Cl+H2→HCl+H
③H+Cl2→HCl+Cl
…
反应②中形成的化合物的电子式为;反应③中被破坏的化学键属于键(填“极性”或“非极性”).
(2)、已知在短周期主族元素中,元素a与氯元素相邻且属同一周期,元素b也与氯元素相邻且属于同一主族,那么比较元素a、b以及氯元素三者的原子半径由大到小的顺序是(用元素符号表示).与氯元素同周期且金属性最强的元素位于周期表的第周期族.(3)、卤素单质及化合物在许多性质上都存在着递变规律.下列有关说法错误的是 (填字母).A、卤素单质的熔沸点按F2、Cl、Br2、I2的顺序由低到高 B、原子半径按 C、Cl、Br、I的顺序由大到小 D、卤化氢的稳定性按的H E、HCl、HBr、HI的顺序由强到弱 F、卤素单质与氢气化合按的F2、Cl2、Br2、I2顺序由难变易(4)、碘单质及其化合物具有重要应用.下列说法正确的是(填字母).a. I与 I互为同位素
b.加碘食盐能使淀粉溶液变蓝
c.从海带中提取I2的过程只发生化学变化
d.提纯含泥沙的粗碘可用升华法.
19. 碘缺乏症遍及全球,多发生于山区.南美的安第斯山区、欧洲的阿尔卑斯山区和亚洲的喜马拉雅山区是高发病地区.我国云南、河南等10余省的山区发病率也较高.据估计我国患者大约有1000万人.为控制该病的发生,较为有效的方法是食用含碘食盐,我国政府以国家标准的方式规定在食盐中添加碘酸钾(KIO3).据此回答下列问题:(1)、碘是合成下列哪种激素的主要原料之一A、胰岛素 B、甲状腺激素 C、生长激素 D、雄性激素(2)、长期生活在缺碘山区,又得不到碘盐的供应,易患A、甲状腺亢进 B、佝偻病 C、地方性甲状腺肿 D、糖尿病(3)、可用盐酸酸化的碘化钾和淀粉检验食盐中的碘酸钾.反应的化学方程式为 . 氧化产物与还原产物的物质的量之比为 . 能观察到的明显现象是 .(4)、已知KIO3可用电解方法制得.总反应化学方程式为:KI+3H2O KIO3+3H2↑.在某温度下.若以12A的电流强度电解KI溶液10min.理论上可得标况下氢气 L.20. 我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务,下图是海水综合利用的一个方面。
请回答下列问题:
(1)、①步主要反应的的离子方程式:。(2)、分离出氢氧化镁的操作为 ,第③步需要加入。
(3)、将粗食盐中含有的Mg2+、Ca2+和SO42—等杂质除去,加入的试剂有(按加入顺序填入(只要求填一组合理的答案即可) 。21. 某同学在复习元素化合物的性质时,做了如下学习笔记,请你一起完成。(1)、氯气的颜色为;由氯的原子结构示意图推测,氯气具有很强的 性。为了证明推测是否正确,进行如下实验:I:将红热的铁丝伸入盛满氯气的集气瓶,观察铁丝在氯气中燃烧,有大量棕黄色烟。该反应的化学方程式是。
II:在空气中点燃H2 , 然后将导管缓缓伸入盛满氯气的集气瓶,可观察到H2在氯气中安静燃烧,产生色的火焰,瓶口有白雾的现象。
由实验I、II可知,上述推测(填“正确”或“不正确”);理由是。
III:将氯气溶于水,制得氯水。下列物质不能与新制氯水反应的是。
Na2CO3溶液 B.FeCl2溶液 C.AgNO3 溶液 D.CuCl2溶液
(2)、下列是一些常见物质之间的转化关系。A是一种红色金属,F为不溶于酸的白色沉淀,B和C是两种强酸。(图中部分产物及反应条件略去)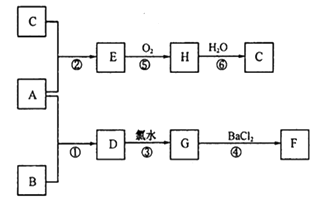
则:①A和B 分别为:A B;
②A与B发生反应的条件是;
③反应⑥的化学方程式为;
④上述反应中,不属于氧化还原反应的是。(填数字序号)。
-