2015-2016学年湖北省襄阳市老河口一中高三上学期期中化学试卷
试卷更新日期:2017-03-08 类型:期中考试
一、选择题
-
1. 下列化学用语的表达正确的是( )A、NaHSO3在溶液中的电离:NaHSO3=Na++H++SO32﹣ B、Cl﹣的结构示意图:
 C、HClO结构式:H﹣Cl﹣O
D、医用钡餐的化学式:BaSO4
2. 如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,下列 关于该装置的说法正确的是( )
C、HClO结构式:H﹣Cl﹣O
D、医用钡餐的化学式:BaSO4
2. 如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,下列 关于该装置的说法正确的是( ) A、外电路电流方向为:X→外电路→Y B、若两极分别为铁棒和碳棒,则X为碳棒,Y为铁棒 C、X极上发生的是还原反应,Y极上发生的是氧化反应 D、若两极都是金属,则它们的活动顺序为X>Y3. 下列说法正确的是( )A、羟基跟链烃基直接相连的化合物属于醇类 B、含有羟基的化合物属于醇类 C、酚类和醇类具有相同的官能团,因而具有相同的化学性质 D、分子内含有苯环和羟基的化合物都属于酚类4. 按碳骨架分类,下列说法正确的是( )A、CH3CH(CH3)2属于链状化合物 B、
A、外电路电流方向为:X→外电路→Y B、若两极分别为铁棒和碳棒,则X为碳棒,Y为铁棒 C、X极上发生的是还原反应,Y极上发生的是氧化反应 D、若两极都是金属,则它们的活动顺序为X>Y3. 下列说法正确的是( )A、羟基跟链烃基直接相连的化合物属于醇类 B、含有羟基的化合物属于醇类 C、酚类和醇类具有相同的官能团,因而具有相同的化学性质 D、分子内含有苯环和羟基的化合物都属于酚类4. 按碳骨架分类,下列说法正确的是( )A、CH3CH(CH3)2属于链状化合物 B、 属于芳香族化合物
C、
属于芳香族化合物
C、 属于脂肪族化合物
D、
属于脂肪族化合物
D、 属于醇类化合物
5. 某有机化合物的结构如图,关于该化合物的下列说法正确的是( )
属于醇类化合物
5. 某有机化合物的结构如图,关于该化合物的下列说法正确的是( ) A、由于含有氧元素不是有机物 B、完全燃烧时只有二氧化碳和水两种产物 C、分子中含有羟基属于醇 D、不能使溴水褪色6. 下列有机物是按照碳的骨架进行分类的是( )A、烷烃 B、烯烃 C、芳香烃 D、卤代烃7. 化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算反应4~8min间的平均反应速率和推测反应16min时反应物的浓度,结果应是( )
A、由于含有氧元素不是有机物 B、完全燃烧时只有二氧化碳和水两种产物 C、分子中含有羟基属于醇 D、不能使溴水褪色6. 下列有机物是按照碳的骨架进行分类的是( )A、烷烃 B、烯烃 C、芳香烃 D、卤代烃7. 化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算反应4~8min间的平均反应速率和推测反应16min时反应物的浓度,结果应是( ) A、2.5 μmol•L﹣1•min﹣1和2.0 μmol•L﹣1 B、2.5 μmol•L﹣1•min﹣1和2.5 μmol•L﹣1 C、3.0 μmol•L﹣1•min﹣1和3.0 μmol•L﹣1 D、5.0 μmol•L﹣1•min﹣1和3.0 μmol•L﹣18. 反应C(s)+H2O(g)⇌CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变可使反应速率加快的是( )A、增加C的量 B、将容器的体积减小一半 C、保持体积不变,充入氮气使体系的压强增大 D、保持压强不变,充入氮气使体系的体积增大9. 将可逆反应:2NO2←→2NO+O2在固定容积的密闭容器中进行,达到平衡的标志是( )
A、2.5 μmol•L﹣1•min﹣1和2.0 μmol•L﹣1 B、2.5 μmol•L﹣1•min﹣1和2.5 μmol•L﹣1 C、3.0 μmol•L﹣1•min﹣1和3.0 μmol•L﹣1 D、5.0 μmol•L﹣1•min﹣1和3.0 μmol•L﹣18. 反应C(s)+H2O(g)⇌CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变可使反应速率加快的是( )A、增加C的量 B、将容器的体积减小一半 C、保持体积不变,充入氮气使体系的压强增大 D、保持压强不变,充入氮气使体系的体积增大9. 将可逆反应:2NO2←→2NO+O2在固定容积的密闭容器中进行,达到平衡的标志是( )①单位时间内消耗n mol O2的同时,生成2n mol NO2
②单位时间内生成n mol O2的同时,消耗2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态
④混合气体的密度不再改变的状态
⑤混合气体的颜色不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态.
A、①④⑥ B、②③⑤ C、①③④ D、②⑤⑥10. 制造硫酸的工艺流程反应其中之一是2SO2(g)+O2(g)←→2SO3(g)+190kJ.下列描述中能说明上述反应已达平衡的是( )A、v(O2)正=2v(SO3)逆 B、容器中气体的平均摩尔质量不随时间而变化 C、如果容器容积是固定的,那么混合气体的密度不随时间而变化 D、单位时间内生成n mol SO3的同时生成n mol O211. 将足量铁粉投入一定浓度的氯化铁和氯化铜的混合溶液中,充分反应后,溶液中剩余固体的质量与加入铁粉的质量相同,则原溶液中氯化铁和氯化铜的浓度之比为( )A、2:7 B、3:4 C、4:7 D、2:312. 如图所示,铜片、锌片和石墨棒用导线连接后插入番茄里,电流计中有电流通过,则下列说法正确的是( ) A、锌片是负极 B、两个铜片上都发生氧化反应 C、石墨是阴极 D、两个番茄都形成原电池13. 下列关于教材中的各项说法错误的一项是( )A、在化学反应中,反应物转化为生成物的同时,必然发生能量的变化 B、氮肥包括铵态氮肥、硝态氮肥和尿素 C、在书写热化学方程式时应标明反应物及生成物的状态,无需标明反应温度和压强 D、医疗上用的石膏绷带是利用熟石膏与水混合成糊状后很快凝固的性质14. X,Y均为元素周期表ⅦA族中的两种元素.下列叙述中,能够说明X的原子得电子能力比Y强的是( )A、原子的电子层数:X>Y B、对应的简单离子的还原性:X>Y C、气态氢化物的稳定性:X>Y D、氧化物对应水化物的酸性:X>Y15. 下列反应的离子方程式书写正确的是( )A、在澄清石灰水中加入少量小苏打:Ca2++OH﹣+HCO3﹣=CaCO3↓+H2O B、苯酚钠溶液中通入少量CO2:2C6H5O﹣+CO2+H2O→2C6H5OH+CO32﹣ C、将少量SO2气体通入NaClO溶液中:SO2+2ClO﹣+H2O=SO32﹣+2HClO D、将标准状况下112mL氯气通入10mL浓度为1mol•L﹣1的溴化亚铁溶液中:2Fe2++4Br﹣+3Cl2=3Fe3++6Cl﹣+2Br216. 据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电.其电池反应为:2CH3OH+3O2+4OH﹣═2CO32﹣+6H2O,则下列说法错误的是( )A、放电时CH3OH参与反应的电极为正极 B、充电时电解质溶液的pH逐渐增大 C、放电时负极的电极反应为:CH3OH﹣6e﹣+8OH﹣═CO32﹣+6H2O D、充电时每生成1 mol CH3OH转移6 mol电子
A、锌片是负极 B、两个铜片上都发生氧化反应 C、石墨是阴极 D、两个番茄都形成原电池13. 下列关于教材中的各项说法错误的一项是( )A、在化学反应中,反应物转化为生成物的同时,必然发生能量的变化 B、氮肥包括铵态氮肥、硝态氮肥和尿素 C、在书写热化学方程式时应标明反应物及生成物的状态,无需标明反应温度和压强 D、医疗上用的石膏绷带是利用熟石膏与水混合成糊状后很快凝固的性质14. X,Y均为元素周期表ⅦA族中的两种元素.下列叙述中,能够说明X的原子得电子能力比Y强的是( )A、原子的电子层数:X>Y B、对应的简单离子的还原性:X>Y C、气态氢化物的稳定性:X>Y D、氧化物对应水化物的酸性:X>Y15. 下列反应的离子方程式书写正确的是( )A、在澄清石灰水中加入少量小苏打:Ca2++OH﹣+HCO3﹣=CaCO3↓+H2O B、苯酚钠溶液中通入少量CO2:2C6H5O﹣+CO2+H2O→2C6H5OH+CO32﹣ C、将少量SO2气体通入NaClO溶液中:SO2+2ClO﹣+H2O=SO32﹣+2HClO D、将标准状况下112mL氯气通入10mL浓度为1mol•L﹣1的溴化亚铁溶液中:2Fe2++4Br﹣+3Cl2=3Fe3++6Cl﹣+2Br216. 据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电.其电池反应为:2CH3OH+3O2+4OH﹣═2CO32﹣+6H2O,则下列说法错误的是( )A、放电时CH3OH参与反应的电极为正极 B、充电时电解质溶液的pH逐渐增大 C、放电时负极的电极反应为:CH3OH﹣6e﹣+8OH﹣═CO32﹣+6H2O D、充电时每生成1 mol CH3OH转移6 mol电子二、填空题
-
17. 有如下有机物:(每空一分)
①
 ②
②  ③
③  ④CH3CH=CHCH3 ⑤
④CH3CH=CHCH3 ⑤  ⑥
⑥  ⑦
⑦  (1)、互为同分异构体的是: , 存在手性异构体的是: , 存在顺反异构体的是 , 互为同系物的是(任写一对):;(2)、氢核磁共振(1H﹣NMR)图谱如上图所示的有;(3)、上述物质中,不属于同分异构体,相同质量时,在氧气中完全燃烧消耗的氧气的质量完全相同的烃是:;(4)、有机物④的系统命名法名称是;(5)、有机物⑤的键线式 , 其分子中碳原子杂化.18. 下表是某地区市场上销售的一种“加碘食盐”包装袋上的部分文字说明.请根据此表,结合初中化学和生物学科的知识,回答下列问题.
(1)、互为同分异构体的是: , 存在手性异构体的是: , 存在顺反异构体的是 , 互为同系物的是(任写一对):;(2)、氢核磁共振(1H﹣NMR)图谱如上图所示的有;(3)、上述物质中,不属于同分异构体,相同质量时,在氧气中完全燃烧消耗的氧气的质量完全相同的烃是:;(4)、有机物④的系统命名法名称是;(5)、有机物⑤的键线式 , 其分子中碳原子杂化.18. 下表是某地区市场上销售的一种“加碘食盐”包装袋上的部分文字说明.请根据此表,结合初中化学和生物学科的知识,回答下列问题.配料表
精制海盐、碘酸钾[
含碘量
20~40mg/kg
卫生许可证号
××卫碘字(1999)第001号
分装日期
见封底
储藏方法
密封、避光、防潮
食用方法
烹调时,待食品熟后加入碘盐
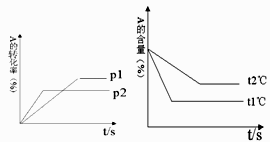
(1)、碘是合成下列哪种激素的主要原料之一A、胰岛素 B、甲状腺素 C、生长激素 D、雄性激素(2)、长期生活在缺碘山区,又得不到食盐供应,易患A、甲状腺亢进 B、贫血症 C、地方性甲状腺肿大 D、糖尿病(3)、食盐中加碘,这碘指的是(填元素、原子或单质).(4)、碘酸钾的化学式为KIO3 , 其中碘元素的化合价为 .(5)、根据含碘盐的食用方法可推测碘元素的化学性质,碘酸钾在受热时容易 .(6)、已知可用盐酸酸化的碘化钾淀粉溶液,检查食盐中含碘酸钾(进行如下反应:IO3﹣+5I﹣+6H+═3I2+3H2O).现有①纯净水、②白酒、③食醋、④淀粉KI试纸、⑤纯碱,试从中选择必须的物质检验食盐样品中是否加入碘,选择的物质(填序号).19. 可逆反应:aA(g)+bB(g) cC(g)+dD(g);根据图回答:①压强 P1P2;(a+b)(c+d)(填“>”或“<”下同).
②温度t1℃ t2℃;△H0.
③保持体积和温度不变,通入He,平衡会移动(填“正向”、“逆向”或“不”).
 20. 写出下列元素基态原子的电子排布式:
20. 写出下列元素基态原子的电子排布式:29 Cu
32Ge(简式) .
21. 在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热.已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量.(1)、写出该反应的热化学方程式: .(2)、已知H2O(l)═H2O(g);△H=+44kJ•mol﹣1,则16g液态肼燃烧生成氮气和液态水时,放出的热量是 kJ.(3)、上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是 .(4)、已知N2(g)+2O2(g)═2NO2(g);△H=+67.7kJ•mol﹣1,N2H4(g)+O2(g)═N2(g)+2H2O (g);△H=﹣534kJ•mol﹣1,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式 .22. 甲醇是一种可再生能源,具有广泛的开发和应用前景.请回答下列与甲醇有关的问题.(1)、甲醇分子是分子(填“极性”或“非极性”).(2)、工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)⇌CH3OH(g)△H=﹣86.6KJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2 , 反应达到平衡时,容器内的压强是开始时的3/5.①达到平衡时,CO的转化率为
②下列选项能判断该反应达到平衡状态的依据的有
A.2v(H2)=v(CH3OH) B.CO的消耗速率等于CH3OH的生成速率
C.容器内的压强保持不变 D.混合气体的密度保持不变
E.混合气体的平均相对分子质量不随时间而变化
(3)、已知在常温常压下:①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(g)△H=﹣akJ•mol﹣1
②2CO(g)+O2(g)=2CO2(g)△H=﹣bkl•mol﹣1
③H2O(g)=H2O(1)△H=﹣ckJ•mol﹣1
则CH3OH(1)+O2(g)═CO(g)+2H2O(1)△H=kJ•mol﹣1
(4)、由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电.①该电池负极的电极反应式为 .
②若以该电池为电源,用石墨做电极电解200mL含有如下离子的溶液.
离子
Cu2+
H+
Cl﹣
SO42﹣
c/mol•L﹣1
0.5
2
2
0.5
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的质量为 .