2015-2016学年湖北省武汉市华中师大一附中高三上学期期中化学试卷
试卷更新日期:2017-03-08 类型:期中考试
一、选择题
-
1. 2015年,中国药学家屠呦呦获得诺贝尔生理学或医学奖,其突出贡献是创制新型抗疟药青蒿素和双氢青蒿素.已知青蒿素的结构如图所示,有关青蒿素的说法,不正确的是( )
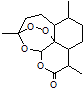 A、分子式为C15H22O5 B、能够发生水解反应 C、每个分子中含有4个六元环 D、青蒿素能够治疗疟疾可能与结构中存在过氧键基团有关2. 下列说法正确的是( )A、SO2和NO2都是有用的化工原料,因此目前都是将汽车尾气中的氮氧化合物收集后制备硝酸以防止污染空气 B、由于HClO具有漂白性,因此工业上常用Cl2的水溶液来漂白纸浆、毛、丝、草帽辫 C、稀土元素在自然界中含量非常低,难以开采,但它们在冶金工业中有着重要的用途,被称为冶金工业的维生素 D、金属钠通常被保存在煤油或石蜡油中,以隔绝空气3. 下列实验装置正确的是( )A、
A、分子式为C15H22O5 B、能够发生水解反应 C、每个分子中含有4个六元环 D、青蒿素能够治疗疟疾可能与结构中存在过氧键基团有关2. 下列说法正确的是( )A、SO2和NO2都是有用的化工原料,因此目前都是将汽车尾气中的氮氧化合物收集后制备硝酸以防止污染空气 B、由于HClO具有漂白性,因此工业上常用Cl2的水溶液来漂白纸浆、毛、丝、草帽辫 C、稀土元素在自然界中含量非常低,难以开采,但它们在冶金工业中有着重要的用途,被称为冶金工业的维生素 D、金属钠通常被保存在煤油或石蜡油中,以隔绝空气3. 下列实验装置正确的是( )A、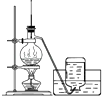 实验室制乙烯
B、
实验室制乙烯
B、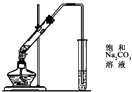 酯化反应
C、
酯化反应
C、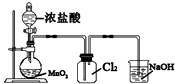 实验室制取Cl2
D、
实验室制取Cl2
D、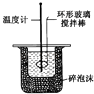 中和热的测定
4. 用如图所示装置除去含CN﹣、Cl﹣废水中的CN﹣时,控制溶液pH为9~10,某电极上产生的ClO﹣将CN﹣氧化为两种无污染的气体,下列说法正确的是( )
中和热的测定
4. 用如图所示装置除去含CN﹣、Cl﹣废水中的CN﹣时,控制溶液pH为9~10,某电极上产生的ClO﹣将CN﹣氧化为两种无污染的气体,下列说法正确的是( )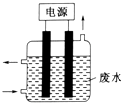 A、可以用石墨作阳极,作铁阴极 B、除去CN﹣的反应:2CN﹣+5ClO﹣+2H+═N2↑+2CO2↑+5Cl﹣+H2O C、阴极的电极反应式为:Cl﹣+2OH﹣+2e﹣═ClO﹣+H2O D、阳极的电极反应式为:2CN﹣+12OH﹣﹣10e﹣═N2↑+2CO32﹣+6H2O5. 甲、乙、丙、丁、戊五种物质是中学化学常见的物质,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法正确的是( )
A、可以用石墨作阳极,作铁阴极 B、除去CN﹣的反应:2CN﹣+5ClO﹣+2H+═N2↑+2CO2↑+5Cl﹣+H2O C、阴极的电极反应式为:Cl﹣+2OH﹣+2e﹣═ClO﹣+H2O D、阳极的电极反应式为:2CN﹣+12OH﹣﹣10e﹣═N2↑+2CO32﹣+6H2O5. 甲、乙、丙、丁、戊五种物质是中学化学常见的物质,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法正确的是( )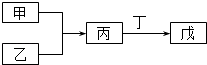 A、若甲可以与NaOH溶液反应放出H2 , 则丙一定是两性氧化物 B、若甲为短周期中最活泼的金属,且戊为碱,则丙生成戊一定是氧化还原反应 C、若丙、丁混合产生大量白烟,则乙可能具有漂白性 D、若甲、丙、戊都含有同一种元素,则三种物质中,该元素的化合价由低到高的顺序可能为甲<丙<戊6. 下列离子方程式书写及评价合理的是( )
A、若甲可以与NaOH溶液反应放出H2 , 则丙一定是两性氧化物 B、若甲为短周期中最活泼的金属,且戊为碱,则丙生成戊一定是氧化还原反应 C、若丙、丁混合产生大量白烟,则乙可能具有漂白性 D、若甲、丙、戊都含有同一种元素,则三种物质中,该元素的化合价由低到高的顺序可能为甲<丙<戊6. 下列离子方程式书写及评价合理的是( )离子方程式
评价
A
Mg(HCO3)2溶液中加入足量的NaOH溶液:Mg2++2HCO3﹣+2OH﹣═MgCO3↓+CO32﹣+2H2O
正确,NaOH过量,酸式盐与碱完全反应生成正盐和水;
B
1mol/L的NaAlO2溶液与2.5mol/L的HCl溶液等体积混合:2AlO2﹣+5H+═Al3++Al(OH)3↓+H2O
正确,AlO2﹣与H+按物质的量1:1反应转化为Al(OH)3 , 过量的H+再将一半Al(OH)3转化为Al3+
C
将少量的Fe3O4溶解在过量的稀HNO3中:Fe3O4+8H+═Fe2++2Fe3++4H2O
正确,Fe3O4化学式可改写为FeO•Fe2O3 , Fe2+与Fe3+物质的量之比为1:2
D
将FeCl2溶液加入到NaClO溶液中:Fe2++2ClO﹣+2H2O═Fe(OH)2↓+2HClO
错误,Fe2+与ClO﹣会发生氧化还原反应:
2Fe2++ClO﹣+5H2O═2Fe(OH)3↓+Cl﹣+4H+
A、A B、B C、C D、D7. 25℃时,用0.1mol•L﹣1的CH3COOH溶液滴定20mL0.1mol•L﹣1的NaOH溶液,当滴加VmLCH3COOH溶液时,混合溶液的pH=7.已知CH3COOH的电离平衡常数为Ka , 忽略混合时溶液体积的变化,下列关系式正确的是( )A、Ka= B、V= C、K a= D、K a=二、填空题
-
8. 美国化学家鲍林教授具有独特的化学想象力:只要给他物质的分子式,他就能大体上想象出这种物质的分子结构模型.多核离子所带电荷可以认为是中心原子得失电子所致,根据VSEPR模型,下列离子中所有原子都在同一平面上的一组是 .A、NO2﹣和NH4+ B、H3O+和ClO3﹣ C、NO3﹣和CO32﹣ D、PO43﹣和SO42﹣9. 铜、锌两种元素的第一电离能、第二电离能如表所示:
电离能/kJ•mol﹣1
I1
I2
铜
746
1958
锌
906
1733
铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是 .
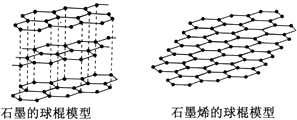
10.石墨烯是从石墨材料中剥离出来、由碳原子组成的只有一层原子厚度的二维晶体.其结构如图:有关说法正确的是( ).
 A、固态时,碳的各种单质的晶体类型相同 B、石墨烯中含有非极性共价键 C、从石墨中剥离石墨烯需要破坏化学键 D、石墨烯具有导电性11. 最近科学家成功以CO2为原料制成了一种新型的碳氧化合物,该化合物晶体中每个碳原子均以4个共价单键与氧原子结合为一种空间网状的无限延伸结构,则该晶体中碳原子采用杂化与周围氧原子成键;晶体中碳氧原子个数比为;碳原子数与C﹣O化学键数之比为 .12. 已知钼(Mo)的晶胞为体心立方晶胞,钼原子半径为a pm,相对原子质量为M,以NA表示阿伏加德罗常数的值,请写出金属钼密度的计算表达式 g/cm3 .
A、固态时,碳的各种单质的晶体类型相同 B、石墨烯中含有非极性共价键 C、从石墨中剥离石墨烯需要破坏化学键 D、石墨烯具有导电性11. 最近科学家成功以CO2为原料制成了一种新型的碳氧化合物,该化合物晶体中每个碳原子均以4个共价单键与氧原子结合为一种空间网状的无限延伸结构,则该晶体中碳原子采用杂化与周围氧原子成键;晶体中碳氧原子个数比为;碳原子数与C﹣O化学键数之比为 .12. 已知钼(Mo)的晶胞为体心立方晶胞,钼原子半径为a pm,相对原子质量为M,以NA表示阿伏加德罗常数的值,请写出金属钼密度的计算表达式 g/cm3 .三、简答题.
-
13. 某晶体(结晶水合物)由五种短周期元素组成.常温下,将该晶体溶于蒸馏水后可电离出三种离子(忽略水的电离),其中两种离子含有的电子数均为10个.将该溶液分成等量2份,一份中加入足量稀盐酸,无明显现象,再加入BaCl2溶液,产生白色沉淀;向另一份中逐滴加入NaOH溶液至过量,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.
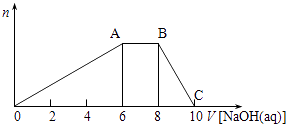
请回答下列问题:
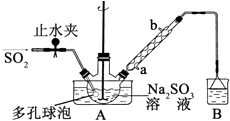
(1)、若该晶体的摩尔质量为906g•mol﹣1 , 写出该晶体的化学式;(2)、B点溶液的pH7(填“<”、“>”或“=”),用化学用语表示其原因 .(3)、若向该晶体的水溶液中逐滴加入Ba(OH)2溶液至产生最多的沉淀,写出该变化的离子方程式 .(4)、C点溶液中所含溶质的化学式为;此时溶液中各种离子浓度由大到小顺序为 .14. 次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O)俗称吊白块,不稳定,120℃时会分解.在印染、医药以及原子能工业中有广泛应用.以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如图:步骤1:在三颈烧瓶中加入一定量Na2SO3和水,搅拌溶解,缓慢通入SO2 , 至溶液pH 约为4,制得NaHSO3溶液.
步骤2:将装置A 中导气管换成橡皮塞.向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80~90℃下,反应约3h,冷却至室温,抽滤;
步骤3:将滤液真空蒸发浓缩,冷却结晶.
 (1)、装置B 的烧杯中应加入的溶液是;冷凝管中冷却水从(填“a”或“b”)口进水.(2)、A中多孔球泡的作用是 .(3)、冷凝管中回流的主要物质除H2O 外还有(填化学式).(4)、写出步骤2中发生反应的化学方程式 .(5)、步骤3中在真空容器中蒸发浓缩的原因是 .(6)、为了测定产品的纯度,准确称取2.0g样品,完全溶于水配成100mL溶液,取20.00mL所配溶液,加入过量碘完全反应后(已知I2不能氧化甲醛,杂质不反应),加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重得到白色固体0.466g,则所制得的产品的纯度为 .15. 氮、碳都是重要的非金属元素,含氮、碳元素的物质在工业生产中有重要的应用.(1)、请写出工业上由NH3制取NO的化学方程式 .(2)、一定条件下,铁可以和CO2发生反应:Fe(s)+CO2(g)⇌FeO(s)+CO(g),已知该反应的平衡常数K与温度T的关系如图所示.
(1)、装置B 的烧杯中应加入的溶液是;冷凝管中冷却水从(填“a”或“b”)口进水.(2)、A中多孔球泡的作用是 .(3)、冷凝管中回流的主要物质除H2O 外还有(填化学式).(4)、写出步骤2中发生反应的化学方程式 .(5)、步骤3中在真空容器中蒸发浓缩的原因是 .(6)、为了测定产品的纯度,准确称取2.0g样品,完全溶于水配成100mL溶液,取20.00mL所配溶液,加入过量碘完全反应后(已知I2不能氧化甲醛,杂质不反应),加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重得到白色固体0.466g,则所制得的产品的纯度为 .15. 氮、碳都是重要的非金属元素,含氮、碳元素的物质在工业生产中有重要的应用.(1)、请写出工业上由NH3制取NO的化学方程式 .(2)、一定条件下,铁可以和CO2发生反应:Fe(s)+CO2(g)⇌FeO(s)+CO(g),已知该反应的平衡常数K与温度T的关系如图所示.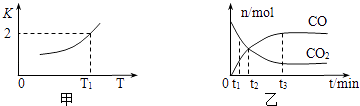
①该反应的逆反应是(填“吸热”或“放热”)反应.
②T℃、P pa压强下,在体积为VL的容器中进行反应,下列能说明反应达到平衡状态的是 .
A、混合气体的平均相对分子质量不再变化;
B、容器内压强不再变化;
C、v正(CO2)=v逆(FeO)
③T1温度下,向体积为V L的密闭容器中加入足量铁粉并充入一定量的CO2 , 反应过程中CO和CO2物质的量与时间的关系如图乙所示.则CO2的平衡转化率为 , 平衡时混合气体的密度与起始时气体的密度之比为 .
(3)、在恒温条件下,起始时容积均为5L的甲、乙两密闭容器中(甲为恒容容器、乙为恒压容器),均进行反应:N2+3H2⇌2NH3 , 有关数据及平衡状态特定见表.容器
起始投入
达平衡时
甲
2mol N2
3mol H2
0mol NH3
1.5mol NH3
同种物质的体积分数相同
乙
a mol N2
b mol H2
0mol NH3
1.2mol NH3
起始时乙容器中的压强是甲容器的倍.
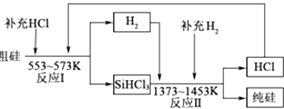
(4)、一定条件下,2.24L(折算为标准状况)N2O和CO的混合气体在点燃条件恰好完全反应,放出bkJ热量.生成的3种产物均为大气组成气体,并测得反应后气体的密度是反应前气体密度的 倍.请写出该反应的热化学方程式 .16. 硅是带来人类文明的重要元素之一,从传统材料到信息材料的发展过程中创造了一个有一个奇迹.(1)、新型陶瓷Si3N4的熔点高、硬度大、化学性质稳定.工业上可以采用化学气相沉积法,在H2的保护下,使SiCl4与N2反应生成Si3N4沉积在石墨表面,写出该反应的化学方程式 .(2)、一种用工业硅(含少量钾、钠、铁、铜的氧化物),已知硅的熔点是1420℃,高温下氧气及水蒸气能明显腐蚀氮化硅.一种合成氮化硅的工艺主要流程如图: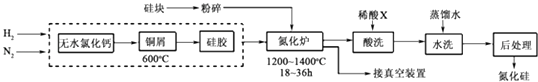
①净化N2和H2时,铜屑的作用是:;硅胶的作用是 .
②在氮化炉中3SiO2(s)+2N2(g)═Si3N4(s)△H=﹣727.5kJ/mol,开始时为什么要严格控制氮气的流速以控制温度;体系中要通入适量的氢气是为了 .
③X可能是(选填:“盐酸”、“硝酸”、“硫酸”、“氢氟酸”).
(3)、工业上可以通过如图所示的流程制取纯硅:①整个制备过程必须严格控制无水无氧.SiHCl3遇水剧烈反应,写出该反应的化学方程式 .
②假设每一轮次制备1mol纯硅,且生产过程中硅元素没有损失,反应Ⅰ中HCl的利用率为90%,反应Ⅱ中H2的利用率为93.75%.则在第二轮次的生产中,补充投入HCl和H2的物质的量之比是 .
 17. 工业上合成a﹣萜品醇G的路线之一如图:
17. 工业上合成a﹣萜品醇G的路线之一如图: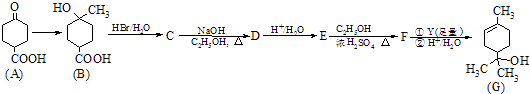
已知:

请回答下列问题:
(1)、F中所含官能团的名称是;B→C的反应类型为 .(2)、写出同时满足下列条件的E的同分异构体的结构简式 .①只有3种环境的氢原子 ②能发生银镜反应 ③分子中含六元环
(3)、A的核磁共振氢谱有个吸收峰,面积比为 .(4)、写出C→D转化的化学方程式 .(5)、写出B在一定条件下聚合成高分子化合物的化学方程式 .(6)、G可以与H2O催化加成得到不含手性碳原子的化合物H,请写出H的结构简式 .