2015-2016学年山西省晋城市高三上学期期末化学试卷
试卷更新日期:2017-03-08 类型:期末考试
一、选择题、
-
1. 化学与人类生产、生活密切相关,下列有关说法不正确的是( )A、氮化硅、氧化铝陶瓷和光导纤维都是无机非金属材料 B、绚丽缤纷的烟花中添加了含钾、钠、钙、铜等金属元素的化合物 C、“海水淡化”可以解决“淡水供应危机”,向海水中加入净水剂明矾可以使海水淡化 D、燃料的脱硫脱氮、SO2的回收利用和NOx的催化转化都是减少酸雨产生的措施2. 向KI、Na2S2O3、淀粉三种物质按一定比例组成的混合溶液中快速加入一定量的(NH4)2S2O8溶液并开始计时,ts时观察到溶液变蓝色,过程中发生下列反应:①2I﹣+S2O82﹣=I2+2SO42﹣(慢),②I2+2S2O32﹣=2I﹣+S4O62﹣ (快)下列说法正确的是( )A、总反应速率由反应②决定 B、在(NH4)2S2O8消耗完后,溶液一定显蓝色 C、若能观察都蓝色出现,刚起始时,n(Na2S2O3)=n[(NH4)2S2O8] D、升高温度,①、②的反应速率均加快3. 茶叶中铁元素的检验可经过以下四个步骤完成,各步骤中选用的实验用品不能都用到的是( )
 A、将茶叶灼烧灰化,选用①、②和⑨ B、用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦ C、过滤得到的滤液,选用④、⑤和⑦ D、检验滤液中的Fe3+ , 选用③、⑧和⑩4. 下列说法正确的是( )
A、将茶叶灼烧灰化,选用①、②和⑨ B、用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦ C、过滤得到的滤液,选用④、⑤和⑦ D、检验滤液中的Fe3+ , 选用③、⑧和⑩4. 下列说法正确的是( ) A、图I所示装置用于Cu和浓H2SO4制取少量的SO2气体 B、图Ⅱ装置可验证非金属性:Cl>C>Si C、图Ⅲ可用于收集气体H2、CO2、Cl2、NH3 D、图Ⅳ表示将SO2气体通入溴水中,所得溶液的pH变化5. CuSO4是一种重要的化工原料,有关制备途径及性质如图所示.下列说法错误的是( )
A、图I所示装置用于Cu和浓H2SO4制取少量的SO2气体 B、图Ⅱ装置可验证非金属性:Cl>C>Si C、图Ⅲ可用于收集气体H2、CO2、Cl2、NH3 D、图Ⅳ表示将SO2气体通入溴水中,所得溶液的pH变化5. CuSO4是一种重要的化工原料,有关制备途径及性质如图所示.下列说法错误的是( ) A、途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:2 B、相对于途径①、③,途径②更好地体现了绿色化学思想 C、生成等量的硫酸铜,三个途径中参加反应的硫酸的物质的量:①=②<③ D、利用途径②制备16g硫酸铜,被还原的硫酸的物质的量为0.1mol6. 用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图象如下:分析图象,以下结论错误的是( )
A、途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:2 B、相对于途径①、③,途径②更好地体现了绿色化学思想 C、生成等量的硫酸铜,三个途径中参加反应的硫酸的物质的量:①=②<③ D、利用途径②制备16g硫酸铜,被还原的硫酸的物质的量为0.1mol6. 用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图象如下:分析图象,以下结论错误的是( )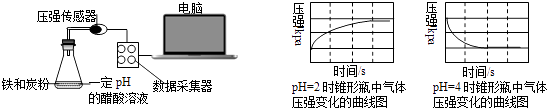 A、溶液pH≤2时,生铁发生析氢腐蚀 B、在酸性溶液中生铁可能发生吸氧腐蚀 C、析氢腐蚀和吸氧腐蚀的速率一样快 D、两溶液中负极反应均为:Fe﹣2e﹣═Fe2+7. 下列说法正确的是( )A、I的原子半径大于Br,HI比HBr的热稳定性强 B、P的非金属性强于Si,H3PO4比H2SiO3的酸性强 C、Al2O3和MgO均可与NaOH溶液反应 D、SO2和SO3混合气体通入Ba(NO3)2溶液可得到BaSO3和BaSO48. 下列说法在一定条件下可以实现的是( )
A、溶液pH≤2时,生铁发生析氢腐蚀 B、在酸性溶液中生铁可能发生吸氧腐蚀 C、析氢腐蚀和吸氧腐蚀的速率一样快 D、两溶液中负极反应均为:Fe﹣2e﹣═Fe2+7. 下列说法正确的是( )A、I的原子半径大于Br,HI比HBr的热稳定性强 B、P的非金属性强于Si,H3PO4比H2SiO3的酸性强 C、Al2O3和MgO均可与NaOH溶液反应 D、SO2和SO3混合气体通入Ba(NO3)2溶液可得到BaSO3和BaSO48. 下列说法在一定条件下可以实现的是( )①酸性氧化物与碱反应
②弱酸与盐溶液反应可生成强酸
③没有水生成,也没有沉淀和气体生成的复分解反应
④两种酸溶液充分反应后的溶液呈中性
⑤有单质参加的非氧化还原反应
⑥两种含氧化合物反应的产物有气体.
A、①②③④⑤⑥ B、②④⑤⑥ C、①②③⑤ D、③④⑤⑥9. 能正确表示下列反应的离子方程式是( )A、Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I﹣═2Fe2++I2+3H2O B、0.1mol/LNH4Al(SO4)2溶液与0.2mol/LBa(OH)2溶液等体积混合:Al3++2SO42﹣+2Ba2++4OH﹣═2BaSO4↓+AlO2﹣+2H2O C、用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO +6H++5H2O2═2Mn2++5O2↑+8H2O D、向次氯酸钠溶液中通入足量SO2气体:ClO﹣+SO2+H2O═HClO+HSO3﹣10. 用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )选项
①中物质
②中物质
预测中的现象
A
稀盐酸
碳酸钠、氢氧化钠混合溶液
立即产生气泡
B
浓硝酸
用砂纸打磨过的铝条
产生红棕色气体
C
氯化铝溶液
浓氢氧化钠溶液
产生大量白色沉淀
D
草酸溶液
高锰酸钾酸性溶液
溶液逐渐褪色
 A、A B、B C、C D、D11. 下列说法错误的是( )A、己烷有4种同分异构体,它们的熔点、沸点各不相同 B、在一定条件下,苯与液溴、硝酸作用生成溴苯、硝基苯的反应都属于取代反应 C、油脂皂化反应得到高级脂肪酸盐与甘油 D、新型生物柴油和矿物油主要化学成分不相同
A、A B、B C、C D、D11. 下列说法错误的是( )A、己烷有4种同分异构体,它们的熔点、沸点各不相同 B、在一定条件下,苯与液溴、硝酸作用生成溴苯、硝基苯的反应都属于取代反应 C、油脂皂化反应得到高级脂肪酸盐与甘油 D、新型生物柴油和矿物油主要化学成分不相同二、非选择题
-
12. 利用铝灰(主要成分为Al、Al2O3、AlN、FeO等)制备铝鞣剂[主要成分为Al(OH2Cl)]的一种工艺如下:
 (1)、气体A能使湿润的红色石蕊试纸变蓝.铝灰在90℃水解生成A的化学方程式为;“水解”采用90℃而不在室温下进行的原因是 .(2)、“酸溶”时,Al2O3发生反应的离子方程为 .(3)、“氧化”时,发生反应的离子方程式为 .(4)、“废渣”成分为(填化学式).(5)、采用喷雾干燥而不用蒸发的原因是 .(6)、煅烧硫酸铝铵晶体,发生的主要反应是:4[NH4Al(SO4)2•12H2O] 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过如图所示的装置.则
(1)、气体A能使湿润的红色石蕊试纸变蓝.铝灰在90℃水解生成A的化学方程式为;“水解”采用90℃而不在室温下进行的原因是 .(2)、“酸溶”时,Al2O3发生反应的离子方程为 .(3)、“氧化”时,发生反应的离子方程式为 .(4)、“废渣”成分为(填化学式).(5)、采用喷雾干燥而不用蒸发的原因是 .(6)、煅烧硫酸铝铵晶体,发生的主要反应是:4[NH4Al(SO4)2•12H2O] 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过如图所示的装置.则①集气瓶中收集到的气体是(填化学式).
②足量饱和NaHSO3溶液吸收的物质除大部分H2O(g)外还有(填化学式)
 13. 二氧化氯(ClO2)是一种黄绿色、易溶于水的气体,是高效、低毒的消毒剂,制备ClO2的方法有多种.(1)、工业上可用纤维素水解得到的最终产物A与NaClO3反应生成ClO2 , 其反应原理如下:
13. 二氧化氯(ClO2)是一种黄绿色、易溶于水的气体,是高效、低毒的消毒剂,制备ClO2的方法有多种.(1)、工业上可用纤维素水解得到的最终产物A与NaClO3反应生成ClO2 , 其反应原理如下:A+NaClO3+H2SO4→ClO2↑+CO2↑+H2O+NaSO4 , 该反应的还原剂与氧化剂的物质的量之比为 .
(2)、实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2;
①电解时发生反应的化学方程式为 .
②溶液X中大量存在的阴离子有 .
③除去ClO2中的NH3可选用的试剂是(填标号).
a.水b.碱石灰c.浓硫酸d.饱和食盐水
(3)、目前已发出电解法制取ClO2的新工艺.
①用石墨做电极,在一定条件下电解饱和食盐水制取ClO2(如图所示),写出阳极产生的ClO2的电极反应式: .
②电解一段时间,当阴极产生的气体体积为112mL(标准状况)时,停止电解、通过阳离子交换膜的阳离子的物质的量为 mol;用平衡移动原理解释阴极区pH增大的原因: .
③已知常温下Ksp(AgCl)=1.8×10﹣10 , Ksp(AgBr)=5×10﹣13 , 用1LNaCl溶液将0.01molAgBr完全转化为AgCl,则c(NaCl)的最小浓度为 mol•L﹣1(保留两位小数).
14. 己二酸二乙酯是乙酸纤维素、硝酸纤维素的增塑剂,实验室合成己二酸二乙酯的反应原理和有关数据如下: +2C2H5OH
+2C2H5OH  +2H2O
+2H2O相对分子质量
密度/(g•cm﹣3)
沸点/℃
水中溶解性
己二酸二乙酯
202
1.01
245
不溶于水
己二酸
146
1.36
231.8
微溶
乙醇
46
0.79
78.4
混溶
甲苯
92
0.87
110.6
不溶于水
实验步骤如下:
步骤1:在50mL圆底烧瓶中加入己二酸1.8g(0.012mol),乙醇4.4mL(0.076mol),甲苯5mL和浓硫酸(1mL),装置如图所示,小火加热回流40min.

步骤2:冷却,回流装置改为蒸馏装置,常压蒸馏,在120℃左右充分蒸馏.
步骤3:将步骤2的液体倒入克氏烧瓶,进行减压蒸馏,最后得己二酸二乙酯2.2g.
(1)、图中冷凝管中冷却水从(填“a”或“b”)口进,浓硫酸的主要作用是 作催化剂 .(2)、回流一段时间后,打开图中旋塞,流出的物质主要是 .(3)、实验中加入过量的乙醇的目的是 .(4)、步骤2实验已完成的标志是 .(5)、本实验的产率为 .15. 某市对大气进行监测,发现该市首要污染物可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等.因此PM2.5、SO2、NO2等你进行研究具有重要意义.请回答下列问题:(1)、对PM2.5样本用适量蒸馏水处理制成待测试样.测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:离子
K+
Na+
NH4+
SO42﹣
NO3﹣
Cl﹣
浓度/mol•L﹣1
4×10﹣6
6×10﹣4
2×10﹣5
4×10﹣5
3×10﹣5
2×10﹣5
根据表中数据判断PM2.5的酸碱性为 , 试样的pH值= .
(2)、为减少SO2的排放,常采取的措施有:①将煤转化为清洁气体燃料.
已知:H2(g)+ O2(g)=H2O(g)△H=﹣241.8kJ/mol﹣1
C(s)+ O2(g)=CO(g)△H=﹣110.5kJ/mol﹣1
写出焦炭与水蒸气反应的热化学方程式:
②洗涤含SO2的烟气.以下物质可作为洗涤剂的是 .
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(3)、汽车尾气中NOx和CO的生成及转化①已知气缸中生成NO的反应为:N2(g)+O2(g)⇌2NO(g)△H>0.
若1mol空气含0.8mol N2和0.2mol O2 , 1300℃时在密闭容器内反应达到平衡.测得NO的物质的量为8×10﹣4mol,计算该温度下的平衡常数K= . 汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g),已知该反应的△H>0,简述该设想能否实现的依据:;
③目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为 .