2018-2019学年人教版(五·四学制)化学九年级全一册第三单元课题2 酸和碱的中和反应 同步训练
试卷更新日期:2018-10-09 类型:同步测试
一、单选题
-
1. 向盛有氢氧化钠溶液的烧杯中滴加稀硫酸,对反应前后烧杯中溶液分析错误的是( )A、颜色改变 B、温度升高 C、碱性减弱 D、质量增加2. 向某稀盐酸中逐渐加入试剂X后溶液的pH变化如图。试剂X可能是下列物质中的( )
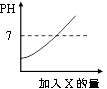 A、H2O B、H2SO4 C、NaOH D、CaCO33. 学会用化学解决实际问题是学习化学的一项重要任务.下列方案合理的是( )A、通过点燃的方法除去CO2中的CO B、加入过量的NaOH处理硫酸厂的废水 C、加入过量的Ca(OH)2除去CaCl2中的HCl D、用水鉴别生石灰和熟石灰4. 测得生活中一些物质的pH值如下表,下列说法正确的是( )
A、H2O B、H2SO4 C、NaOH D、CaCO33. 学会用化学解决实际问题是学习化学的一项重要任务.下列方案合理的是( )A、通过点燃的方法除去CO2中的CO B、加入过量的NaOH处理硫酸厂的废水 C、加入过量的Ca(OH)2除去CaCl2中的HCl D、用水鉴别生石灰和熟石灰4. 测得生活中一些物质的pH值如下表,下列说法正确的是( )食品
胃液
人体血液
肥皂水
洗涤剂
pH
0.8﹣15
7.35﹣7.45
10.2
12.2
A、人体血液呈酸性 B、用NaOH可以治疗胃酸过多 C、洗涤剂比肥皂水的碱性强 D、肥皂水能使蓝色石蕊试纸变红5. 下列说法正确的是( )A、除去二氧化碳中混有的氯化氢气体,可通过氢氧化钠溶液洗气 B、测定溶液的pH时,需预先用蒸馏水将pH试纸润湿 C、比较铁、铜的活动性强弱,可分别将这两种金属投入稀盐酸中观察现象 D、若厨房天然气泄漏,应立即打开脱排油烟机进行排气6. 下列图像能正确反映其对应关系的是( ) A、①表示向NaOH溶液中不断加水稀释 B、②表示水电解生成氢气与氧气的质量关系 C、③表示用等质量、等质量分数的过氧化氢溶液制取氧气 D、④表示分别向等质量、等质量分数的稀硫酸中加入足量的镁、铝7. 25℃时,下列过程的pH变化符合如图所示的是( )
A、①表示向NaOH溶液中不断加水稀释 B、②表示水电解生成氢气与氧气的质量关系 C、③表示用等质量、等质量分数的过氧化氢溶液制取氧气 D、④表示分别向等质量、等质量分数的稀硫酸中加入足量的镁、铝7. 25℃时,下列过程的pH变化符合如图所示的是( )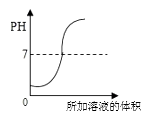 A、NaOH溶液中滴加稀盐酸 B、稀盐酸中滴加NaOH溶液 C、一定浓度的NaOH溶液加水稀释 D、一定浓度的盐酸加水稀释8. 推理是化学学习中常用的思维方法,下列推理正确的是( )A、人的血液呈碱性,则人的体液都呈碱性 B、NaCl溶液能够导电,则所有液体都能导电 C、KNO3溶液无色透明,则无色透明的液体都是溶液 D、酸性溶液能使石蕊变红,能使石蕊变红的溶液都是酸性溶液9. 人若长期食用“镉大米”(镉含量超标)会引起痛痛病。研究表明水稻对镉的吸收率与土壤的pH有紧密关系(如图所示),下列物质中可用于改良土壤结构,降低水稻对镉吸收率的是( )
A、NaOH溶液中滴加稀盐酸 B、稀盐酸中滴加NaOH溶液 C、一定浓度的NaOH溶液加水稀释 D、一定浓度的盐酸加水稀释8. 推理是化学学习中常用的思维方法,下列推理正确的是( )A、人的血液呈碱性,则人的体液都呈碱性 B、NaCl溶液能够导电,则所有液体都能导电 C、KNO3溶液无色透明,则无色透明的液体都是溶液 D、酸性溶液能使石蕊变红,能使石蕊变红的溶液都是酸性溶液9. 人若长期食用“镉大米”(镉含量超标)会引起痛痛病。研究表明水稻对镉的吸收率与土壤的pH有紧密关系(如图所示),下列物质中可用于改良土壤结构,降低水稻对镉吸收率的是( )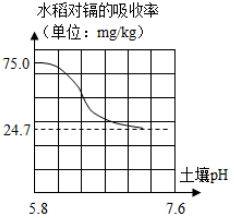 A、氯化钾 B、烧碱 C、熟石灰 D、硫酸亚铁(水溶液显酸性)10. 某校化学小组在利用硫酸和氢氧化钠溶液探究酸碱中和反应时,测得烧杯中溶液 pH 的变化如图所示。下列说法正确的是( )
A、氯化钾 B、烧碱 C、熟石灰 D、硫酸亚铁(水溶液显酸性)10. 某校化学小组在利用硫酸和氢氧化钠溶液探究酸碱中和反应时,测得烧杯中溶液 pH 的变化如图所示。下列说法正确的是( )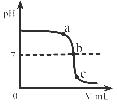 A、a 点所示溶液呈酸性 B、向 b 点所示溶液中滴加石蕊溶液,溶液呈紫色 C、该实验是将 NaOH 溶液逐滴滴入稀硫酸中 D、c 点所示溶液中,含有的溶质是 Na2SO4和 NaOH
A、a 点所示溶液呈酸性 B、向 b 点所示溶液中滴加石蕊溶液,溶液呈紫色 C、该实验是将 NaOH 溶液逐滴滴入稀硫酸中 D、c 点所示溶液中,含有的溶质是 Na2SO4和 NaOH二、填空题
-
11. 实验室有A、B 两种溶液,A 能使紫色石蕊溶液变红色,B能使无色酚酞溶液变红色,则A、B两种溶液的pH大小关系是AB (填“大于”或“小于”),显酸性的是溶液,该溶液是酸(填一定、不一定 ).要测定A、B 溶液的pH,其做法是。
12. 某试剂瓶上的标签已破损,残余部分如图.
①请猜测瓶中的试剂可能是 .
②取瓶中的试剂少许溶于水,发现放出大量的热,如何用pH试纸测所得溶液的pH值(写出具体操作方法) .
③用该稀溶液与氧化铜反应的方程式是 .
④若少量该试剂沾到皮肤上,应迅速用较多水冲洗,再涂上3%﹣5%溶液(填“碳酸氢钠”或“氢氧化钠”),最后再用清水清洗.
三、综合题
-
13. 铝是地壳中含量最多的金属元素,铝的化合物种类繁多,氧化铝的熔点(2050℃)高于铝的熔点(660℃)。硬铝(含铝、铜、镁、硅)是用途广发的铝合金。结合课本知识回答下列问题。
(1)、硬铝比铝的硬度(填“大”或“小”),硬铝含有的非金属元素是。(2)、氧化铝可用于制造耐火砖等高温材料,这是因为。
(3)、从活泼金属的化合物中提炼单质比较困难。人类3000做年前就使用铜,1500多年前就使用铁。推测人类使用铝比铁的年代(填“早”或“晚”)。(4)、药物“胃舒平”(主要成分是氢氧化铝)可治疗胃酸过多,反应的化学方程式是。14. 化学基础与常识
(1)、下图金属应用的实例,主要利用金属的导热性的是_______(填序号); A、电缆 B、电热壶 C、金属丝 D、金属乐器(2)、向氢氧化钠溶液中滴加稀盐酸至恰好完全反应,反应前后溶液中存在的离子种类如图所示(其中“○”“
A、电缆 B、电热壶 C、金属丝 D、金属乐器(2)、向氢氧化钠溶液中滴加稀盐酸至恰好完全反应,反应前后溶液中存在的离子种类如图所示(其中“○”“ ”“●”“
”“●”“  ”表示不同离子)。则“○”与“
”表示不同离子)。则“○”与“  ”反应生成了(填物质名称)。
”反应生成了(填物质名称)。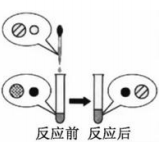 (3)、氢氟酸(HF)能刻画玻璃,其中有一个化学反应的化学方程式是: CaSiO3+6HF=X+SiF4↑+3H2O,则X的化学式为(4)、氢能是一种极具发展潜力的清洁能。以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如图所示。
(3)、氢氟酸(HF)能刻画玻璃,其中有一个化学反应的化学方程式是: CaSiO3+6HF=X+SiF4↑+3H2O,则X的化学式为(4)、氢能是一种极具发展潜力的清洁能。以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如图所示。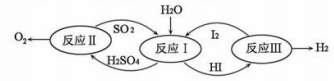
写出反应I中,发生反应的化学方程式:。
15. 分析、归纳、推理是学习化学的重要方法,请同学们根据下面微观粒子反应(在水式溶液中进行反应,水分子已省略)示意图,分析解决下列问题。 (1)、请根据图1、图2、图3任写一个反应的化学方程式。该反应属于反应(填基本反应类型);(2)、任选一个反应从微观角度分析该反应的实质。(3)、请你认真分析图1、图2、图3,从微观角度说明该反应类型发生反应的实质。16. 根据下图所示的回答问题。
(1)、请根据图1、图2、图3任写一个反应的化学方程式。该反应属于反应(填基本反应类型);(2)、任选一个反应从微观角度分析该反应的实质。(3)、请你认真分析图1、图2、图3,从微观角度说明该反应类型发生反应的实质。16. 根据下图所示的回答问题。 (1)、在白色点滴板1~6的孔穴中分别滴加2滴紫色石蕊溶液,溶液变为红色的孔穴有(填孔穴序号)。再向孔穴4中滴加氢氧化钠溶液,溶液变为紫色,用化学方程式解释其原因:。(2)、将试管①和②的现象相比较得到的结论是。(3)、丙实验①是稀释浓硫酸的正确操作,M烧杯中的物质应是。丙实验②电子秤上的量筒中盛有浓硫酸,放置一段时间,电子秤示数发生的变化及其原因是。17. 实验室常会产生含硫酸的废水,需经处理至中性.某兴趣小组同学配制一定质量分数的氢氧化钾溶液来处理酸性废水.(1)、定性检测废水
(1)、在白色点滴板1~6的孔穴中分别滴加2滴紫色石蕊溶液,溶液变为红色的孔穴有(填孔穴序号)。再向孔穴4中滴加氢氧化钠溶液,溶液变为紫色,用化学方程式解释其原因:。(2)、将试管①和②的现象相比较得到的结论是。(3)、丙实验①是稀释浓硫酸的正确操作,M烧杯中的物质应是。丙实验②电子秤上的量筒中盛有浓硫酸,放置一段时间,电子秤示数发生的变化及其原因是。17. 实验室常会产生含硫酸的废水,需经处理至中性.某兴趣小组同学配制一定质量分数的氢氧化钾溶液来处理酸性废水.(1)、定性检测废水检测废水呈酸性的方法是 .
(2)、配制200g质量分数为5.6%的氢氧化钾溶液①计算
m(KOH)= g,V(H2O) mL(水的密度近似为1.0g•mL﹣1).
②称取氢氧化钾
调节托盘天平平衡后,将一只烧杯放在托盘天平的左盘,称量其质量.然后 (按操作先后顺序,填字母),直至天平平衡.
A .向烧杯中加氢氧化钾固体 B .按需要添加砝码、移动游码
C .量取; D .溶解 E .转移.
(3)、定量测定废水取酸性废水样品100g,逐滴加入5.6%的氢氧化钾溶液,废水中硫酸的质量分数变化如图所示.(假设废水中其他成分不与氢氧化钾反应且不含硫酸钾)

①P点对应溶液中一定存在的阳离子有 (填离子符号).
②酸性废水中硫酸的质量分数为 (用百分数表示,保留到0.1%).
③计算当废水处理至中性时,溶液中硫酸钾的质量分数(写出计算过程,结果用百分数表示,保留到0.1%).