2015-2016学年河北省廊坊市高三上学期期末化学试卷
试卷更新日期:2017-03-07 类型:期末考试
一、选择题
-
1. 汽车排放的尾气是产生雾霾的一个因素,尾气中的下列成分与雾霾不相关的是( )A、硫氧化物 B、碳氧化物 C、氮氧化物 D、固体颗粒物2. 进行化学实验时应强化安全意识.下列做法正确的是( )A、金属钠着火时使用泡沫灭火器灭火 B、用试管加热碳酸氢钠固体时使试管口竖直向上 C、浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 D、蒸馏时应先向冷凝管中通入冷凝水再加热3. 下列物质在生活中应用时,起还原作用的是( )A、三氯化铁作净水剂 B、硅胶作干燥剂 C、漂粉精作消毒剂 D、铁粉作食品袋内的脱氧剂4. 设NA为阿伏加德罗常数的数值,下列说法正确的是( )A、23gNa与足量H2O反应完全后失去2NA个电子 B、1molCu和足量热浓硫酸反应可生成NA个SO3分子 C、标准状况下,22.4LN2和H2混合气中含2NA个原子 D、3mol单质Fe完全转变为Fe3O4 , 失去9NA个电子5. 25℃时,下列各组离子在指定溶液中一定能大量共存的是( )A、滴入石蕊试液显蓝色的溶液中:K+、Na+、HSO3﹣、ClO﹣ B、0.1mol/L的Fe(NO3)3溶液中:Na+、H+、Cl﹣、I﹣ C、0.1mol/L的NaAlO2溶液中:K+、H+、NO3﹣、SO42﹣ D、由水电离产生的c(H+)=1×10﹣13mol/L的溶液中:Na+、Ba2+、NO3﹣、Cl﹣6. 下列指定反应的离子方程式正确的是( )A、氯气溶于水:Cl2+H2O═2H++Cl﹣+ClO﹣ B、NaHCO3溶液中加足量Ba(OH)2溶液:HCO3﹣+Ba2++OH﹣═BaCO3↓+H2O C、酸性溶液中KIO3与KI反应生成I2:IO3﹣+I﹣+6H+═I2+3H2O D、Na2CO3溶液中CO32﹣的水解:CO32﹣+H2O═HCO3﹣+OH﹣7. 研究电化学腐蚀及防护的装置如图所示.下列有关说法错误的是( )
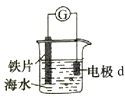 A、d为石墨,铁片腐蚀加快 B、d为石墨,石墨上电极反应为:O2+2H2O+4e﹣→4OH﹣ C、d为锌块,铁片不易被腐蚀 D、d为锌块,铁片上电极反应为:2H++2e﹣→H2↑8. 下列说法不正确的是( )A、油脂皂化反应得到高级脂肪酸盐与甘油 B、在一定条件下,苯分别与液溴、硝酸作用生成溴苯、硝基苯的反应都属于取代反应 C、己烷有4种同分异构体,它们的熔点、沸点各不相同 D、聚合物
A、d为石墨,铁片腐蚀加快 B、d为石墨,石墨上电极反应为:O2+2H2O+4e﹣→4OH﹣ C、d为锌块,铁片不易被腐蚀 D、d为锌块,铁片上电极反应为:2H++2e﹣→H2↑8. 下列说法不正确的是( )A、油脂皂化反应得到高级脂肪酸盐与甘油 B、在一定条件下,苯分别与液溴、硝酸作用生成溴苯、硝基苯的反应都属于取代反应 C、己烷有4种同分异构体,它们的熔点、沸点各不相同 D、聚合物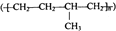 可由单体CH3CH=CH2和CH2=CH2加聚制得
9. 某温度下,向2L恒容密闭容器中充入1.0mol A和1.0mol B,反应A(g)+B(g)⇌C(g)经过一段时间后达到平衡.反应过程中测定的部分数据见下表,下列说法正确的是( )
可由单体CH3CH=CH2和CH2=CH2加聚制得
9. 某温度下,向2L恒容密闭容器中充入1.0mol A和1.0mol B,反应A(g)+B(g)⇌C(g)经过一段时间后达到平衡.反应过程中测定的部分数据见下表,下列说法正确的是( )t/s
0
5
15
25
35
n(A)/mol
1.0
0.85
0.81
0.80
0.80
A、反应在前5 s的平均速率v(A)=0.17 mol•L﹣1•s﹣1 B、保持其他条件不变,升高温度,平衡时c(A)=0.41 mol•L﹣1 , 则反应的△H>0 C、相同温度下,起始时向容器中充入2.0 mol C,达到平衡时,C的转化率大于80% D、相同温度下,起始时向容器中充入0.20 mol A、0.20 mol B和1.0 mol C,反应达到平衡前v(正)<v(逆)10. 下列关于元素的叙述正确的是( )A、目前使用的元素周期表中,最长的周期含有36种元素 B、只有在原子中,质子数才与核外电子数相等 C、金属元素与非金属元素能形成共价化合物 D、非金属元素形成的共价化合物中,原子的最外层电子数只能是2或811. 屠呦呦等科学家用乙醚从青蒿中提取出青蒿素,其结构如图所示,已知结构中含有与H2O2相似的过氧键.下列说法正确的是( )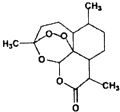 A、青蒿素的结构中含有过氧键受热容易分解 B、乙醚的结构简式为:CH3OCH3 C、青蒿素溶于热水,所以应加热加快溶解 D、乙醚易溶于水,不能用分液的方法分离12. NaOH标准溶液的配制和标定,需经过NaOH溶液配制、基准物质H2C2O4•2H2O的称量以及用NaOH溶液滴定等操作.下列有关说法正确的是( )A、
A、青蒿素的结构中含有过氧键受热容易分解 B、乙醚的结构简式为:CH3OCH3 C、青蒿素溶于热水,所以应加热加快溶解 D、乙醚易溶于水,不能用分液的方法分离12. NaOH标准溶液的配制和标定,需经过NaOH溶液配制、基准物质H2C2O4•2H2O的称量以及用NaOH溶液滴定等操作.下列有关说法正确的是( )A、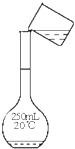 用图所示操作转移NaOH溶液到容量瓶中
B、
用图所示操作转移NaOH溶液到容量瓶中
B、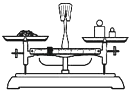 用图所示装置准确称得0.1575gH2C2O4•2H2O固体
C、
用图所示装置准确称得0.1575gH2C2O4•2H2O固体
C、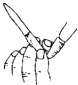 用图所示操作排除碱式滴定管中的气泡
D、
用图所示操作排除碱式滴定管中的气泡
D、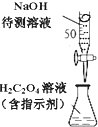 用图所示装置以NaOH待测液滴定H2C2O4溶液
13. 如表物质的分类组合正确的是( )
用图所示装置以NaOH待测液滴定H2C2O4溶液
13. 如表物质的分类组合正确的是( )A
B
C
D
纯净物
纯硫酸
冰醋酸
水玻璃
胆矾
混合物
水煤气
福尔马林
冰水混合物
漂白粉
弱电解质
氨水
氟化氢
氨
水
非电解质
干冰
乙醇
三氧化硫
氯气
A、A B、B C、C D、D14. 如图所示的电解池I和Ⅱ中,a、b、c和d均为Pt电极.电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b>d.符合上述实验结果的盐溶液是( )选项
X
Y
A
AgNO3
Cu(NO3)2
B
MgSO4
CuSO4
C
FeSO4
Al2(SO4)3
D
CuSO4
AgNO3
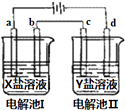 A、A B、B C、C D、D15. 下列溶液中微粒浓度关系一定正确的是( )A、0.1mol/L的硫酸铵溶液中:c(NH4+)>c(SO42﹣)>c(H+) B、室温下,pH=7的醋酸和醋酸钠的混合溶液中:c(CH3COO﹣)>c(Na+) C、将水加热到100℃,pH=6:c(H+)>c(OH﹣) D、同浓度的三种溶液:①CH3COONH4 ②NH4Cl ③NH3•H2O中,c(NH4+)由大到小的顺序是②③①16. 将一定质量的镁、铜合金加入到稀硝酸中,合金完全溶解,假设反应过程中还原产物全部是NO,向所得溶液中加入物质的量浓度为3mol/L的NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述正确的是( )A、反应中转移电子的总数为0.3mol B、反应过程中,消耗硝酸的物质的量为0.3mol C、沉淀完全时消耗NaOH溶液的体积为100mL D、开始加入合金的质量可能为3.4g
A、A B、B C、C D、D15. 下列溶液中微粒浓度关系一定正确的是( )A、0.1mol/L的硫酸铵溶液中:c(NH4+)>c(SO42﹣)>c(H+) B、室温下,pH=7的醋酸和醋酸钠的混合溶液中:c(CH3COO﹣)>c(Na+) C、将水加热到100℃,pH=6:c(H+)>c(OH﹣) D、同浓度的三种溶液:①CH3COONH4 ②NH4Cl ③NH3•H2O中,c(NH4+)由大到小的顺序是②③①16. 将一定质量的镁、铜合金加入到稀硝酸中,合金完全溶解,假设反应过程中还原产物全部是NO,向所得溶液中加入物质的量浓度为3mol/L的NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述正确的是( )A、反应中转移电子的总数为0.3mol B、反应过程中,消耗硝酸的物质的量为0.3mol C、沉淀完全时消耗NaOH溶液的体积为100mL D、开始加入合金的质量可能为3.4g二、非选择题
-
17. A﹣I是中学化学常见的九种物质,A﹣I之间的转化关系如图所示.
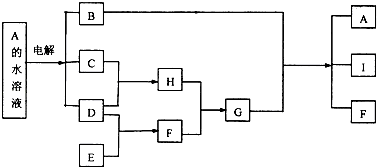
已知化合物A的焰色反应显黄色,C、D、E是气态单质,F、H是气态化合物,两者在通常状况下反应产生大量白烟.请回答下列问题:
(1)、写出I的电子式;(2)、写出电解A溶液的离子反应方程式;(3)、以F、空气和水为原料经过一系列的化学反应可以合成酸M,M的浓溶液与铜反应产生红棕色气体,写出M的浓溶液与铜反应的化学方程式 .(4)、G的溶液可使Mg(OH)2悬浊液溶解.若Mg(OH)2饱和溶液中的c(Mg2+)=0.18mol/L,则溶液的pH是 . (已知:Ksp[Mg(OH)2]=1.8×10﹣11mol/L)18. 硒鼓回收料含硒约97%,其余为约3%的碲和微量的氯.从该回收料中回收硒的工艺流程如图所示(已知煅烧过程中,回收料中的硒、碲被氧化成SeO2和TeO2):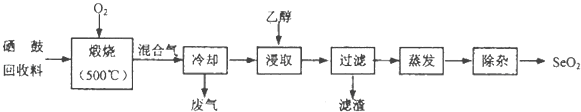
部分物质的物理性质如表:
物质
熔点
沸点
溶解度
SeO2
340℃(315℃升华)
684℃
易溶于水和乙醇
TeO2
733℃(450℃升华)
1260℃
微溶于水,不溶于乙醇
回答下列问题:
(1)、Se与S是同族元素,比S多1个电子层,Se在元素周期表的位置为;H2Se的热稳定性比H2S的热稳定性(填“强”或“弱”).(2)、乙醇浸取后过滤所得滤渣的主要成分是 . 蒸发除去溶剂后,所得固体中仍含有少量TeO2杂质,除杂时适宜采用的方法是 .(3)、SeO2易溶于水得到H2SeO3溶液,向溶液中通入HI气体后,再加入淀粉溶液,溶液变蓝色,同时生成Se沉淀,写出反应的化学方程式 .(4)、已知H2SeO3的电离常数K1=3.5×10﹣3、K2=5.0×10﹣8 , 回答下列问题:①Na2SeO3溶液呈性,原因是(用离子方程式表示);
②在Na2SeO3溶液中,下列关系式正确的是:
A.c(Na+)+c(H+)=c(SeO32﹣)+c(HSeO3﹣)+c(OH﹣)
B.2c(Na+)=c(SeO32﹣)+c(HSeO3﹣)+c(H2SeO3)
C.c(Na+)=2c(SeO32﹣)+2c(HSeO3﹣)+2c(H2SeO3)
D.c(OH﹣)=c(H+)+c(HSeO3﹣)+c(H2SeO3)
19. 甲醇是重要的化工原料,又可做为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:ⅠCO(g)+2H2(g)⇌CH3OH(g)△H1
ⅡCO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H2=﹣58kJ/mol
ⅢCO2(g)+H2(g)⇌CO(g)+H2O(g)△H3
回答下列问题:
(1)、物质的标准生成热是常用的化学热力学数据,可以用来计算化学反应热.即化学反应热:△H=生成物标准生成热综合﹣反应物标准生成热总和.已知四种物质的标准生成热如表:
物质
CO
CO2
H2
CH3OH(g)
标准生成热(kJ/mol)
﹣110.52
﹣393.51
0
﹣201.25
A.计算△H1=kJ/mol B.△H30(填=、<、>)
(2)、由甲醇在一定条件下制备甲醚.一定温度下,在三个体积均为1.0L的恒容密闭容器中发生反应:2CH3OH(g)⇌CH3OCH3(g)+H2O(g).实验数据见表:容器编号
温度(℃)
起始物质的量(mol)
平衡物质的量(mol)
CH3OH(g)
CH3OCH3(g)
H2O(g)
CH3OCH3(g)
H2O(g)
a
387
0.20
0
0
0.080
0.080
b
387
0.40
0
0
c
207
0.20
0
0
0.090
0.090
下列说法正确的是
A、该反应的正反应为放热反应 B、达到平衡时,容器a中的CH3OH体积分数比容器b中的小 C、容器a中反应到达平衡所需时间比容器c中的长 D、若起始时向容器a中充入CH3OH 0.15mol、CH3OCH3 0.15mol和H2O 0.10mol,则反应将向正反应方向进行(3)、合成气的组成 =2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图所示.①α(CO)值随温度升高而(填“增大”或“减小”),其原因是 .
②图中P1、P2、P3的大小关系为 , 其判断理由是 .
(4)、甲醇可以制成燃料电池,与合成气制成燃料电池相比优点是:;若以硫酸作为电解质其负极反应为: . 20. 实验室用如图所示装置制取溴化亚铁.D和d中均盛有液溴,E为外套电炉丝的瓷管,e是两只耐高温的瓷皿,其中共盛有56g细铁粉.实验开始时先将干燥、纯净的CO2气流通入D中,然后将铁粉加热至600℃~700℃,E管中反应开始.E中的反应为:
20. 实验室用如图所示装置制取溴化亚铁.D和d中均盛有液溴,E为外套电炉丝的瓷管,e是两只耐高温的瓷皿,其中共盛有56g细铁粉.实验开始时先将干燥、纯净的CO2气流通入D中,然后将铁粉加热至600℃~700℃,E管中反应开始.E中的反应为:2Fe+3Br2═2FeBr3 , 2FeBr3 2FeBr2+Br2↑,
最后将d中液溴滴入100℃~120℃的D中,经过几小时的连续反应,在铁管的一端沉积有黄绿色鳞片状溴化亚铁80g.
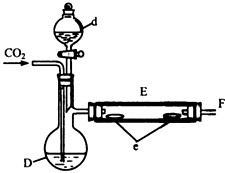
请回答:
(1)、仪器d的名称 .(2)、导入的CO2不干燥,会在E中发生副反应,其含铁副产物为;若所得产物中含此副产物,用化学方法检验.下列方案合理的是 .A.取少量产物于试管中加入稀盐酸,再加入KSCN溶液
B.取少量产物于硬质大试管中,通入氢气,排尽空气后加热,用CuSO4检验生成的水蒸气
C.用磁铁吸引,看产物能否被吸引
D.取少量产物于试管中加入蒸馏水,过滤看是否有黑色不溶物
(3)、为防止污染空气,实验时应在F处连接盛有NaOH溶液的尾气吸收装置,反应的化学方程式: .(4)、取产品10g配制成250mL溶液,取出25.00mL用酸性KMnO4溶液滴定溶液中的Fe2+ , 用去0.03000mol/L酸性KMnO4溶液25.00mL,则产品的纯度为 .(5)、利用除去杂质后的FeBr2可以验证Cl2、Fe3+、Br2的氧化性强弱.将你设计的实验操作、预计的实验现象和实验结论(氧化性强弱)填写在下列表空格内:实验操作
实验现象
氧化性强弱
①
溶液呈血红色
②
③
④
Cl2>Br2
21. 已知: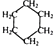 可用键线式表示为
可用键线式表示为  ,
, 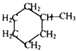 可用键线式表示为
可用键线式表示为  ;
; 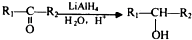 ;
;几种化合物有如图的转化关系:
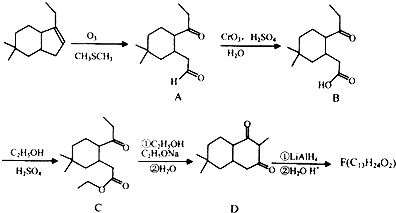 (1)、A→B的反应类型;(2)、F的结构简式;(3)、写出B→C的化学反应的方程式;(4)、同时符合下列三个条件的B的同分异构体有种(不考虑立体异构);
(1)、A→B的反应类型;(2)、F的结构简式;(3)、写出B→C的化学反应的方程式;(4)、同时符合下列三个条件的B的同分异构体有种(不考虑立体异构);Ⅰ含
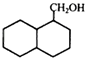 结构
结构Ⅱ属于酯类化合物
Ⅲ不能发生银镜反应.
写出其中一种同分异构体的结构简式 .
(5)、写出由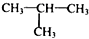 制
制 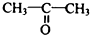 的流程图并注明反应条件.
的流程图并注明反应条件.