2015-2016学年北京市丰台区高三上学期期末化学试卷
试卷更新日期:2017-03-07 类型:期末考试
一、选择题
-
1. 在下列自然资源的开发利用中,不涉及化学变化的是( )A、用蒸馏法淡化海水 B、用铁矿石冶炼铁 C、用石油裂解生产乙烯 D、用煤生产水煤气2. 下列化学用语正确的是( )A、乙酸的结构简式:C2H4O2 B、氯化氢的电子式:
 C、镁的原子结构示意图:
C、镁的原子结构示意图:  D、水的电离方程式:H2O═H++OH﹣
3. 设NA为阿伏加德罗常数的值.下列说法正确的是( )A、1mol 18O含有的中子数为10NA B、22.4L甲烷气体中所含分子数目为NA C、1L 0.1mol•L﹣1NH4Cl 溶液中NH4+数目为 0.1NA D、1L pH=1的醋酸溶液中,CH3COOH分子的数目为0.1NA4. 下列表示物质用途的化学方程式不正确的是( )A、用硅酸钠与盐酸反应制备硅胶:SiO32﹣+2H+═H2SiO3(胶体) B、用二氧化硅与烧碱反应制备硅酸钠:SiO2+OH﹣═SiO32﹣+H2O C、用铝热法炼铁:2Al+Fe2O3 2Fe+Al2O3 D、用氯气制备漂白粉:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O5. 依据元素周期表及元素周期律,下列推断正确的是( )A、碱性:Ca(OH)2>Mg(OH)2 B、酸性:H3BO3>H2CO3 C、热稳定性:NH3<PH3 D、还原性:S2﹣<F﹣6. 下列物质的分类依据、类别、性质三者之间对应关系完全正确的是( )
D、水的电离方程式:H2O═H++OH﹣
3. 设NA为阿伏加德罗常数的值.下列说法正确的是( )A、1mol 18O含有的中子数为10NA B、22.4L甲烷气体中所含分子数目为NA C、1L 0.1mol•L﹣1NH4Cl 溶液中NH4+数目为 0.1NA D、1L pH=1的醋酸溶液中,CH3COOH分子的数目为0.1NA4. 下列表示物质用途的化学方程式不正确的是( )A、用硅酸钠与盐酸反应制备硅胶:SiO32﹣+2H+═H2SiO3(胶体) B、用二氧化硅与烧碱反应制备硅酸钠:SiO2+OH﹣═SiO32﹣+H2O C、用铝热法炼铁:2Al+Fe2O3 2Fe+Al2O3 D、用氯气制备漂白粉:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O5. 依据元素周期表及元素周期律,下列推断正确的是( )A、碱性:Ca(OH)2>Mg(OH)2 B、酸性:H3BO3>H2CO3 C、热稳定性:NH3<PH3 D、还原性:S2﹣<F﹣6. 下列物质的分类依据、类别、性质三者之间对应关系完全正确的是( )物质
分类依据
类别
性质
A
FeCl2
铁元素化合价
还原剂
可与O2、Zn等发生反应
B
FeCl2
电离产生的微粒
盐
可发生水解反应,溶液显碱性
C
HNO3
在水中能电离出H+
酸
可与CuO反应生成NO
D
HNO3
氮元素的化合价
氧化剂
可与Al、I﹣等发生反应
A、A B、B C、C D、D7. 某同学在实验室利用氢氧化钠、盐酸分离铁粉和铝粉混合物,物质转化关系如图所示:
下列说法不正确的是( )
A、x为NaOH溶液,y为盐酸 B、a→b发生的反应为:AlO2﹣+H++H2O═Al(OH)3↓ C、b→c→Al的反应条件分别为:加热、电解 D、a、b、c既能与酸又能与碱反应8. 将氯气分别通入下列溶液中,由实验现象得出的结论正确的是( )选项
氯气通入下列溶液中
实验现象
结论
A
滴有KSCN的FeCl2溶液
变红
氯气具有还原性
B
滴有酚酞的NaOH溶液
褪色
氯气具有漂白性
C
紫色石蕊溶液
先变红后褪色
氯气具有酸性、漂白性
D
少量氯气通入大量水中
溶液pH<7
呈浅黄绿色
氯气与水反应生成酸性物质,
且该反应为可逆反应
A、A B、B C、C D、D9. 某同学研究浓度对化学平衡的影响,下列说法正确的是( )已知:

步骤:

现象:
待试管b中颜色不变后与试管a比较,溶液颜色变浅.
滴加浓硫酸,试管c温度略有升高,溶液颜色与试管a相比,变深.
A、该反应是一个氧化还原反应 B、待试管b中溶液颜色不变的目的是使Cr2O72﹣完全反应 C、该实验不能证明减小生成物浓度,平衡正向移动 D、试管c中的现象说明影响平衡的主要因素是温度10. 下列有关2个电化学装置的叙述正确的是( )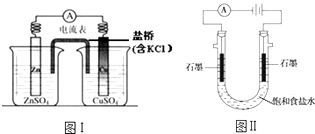 A、图Ⅰ,电流形成的完整过程是:负极Zn﹣2e﹣═Zn2+ , 电子经导线流向正极,正极Cu2++2e﹣═Cu B、图Ⅰ,在不改变总反应的前提下,可用Na2SO4替换ZnSO4 , 用石墨替换Cu棒 C、图Ⅱ,通电后H+和Na+先从阳极区移动到阴极,然后阴极才发生反应2H++2e﹣═H2↑ D、图Ⅱ,通电后,由于OH﹣向阳极迁移,导致阳极附近pH升高11. 下列实验事实不能用基团间相互作用来解释的是( )A、与Na反应时,乙醇的反应速率比水慢 B、苯酚能与NaOH溶液反应而乙醇不能 C、乙醇能使重铬酸钾溶液褪色而乙酸不能 D、苯、甲苯发生硝化反应生成一硝基取代产物时,甲苯的反应温度更低12. 下列说法正确的是( )A、蔗糖与麦芽糖都具有还原性,水解产物都是葡萄糖 B、淀粉和纤维素互为同分异构体,水解产物都是葡萄糖 C、蛋白质在酶的作用下,水解为多肽,最终生成氨基酸 D、植物油和动物油都是高级脂肪酸甘油酯,前者的饱和程度更高13. 下列说法不正确的是( )A、室温下,在水中的溶解度:乙二醇>乙醇>苯酚 B、用质谱法可确定有机物分子中的官能团 C、用核磁共振氢谱能够区分CH3CH2CHO和CH3COCH3 D、乙二酸、甲醛、苯乙烯均可发生聚合反应14. 在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:C (s)+2NO(g)⇌CO2(g)+N2(g),平衡时c (NO)与温度T的关系如图所示,则下列说法正确的是( )
A、图Ⅰ,电流形成的完整过程是:负极Zn﹣2e﹣═Zn2+ , 电子经导线流向正极,正极Cu2++2e﹣═Cu B、图Ⅰ,在不改变总反应的前提下,可用Na2SO4替换ZnSO4 , 用石墨替换Cu棒 C、图Ⅱ,通电后H+和Na+先从阳极区移动到阴极,然后阴极才发生反应2H++2e﹣═H2↑ D、图Ⅱ,通电后,由于OH﹣向阳极迁移,导致阳极附近pH升高11. 下列实验事实不能用基团间相互作用来解释的是( )A、与Na反应时,乙醇的反应速率比水慢 B、苯酚能与NaOH溶液反应而乙醇不能 C、乙醇能使重铬酸钾溶液褪色而乙酸不能 D、苯、甲苯发生硝化反应生成一硝基取代产物时,甲苯的反应温度更低12. 下列说法正确的是( )A、蔗糖与麦芽糖都具有还原性,水解产物都是葡萄糖 B、淀粉和纤维素互为同分异构体,水解产物都是葡萄糖 C、蛋白质在酶的作用下,水解为多肽,最终生成氨基酸 D、植物油和动物油都是高级脂肪酸甘油酯,前者的饱和程度更高13. 下列说法不正确的是( )A、室温下,在水中的溶解度:乙二醇>乙醇>苯酚 B、用质谱法可确定有机物分子中的官能团 C、用核磁共振氢谱能够区分CH3CH2CHO和CH3COCH3 D、乙二酸、甲醛、苯乙烯均可发生聚合反应14. 在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:C (s)+2NO(g)⇌CO2(g)+N2(g),平衡时c (NO)与温度T的关系如图所示,则下列说法正确的是( ) A、该反应的△H>0 B、若该反应在T1 , T2时的平衡常数分别为K1 , K2 , 则K1<K2 C、在T2时,若反应体系处于状态D,则此时v正>v逆 D、若状态B,C,D的压强分别为PB , PC , PD , 则 PC=PD>PB
A、该反应的△H>0 B、若该反应在T1 , T2时的平衡常数分别为K1 , K2 , 则K1<K2 C、在T2时,若反应体系处于状态D,则此时v正>v逆 D、若状态B,C,D的压强分别为PB , PC , PD , 则 PC=PD>PB二、解答题
-
15. 某同学在实验室研究Na2CO3和NaHCO3的性质及相互转化.(1)、分别向浓度均为0.1mol/LNa2CO3及NaHCO3溶液中滴加几滴酚酞试剂:
①Na2CO3溶液由无色变为红色,其原因是 .
②NaHCO3溶液也由无色变为红色,其原因是 .
③比较两份溶液的颜色,红色较浅的是(填化学式).
(2)、研究NaHCO3与CaCl2的反应.实验序号
实验操作
实验现象
实验1
向2mL 0.001mol/L NaHCO3溶液中加入1mL 0.1mol/LCaCl2溶液
无明显变化.用激光笔照射,没有出现光亮的通路.
实验2
向2mL 0.1mol/L NaHCO3溶液中加入1mL 0.1mol/LCaCl2溶液
略显白色均匀的浑浊,用激光笔照射,出现光亮的通路.
①实验1中没有出现白色浑浊的原因是 .
②实验2中形成的分散系属于 .
③用离子方程式表示实验2中发生的反应 .
(3)、在不引入其他杂质的前提下,实现Na2CO3与NaHCO3之间的转化,请在图中标出所用的试剂、用量或物质的浓度(反应前后溶液体积的变化可忽略). 16. 实验室利用下列装置模拟工业生产制备少量硝酸.
16. 实验室利用下列装置模拟工业生产制备少量硝酸. (1)、B中试剂为 , NaOH溶液的作用是 .(2)、用过氧化钠与水反应制备氧气的化学方程式为 .(3)、实验时先用酒精喷灯预热催化剂,然后通入反应气体,当催化剂红热后撤离酒精喷灯,催化剂始终保持红热,温度可达到700℃以上.下列图示中,能够正确表示该反应过程能量变化的是 .A、
(1)、B中试剂为 , NaOH溶液的作用是 .(2)、用过氧化钠与水反应制备氧气的化学方程式为 .(3)、实验时先用酒精喷灯预热催化剂,然后通入反应气体,当催化剂红热后撤离酒精喷灯,催化剂始终保持红热,温度可达到700℃以上.下列图示中,能够正确表示该反应过程能量变化的是 .A、 B、
B、 C、
C、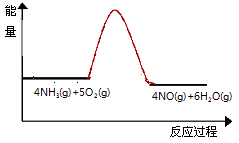 D、
D、 (4)、已知2NO2(g)⇌2NO(g)+O2(g)△H
(4)、已知2NO2(g)⇌2NO(g)+O2(g)△HNO2(g) N(g)+2O(g)
NO(g) N(g)+O(g)
O2(g) 2O(g)
①计算反应的△H= .
②请解释高温下,氨气与氧气反应难以生成NO2的原因 .
(5)、控制氨气和氧气的比例是制备硝酸的关键.①当比例不合适时,A中不仅有红棕色气体产生,还伴有白烟.请用化学方程式表示白烟产生的原因 .
②欲使氨气尽可能完全转化为硝酸,理论上n(NH3):n(O2)的最佳比例为 .
17. 将氯碱工业与燃料电池联合能够有效降低能源消耗,如图是该工艺的图示(电源及电极未标出),请回答下列问题: (1)、电解饱和食盐水(氯碱工业)的化学方程式为 .(2)、物质X为 , 装置Ⅰ和Ⅱ中属于燃料电池的是 .(3)、装置Ⅰ中,NaOH溶液浓度m%n% (填“>”或“<”).(4)、利用装置Ⅱ可获得10mol/L盐酸,该产品出口为(填“A”或“B”),请说明理由 .18. 某学习小组在实验室研究SO2与Ba(NO3)2溶液的反应:
(1)、电解饱和食盐水(氯碱工业)的化学方程式为 .(2)、物质X为 , 装置Ⅰ和Ⅱ中属于燃料电池的是 .(3)、装置Ⅰ中,NaOH溶液浓度m%n% (填“>”或“<”).(4)、利用装置Ⅱ可获得10mol/L盐酸,该产品出口为(填“A”或“B”),请说明理由 .18. 某学习小组在实验室研究SO2与Ba(NO3)2溶液的反应:实验:向盛有2mL 0.1mol/L Ba(NO3)2溶液的试管中,缓慢通入SO2气体,试管内有白色沉淀产生,液面上方略显浅棕色.
探究1:白色沉淀产生的原因.
(1)、白色沉淀是 .(2)、分析白色沉淀产生的原因,甲同学认为是NO3﹣氧化了SO2 , 乙同学认为是溶液中溶解的O2氧化了SO2 .①支持甲同学观点的实验证据是 .
②依据甲的推断,请写出Ba(NO3)2溶液与SO2反应的离子方程式 .
(3)、乙同学通过下列实验证明了自己的推测正确,请完成实验方案:实验操作
实验现象
向2mLmol/L溶液(填化学式)中通入SO2
(4)、探究2:在氧化SO2的过程中,NO3﹣和O2哪种微粒起到了主要作用.实验操作
实验数据
向烧杯中加入煮沸了的0.1mol/L的BaCl2溶液25mL,再加入25mL植物油,冷却至室温,用pH传感器测定溶液pH随时间(t)的变化曲线
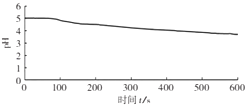
图1:向BaCl2(无氧)溶液中通入SO2
向烧杯中分别加入25mL 0.1mol/L的BaCl2溶液、Ba(NO3)2溶液,通入SO2 , 用pH传感器分别测定溶液pH随时间(t)变化的曲线.

图2:分别向BaCl2、Ba(NO3)2溶液中通入SO2
图1,在无氧条件下,BaCl2溶液pH下降的原因是 .
(5)、图2,BaCl2溶液中发生反应的离子方程式为 .(6)、依据上述图象你得出的结论是 , 说明理由 .19. EHPB是合成治疗高血压和充血性心力衰竭的药物的中间体,合成路线如下:
已知:
ⅰ碳碳双键容易被氧化
ⅱ
 +Cl2
+Cl2

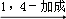

ⅲ
 (1)、A的名称是 , A形成的顺丁橡胶的结构式是(选填字母).
(1)、A的名称是 , A形成的顺丁橡胶的结构式是(选填字母).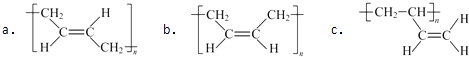 (2)、已知1molE发生银镜反应可生成4molAg.E中含氧官能团的名称为 .(3)、E由B经①、②、③合成.
(2)、已知1molE发生银镜反应可生成4molAg.E中含氧官能团的名称为 .(3)、E由B经①、②、③合成.a.①的反应试剂和条件是 .
b.②、③的反应类型依次是、 .
(4)、1molF转化成G所消耗的NaOH的物质的量为 mol.(5)、M的结构简式为 .(6)、完成下列化学方程式:①EHPB不能与NaHCO3反应,有机物N→EHPB的化学方程式为
②有机物K与试剂x发生反应的化学方程式为 .
(7)、有机物N有多种同分异构体,写出一种满足下列条件的同分异构体的结构简式 .a.含有酚羟基 b.既能水解又能发生银镜反应
c.苯环上的一氯代物只有一种 d.核磁共振氢谱有5组峰.