第8讲:铜及其化合物 金属的冶炼
试卷更新日期:2018-09-30 类型:一轮复习
一、单选题
-
1. 中国文化源远流长,下列对描述内容所做的相关分析错误的是( )
选项
描述
分析
A
“熬胆矾铁釜,久之亦化为铜”
其反应原理是电镀
B
“以火烧之,紫青烟起,乃真硝石(KNO3)”
“紫青烟”是因为发生了焰色反应
C
“司南之杓(勺),投之于地,其柢(勺柄)指南”
司南中“杓”的材质为Fe3O4
D
“用浓酒和糟入甑,蒸令气上,用器承滴露”
其中涉及的操作是蒸馏
A、A B、B C、C D、D2. 明代《天工开物》中记载:“凡铸钱每十斤,红铜居六七,倭铅(锌的古称)居三四。” 下列金属的冶炼原理与倭铅相同的是( )A、Na B、Au C、Al D、Fe3. 下列说法中,正确的是( )A、二氧化硅可用来制造太阳能电池 B、需要加热才能进行的反应一定是吸热反应 C、铜的金属性比铝弱,可以用铜罐贮运浓硝酸 D、NaOH溶液不能保存在带磨口玻璃塞的试剂瓶中4. 铜与过量的浓硝酸反应,当有0.2mol硝酸被还原时,参加反应的铜为( )A、0.05mol B、0.1mol C、0.2mol D、0.04mol5. 向铁和铜的混合物中加入一定量的稀硫酸,反应后剩余了m1克金属,再继续加入一定量的硝酸钠溶液后剩余了m2克金属,则m1和 m2的大小关系正确的是( )A、m1=m2 B、m1>m2 C、m1<m2 D、m1≥m26. 下列有关物质的工业制法中,错误的是( )A、制硅:用焦炭还原二氧化硅得硅 B、制钠:以海水为原料制得NaCl,再电解熔融NaCl得钠 C、制铁:以焦炭和铁矿石为原料,用CO还原铁矿石得铁 D、制镁:以海水为原料,经一系列过程制得氯化镁,用H2还原MgCl2得镁7. 把mg铜丝灼烧变黑,立即放入下列物质中,能使铜丝变红但质量减小的是( )A、NaOH溶液 B、CH3COOH C、水 D、CH3CH2OH8. 使用单质铜制硝酸铜,耗用原料最经济,而且对环境几乎没有污染的是( )A、Cu Cu(NO3)2 B、Cu CuO Cu(NO3)2 C、Cu Cu(NO3)2 D、Cu CuCl2 Cu(NO3)29. 铜锈的主要成分是碱式碳酸铜。碱式碳酸铜受热分解的化学方程式为: Cu2(OH)2CO3 2CuO+X+CO2↑。下列说法正确的是( )A、反应前后固体物质中铜元素的质量分数不变 B、碱式碳酸铜中铜原子和氧原子的质量比为 8:5 C、X 是相对分子质量最小的氧化物 D、加热 Cu2(OH)2CO3 的实验装置和实验室用双氧水制取 O2 的发生装置相同10. 取一定质量的铜片和一定体积的浓硫酸放在烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,若要使铜片继续溶解可向烧瓶中加入( )A、稀H2SO4 B、稀盐酸 C、K2SO4固体 D、KNO3固体11. 下列金属冶炼的反应原理,错误的是( )A、MgCl2(熔融) Mg+Cl2↑ B、Al2O3+3H2 2Al+3H2O C、Fe3O4+4CO 3Fe+4CO2 D、2HgO 2Hg+O2↑12. 下列叙述正确的是( )A、SO2具有还原性,故可作漂白剂 B、Na的金属活性比Mg强,故可用Na与MgCl2溶液反应制Mg C、浓硝酸中的HNO3见光易分解,故有时在实验室看到的浓硝酸呈黄色 D、Fe在Cl2中燃烧生成FeCl3 , 故在与其他非金属反应的产物中的Fe也显+3价13. 把质量为m g的铜丝灼烧变黑,立即放入下列物质中,使铜丝变红,而且质量仍为m g的是( )①稀硫酸 ②C2H5OH ③稀硝酸 ④CO.
A、①② B、②④ C、③④ D、②③14. CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示.下列说法正确的是( )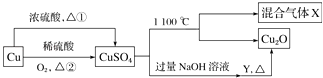 A、相对于途径②,途径①更好地体现了绿色化学思想 B、X可能是SO2和SO3的混合气体 C、Y可以是葡萄糖溶液 D、将CuSO4溶液蒸发,利用余热蒸干,可制得胆矾晶体
A、相对于途径②,途径①更好地体现了绿色化学思想 B、X可能是SO2和SO3的混合气体 C、Y可以是葡萄糖溶液 D、将CuSO4溶液蒸发,利用余热蒸干,可制得胆矾晶体二、填空题
-
15. 在浓硝酸中放入铜片:
①开始反应的化学方程式为 .
②若铜有剩余,则反应将要结束时的反应的离子方程是:
③待反应停止后,再加入少量的25%的稀硫酸,这时铜片上又有气泡产生,其原因是 .
三、综合题
-
16. 自然界中,金属元素大多以化合态存在,通过金属冶炼得到金属单质.工业上生产Na、Ca、Mg都用电解其熔融的氯化物,但生产钾是用金属钠和熔化的KCl在一定的条件下反应制取:KCl+Na⇌NaCl+K+Q (Q<0)
有关数据如表:
熔点℃
沸点℃
密度 (g/cm3)
Na
97.8
882.9
0.97
K
63.7
774
0.86
NaCl
801
1413
2.165
KCl
770
1500
1.984
(1)、请结合平衡移动理论分析,为什么能用该反应制备金属钾. .(2)、在常压下金属钾转为气态从反应混合物中分离的最低温度约为℃,而反应的最高温度应低于℃.(3)、在制取金属钾的过程中,为了提高原料的转化率可采取的措施有 . (任写两点)(4)、相比于电解熔融氯化钾,此方法的优点有(5)、常压下,当反应温度升高到900℃时,该反应的平衡常数可表示为k=17. 工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如图:
已知:Cu2O+2H+=Cu+Cu2++H2O
(1)、实验操作I的名称为;在空气中灼烧固体混合物D时,用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有(填仪器名称).(2)、滤液A中存在的阳离子有 , 固体混合物B经过提纯后可得SiO2 , 写出它的一种用途(3)、金属E与固体F发生的某一反应可用于焊接钢轨,该反应的化学方程为 .(4)、常温下,等pH的NaAlO2和NaOH两份溶液中,由水电离出的c(OH﹣)前者为后者的108倍,则两种溶液的pH= .(5)、从浓硫酸、浓硝酸、蒸馏水中选用合适的试剂,测定粗铜样品中金属铜的质量分数,涉及的主要步骤为:称取一定质量的样品→→过滤、洗涤、干燥→称量剩余固体铜的质量.(填缺少的操作步骤,不必描述操作过程的细节)(6)、利用电解法进行粗铜精炼时,下列叙述正确的是(填代号).a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c.精铜作阴极,电解后电解液中Cu2+浓度减小
d.粗铜精炼时通过的电量与阴极析出铜的量无确定关系.
18.研究铜及其化合物的性质对科研、生产生活有重要的意义.
(1)铜可采用如下方法制备
①火法炼铜:Cu2S+O2
 2Cu+SO2
2Cu+SO2②湿法炼铜:CuSO4+Fe═FeSO4+Cu
上述两种方法中,铜元素均被 (填“氧化”或“还原”)成铜单质,若用①法每制得32gCu,转移电子的物质的量是 .
(2)在潮湿的空气中铜可以发生电化学腐蚀,生成铜绿,铜绿的化学式为 发生腐蚀的正极反应式为 ,由铜和锌组成的黄铜合金不易生锈,其防腐蚀的方法是 .
(3)①Li﹣﹣CuO电池总反应为:2Li+CuO═Li2O+Cu.电解质溶液为高氯酸锂有机溶液,电池的正极反应式为 .
②Cu2O是一种半导体材料,可在碱性溶液中用电解法制取,电解总反应式为:
2Cu+H2O
 Cu2O+H2↑,阳极反应式为 ;Cu2O投入稀硫酸中,得到蓝色溶液和红色沉淀,写出该反应的离子方程式 .
Cu2O+H2↑,阳极反应式为 ;Cu2O投入稀硫酸中,得到蓝色溶液和红色沉淀,写出该反应的离子方程式 .(4)为了回收粗铜精炼后阳极泥中的Ag和Au,某实验小组查阅了有关资料如下表:
编号
常温下反应
化学平衡常数
反应甲
Au+6HNO3⇌Au(NO3)3+3NO2↑+3H2O
<10﹣5
反应乙
Au3++4Cl﹣⇌[AuCl4]﹣
>105
从资料中可知,常温下金很难与硝酸反应,但却可溶于王水(浓硝酸与浓盐酸体积比为l:3的混合物).请你运用化学平衡移动原理,简要说明金能溶于王水的原因 .
-