第7讲:铁及其化合物
试卷更新日期:2018-09-30 类型:一轮复习
一、单选题
-
1. 下列关于铁与水反应的描述不正确的是( )A、铁与水蒸气反应的产物是黑色的Fe2O3 B、红热的铁能与水蒸气反应,放出的气体点燃时能发出爆鸣声 C、铁与水蒸气的反应是氧化还原反应 D、常温下,Fe与H2O不反应,但在空气中O2、CO2、H2O的共同作用下能发生反应2. 元素X的单质及X 与Y形成的化合物能发生如图所示的转化,则X 为( )
 A、Cu B、Fe C、S D、C3. 检验硫酸铁溶液中是否含有硫酸亚铁,可选用的试剂是( )A、NaOH 溶液 B、酸性 KMnO4 溶液 C、KSCN 溶液 D、Cu4. 已知硝酸能将Fe2+氧化为Fe3+ . 下列物质反应后能使KSCN溶液变红的是( )
A、Cu B、Fe C、S D、C3. 检验硫酸铁溶液中是否含有硫酸亚铁,可选用的试剂是( )A、NaOH 溶液 B、酸性 KMnO4 溶液 C、KSCN 溶液 D、Cu4. 已知硝酸能将Fe2+氧化为Fe3+ . 下列物质反应后能使KSCN溶液变红的是( )①过量的Fe与Cl2反应
②Fe和过量稀硫酸反应
③FeCl2溶液中通入少量Cl2
④Fe和Fe2O3的混合物溶于盐酸中
⑤向Fe(NO3)2溶液中加入过量稀硫酸.
A、只有① B、只有①③⑤ C、只有①②③ D、全部5. 下列变化不能通过一步反应直接完成的是( )A、Fe→Fe3+ B、Fe→Fe3O4 C、Al(OH)3→Al2O3 D、Al→Al(OH)36. 一定条件下A、B、C的如图所示的转化关系,且△H=△H1+△H2 . 则A、C可能是( )
①Fe、FeCl3
②C、CO2
③AlCl3、NaAlO2
④NaOH、NaHCO3
⑤S、SO3
⑥Na2CO3、CO2 .
A、②③④⑥ B、②③④⑤⑥ C、①②③④⑥ D、①②③④⑤⑥7. 为了探究铁及其化合物的氧化性或还原性,某同学设计如下实验方案,其中符合实验要求且完全正确的是( )
选项
实验操作
实验现象
实验结论
离子反应
A
向FeCl2溶液中加入Zn片
浅绿色溶液变为无色
Zn具有还原性
Fe2++Zn═Zn2++Fe
B
向FeCl2溶液中滴新制氯水
浅绿色溶液变为棕黄色
Fe2+具有还原性
2Fe2++Cl2═2Fe3++2Cl﹣
C
向FeCl3溶液中加入铁粉
棕黄色溶液变为浅绿色
Fe具有还原性
Fe+Fe3+═2Fe2+
D
向FeCl3溶液中加入铜粉
蓝色溶液变为棕黄色
Fe3+具有氧化性
Fe3++Cu═Fe2++Cu2+
A、A B、B C、C D、D8. 一定条件下,下列各组物质能一步实现如图所示转化关系的是( )选项
X
Y
Z
W
A
Al
Al2O3
NaAlO2
Al(OH)3
B
Fe2O3
Fe
FeCl2
FeCl3
C
H2SO4
SO2
S
SO3
D
NH3
N2
NO
NO2
 A、A B、B C、C D、D9. 硫酸亚铁铵[(NH4)2Fe(SO4)2]是一种重要的化工原料,下列有关说法正确的是( )
A、A B、B C、C D、D9. 硫酸亚铁铵[(NH4)2Fe(SO4)2]是一种重要的化工原料,下列有关说法正确的是( )
A、Na+、Fe3+、NO3﹣、Cl2都可在该物质的溶液中大量共存 B、 向0.1mol·L﹣1该物质的溶液中滴加0.1mol·L﹣1NaOH溶液,生成沉淀的物质的量与逐滴加入NaOH溶液体积关系如图所示
C、检验该物质中Fe2+是否变质的方法是向该物质的溶液中滴入几滴KSCN溶液,观察溶液是否变红色
D、向该物质的溶液中摘加Ba(OH)2溶液,恰好使SO42﹣完全沉淀的离子方程式为:Fe2++2SO42﹣+3Ba2++2OH﹣═2BaSO4↓+Fe(OH)2↓
10. 常温下,将一定量的铁粉加入到50 mL10mol/L硝酸(①)中,待其充分反应后,收集到的气体换算成标准状况下的体积为4.2L(②),所得溶液能够使淀粉碘化钾溶液变蓝(③),该溶液也能使酸性高锰酸钾褪色(④)。下列说法正确的是( )A、①中数据表明,硝酸是浓硝酸,因此Fe已经钝化 B、②中数据表明,生成的气体中只有NO2 C、③中现象表明,硝酸一定有剩余 D、④中现象表明,溶液中一定含有Fe2+11. 在给定条件下,下列选项所示的物质间转化均能实现的是( )A、Fe FeCl3 Fe(OH)3 B、S SO3 H2SO4 C、NaOH Na2O Na2SiO3 D、NH3 NO HNO312. FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断正确的是( )A、溶液中一定含Cu2+ B、溶液中不一定含Fe2+ C、剩余固体一定含Cu和Fe D、加入KSCN溶液一定不变红色13. 在FeCl2和AlCl3的混合溶液中加入过量的氨水,直至溶液中沉淀的量不再改变为止。经过滤、洗涤、干燥、在空气中灼烧,最终剩余固体的成分是 ( )A、Fe2O3、Al2O3 B、Fe2O3 C、Fe (OH)2、Al(OH)3 D、Fe(OH)3、Al(OH)314. 下列有关铁及其化合物的说法中正确的是( )A、赤铁矿的主要成分是Fe3O4 B、铁与水蒸气在高温下的反应产物为Fe2O3和H2 C、除去FeCl2溶液中的FeCl3杂质可以向溶液中加入铁粉,然后过滤 D、Fe3+与KSCN溶液产生红色沉淀
向0.1mol·L﹣1该物质的溶液中滴加0.1mol·L﹣1NaOH溶液,生成沉淀的物质的量与逐滴加入NaOH溶液体积关系如图所示
C、检验该物质中Fe2+是否变质的方法是向该物质的溶液中滴入几滴KSCN溶液,观察溶液是否变红色
D、向该物质的溶液中摘加Ba(OH)2溶液,恰好使SO42﹣完全沉淀的离子方程式为:Fe2++2SO42﹣+3Ba2++2OH﹣═2BaSO4↓+Fe(OH)2↓
10. 常温下,将一定量的铁粉加入到50 mL10mol/L硝酸(①)中,待其充分反应后,收集到的气体换算成标准状况下的体积为4.2L(②),所得溶液能够使淀粉碘化钾溶液变蓝(③),该溶液也能使酸性高锰酸钾褪色(④)。下列说法正确的是( )A、①中数据表明,硝酸是浓硝酸,因此Fe已经钝化 B、②中数据表明,生成的气体中只有NO2 C、③中现象表明,硝酸一定有剩余 D、④中现象表明,溶液中一定含有Fe2+11. 在给定条件下,下列选项所示的物质间转化均能实现的是( )A、Fe FeCl3 Fe(OH)3 B、S SO3 H2SO4 C、NaOH Na2O Na2SiO3 D、NH3 NO HNO312. FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断正确的是( )A、溶液中一定含Cu2+ B、溶液中不一定含Fe2+ C、剩余固体一定含Cu和Fe D、加入KSCN溶液一定不变红色13. 在FeCl2和AlCl3的混合溶液中加入过量的氨水,直至溶液中沉淀的量不再改变为止。经过滤、洗涤、干燥、在空气中灼烧,最终剩余固体的成分是 ( )A、Fe2O3、Al2O3 B、Fe2O3 C、Fe (OH)2、Al(OH)3 D、Fe(OH)3、Al(OH)314. 下列有关铁及其化合物的说法中正确的是( )A、赤铁矿的主要成分是Fe3O4 B、铁与水蒸气在高温下的反应产物为Fe2O3和H2 C、除去FeCl2溶液中的FeCl3杂质可以向溶液中加入铁粉,然后过滤 D、Fe3+与KSCN溶液产生红色沉淀二、实验探究题
-
15. 往氯化亚铁溶液中滴加氢氧化钠溶液,现象是
往氯化铁溶液中滴加氢氧化钠溶液,现象是
往氯化铁溶液中滴加硫氰化钾溶液,现象是
往氯化铝溶液中滴加氢氧化钠溶液至过量,现象是 .
16. 如图,在玻璃管中放入还原铁粉和石棉绒的混合物,加热并通入水蒸气,用试管收集产生的经干燥的水蒸气,并靠近火焰点燃。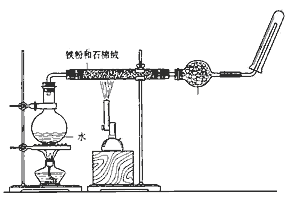 (1)、写出该反应的化学方程式 , 氧化剂是。(2)、加热烧瓶的作用是 , 烧瓶底部放了几片碎瓷片,其作用是。干燥管里可装入的试剂是 , 其作用是。(3)、实验开始时应先点燃(填“酒精灯”或“酒精喷灯”)。17. 根据胶体相关知识填空:(1)、取少量Fe2O3粉末(红棕色)加入适量盐酸,发生反应的化学方程式: .
(1)、写出该反应的化学方程式 , 氧化剂是。(2)、加热烧瓶的作用是 , 烧瓶底部放了几片碎瓷片,其作用是。干燥管里可装入的试剂是 , 其作用是。(3)、实验开始时应先点燃(填“酒精灯”或“酒精喷灯”)。17. 根据胶体相关知识填空:(1)、取少量Fe2O3粉末(红棕色)加入适量盐酸,发生反应的化学方程式: .用此溶液分别做如下实验:取少量溶液置于试管中,滴入几滴NaOH溶液,可观察到有红褐色沉淀生成,反应的化学方程式为 , 此反应属于(填反应类型).
(2)、在小烧杯中加入20mL蒸馏水,加热至沸腾后,向沸水中滴入几滴饱和FeCl3溶液,继续煮沸至溶液呈色,即制得Fe(OH)3胶体.(3)、取另一只小烧杯也加入20mL蒸馏水,向烧杯中加入1mL FeCl3溶液,振荡均匀后,将此烧杯(编号甲)与盛有Fe(OH)3胶体的烧杯(编号乙)一起放置于暗处,分别用激光笔照射烧杯中的液体,可以看到烧杯中的液体产生丁达尔效应.这个实验可以用来区别 .(4)、用Fe(OH)3胶体进行下列实验:向其中滴入过量稀硫酸,现象是 .18. (14分)绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途.某化学兴趣小组对绿矾的一些性质进行探究.回答下列问题:(1)、在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化.再向试管中通入空气,溶液逐渐变红.由此可知:、 .(2)、为测定绿矾中结晶水含量,将石英玻璃管(带端开关K1和K2)(设为装置A)称重,记为m1 g.将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g.按下图连接好装置进行实验.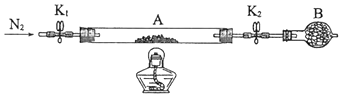
①仪器B的名称是 .
②将下列实验操作步骤正确排序(填标号);重复上述操作步骤,直至A恒重,记为m3 g.
a.点燃酒精灯,加热b.熄灭酒精灯c.关闭K1和K2
d.打开K1和K2 , 缓缓通入N2e.称量Af.冷却至室温
③根据实验记录,计算绿矾化学式中结晶水数目x=(列式表示).若实验时按a、d次序操作,则使x(填“偏大”“偏小”或“无影响”).
(3)、为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2 , 缓缓通入N2 , 加热.实验后反应管中残留固体为红色粉末.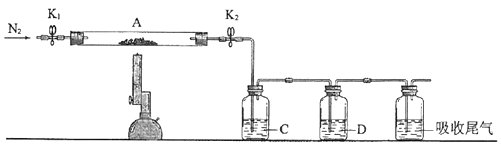
①C、D中的溶液依次为(填标号).C、D中有气泡冒出,并可观察到的现象分别为 .
a.品红b.NaOHc.BaCl2d.Ba(NO3)2e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式 .
三、综合题
-
19. 现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。

请根据以上信息回答下列问题:
(1)、写出下列物质的化学式:A: B: F: 丙:(2)、说出黄绿色气体乙的一种用途:。(3)、若除去F溶液中含有的少量G,需加入 , 实验室检验G中所含的金属离子时,常在G的溶液中加入溶液。(4)、反应①的离子方程式为。(5)、反应⑦涉及的化学方程式有。20. 铁是人类较早使用的金属之一,铁及其化合物之间的相互转化作用可用下式表示:I.回答下列有关问题:
(1)、向沸水中逐滴滴加1mol/LFeCl3溶液,至液体呈透明的红褐色,形成该分散系的微粒大小范围是nm。(2)、电子工业需用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,生成FeCl2和CuCl2 , 制造印刷电路板。写出FeCl3溶液腐蚀铜的化学反应方程式:。检验反应后溶液中还存在Fe3+的试剂是。(3)、在下列化学方程式中:2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O还原剂是.(4)、II.现有五种溶液,分别含下列离子:①Ag+ , ②Mg2+ , ③Fe2+ , ④Al3+ , ⑤Fe3+。写出符合下列条件的离子符号:既能被氧化又能被还原的离子是 , 加铁粉后溶液增重的是 (填写离子符号)
(5)、向Fe2+的溶液中滴加NaOH溶液,现象是 。(6)、欲除去FeCl2中FeCl3选用的试剂是 , 并写出相应离子方程式:。21. 称取4.00 g氧化铜和氧化铁固体混合物,加入50.0 mL 2.00 mol·Lˉ1的硫酸充分溶解,往所得溶液中加入5.60 g铁粉,充分反应后,得固体的质量为3.04 g。请计算:
(1)、加入铁粉充分反应后,溶液中溶质的物质的量。(2)、固体混合物中氧化铜的质量。22. 将铁粉、铜粉、FeCl3溶液和CuCl2溶液混合于某容器中充分反应(假定容器不参与反应).试判断下列情况下,溶液中存在的金属离子和金属单质.(1)、若铁粉有剩余,则容器中不可能有的离子是 , 铜单质(填“一定”或“可能”)存在.(2)、若CuCl2有剩余,则容器中还可能有的离子为 , 铜单质(填“一定”或“可能”)存在.(3)、若FeCl3和CuCl2都有剩余,则容器中不可能有的单质是 , Fe2+(填“一定”或“可能”)存在.