第6讲:镁、铝及其化合物
试卷更新日期:2018-09-30 类型:一轮复习
一、单选题
-
1. 下列物质中,不能与盐酸反应的是( )A、Al B、Al2O3 C、Al(OH)3 D、AlCl32. 下列变化不能通过一步反应直接完成的是( )A、Fe→Fe3+ B、Fe→Fe3O4 C、Al(OH)3→Al2O3 D、Al→Al(OH)33. 属于铝热反应的是( )A、Al+HCl B、Al+H2SO4 C、Al+MgO D、Al+MnO24. 下列物质不能与镁反应的是( )A、Cl2 B、N2 C、CO2 D、Ar5. 铝、氧化铝、氢氧化铝和可溶性铝盐与过量强碱溶液的反应,其生成物有一定的规律,下列说法中正确的是( )A、都有H2O生成 B、都有H2生成 C、都有AlO2-生成 D、都有Al3+生成6. 向m g镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体b L。向反应后的溶液中加入c mol/L氢氧化钾溶液V mL,使金属离子刚好沉淀完全,得到的沉淀质量为n g。再将得到的沉淀灼烧至质量不再改变为止,得到固体p g。则下列关系不正确的是( )A、n=17Vc+m B、5m/3<p<17m/9 C、p=m+cV/125 D、c=1000b/11.2V7. 将等物质的量的镁和铝混合,取等质量该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是( )A、4 mol·L-1 HNO3 B、3 mol·L-1HCl C、8 mol·L-1 NaOH D、18 mol·L-1 H2SO48. 在FeCl2和AlCl3的混合溶液中加入过量的氨水,直至溶液中沉淀的量不再改变为止。经过滤、洗涤、干燥、在空气中灼烧,最终剩余固体的成分是 ( )A、Fe2O3、Al2O3 B、Fe2O3 C、Fe (OH)2、Al(OH)3 D、Fe(OH)3、Al(OH)39. 金属及其化合物的转化关系是化学学习的重要内容之一。下列各组物质的转化关系,不全是可通过一步反应完成的是( )A、Na→NaOH→Na2CO3→NaCl B、Al→Al2O3→Al(OH)3→AlCl3 C、Mg→MgCl2→Mg(OH)2→MgSO4 D、Fe→FeCl2→Fe(OH)2→Fe(OH)310. 在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如右图所示,由此确定,原溶液中含有的阳离子可能是( )
 A、Mg2+、Al3+、Fe3+ B、Na+、Mg2+、Al3+ C、H+、Ba2+、Al3+ D、H+、Mg2+、Al3+11. 向一定质量的稀盐酸中加入镁粉至过量,图中横坐标表示镁粉的质量,则纵坐标表示( )
A、Mg2+、Al3+、Fe3+ B、Na+、Mg2+、Al3+ C、H+、Ba2+、Al3+ D、H+、Mg2+、Al3+11. 向一定质量的稀盐酸中加入镁粉至过量,图中横坐标表示镁粉的质量,则纵坐标表示( ) A、溶液的质量 B、稀盐酸的质量 C、氯化镁的质量 D、生成气体的质量12. 将少量的铝投入过量的氢氧化钠溶液中充分反应,下列有关所得混合溶液的叙述正确的是( )
A、溶液的质量 B、稀盐酸的质量 C、氯化镁的质量 D、生成气体的质量12. 将少量的铝投入过量的氢氧化钠溶液中充分反应,下列有关所得混合溶液的叙述正确的是( )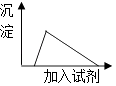 A、该溶液中,Ag+、K+、NH4+、SO42﹣可以大量共存 B、该溶液中,Na+、OH﹣、NO3﹣、CO32﹣不能大量共存 C、向该溶液中逐滴加入AlCl3溶液,生成沉淀与加入AlCl3溶液关系如图 D、向该溶液中逐滴加入稀盐酸,生成沉淀与加入稀盐酸关系如图13. 有五种化合物:①Mg(HSO3)2 , ②Al(OH)3 ③Na[Al(OH)4], ④(NH4)2CO3 , ⑤Al2O3。跟盐酸和NaOH溶液都反应的是( )A、②④ B、①②③ C、①②④⑤ D、③④⑤14. 镁遇到下列物质不放出H2的是:( )
A、该溶液中,Ag+、K+、NH4+、SO42﹣可以大量共存 B、该溶液中,Na+、OH﹣、NO3﹣、CO32﹣不能大量共存 C、向该溶液中逐滴加入AlCl3溶液,生成沉淀与加入AlCl3溶液关系如图 D、向该溶液中逐滴加入稀盐酸,生成沉淀与加入稀盐酸关系如图13. 有五种化合物:①Mg(HSO3)2 , ②Al(OH)3 ③Na[Al(OH)4], ④(NH4)2CO3 , ⑤Al2O3。跟盐酸和NaOH溶液都反应的是( )A、②④ B、①②③ C、①②④⑤ D、③④⑤14. 镁遇到下列物质不放出H2的是:( )①NH4Cl溶液 ②KOH溶液 ③Na2CO3溶液 ④热的乙醇 ⑤苯
⑥醋酸溶液⑦FeCl3 溶液 ⑧CuSO4 溶液 ⑨NaH2PO4 ⑩NaHCO3 溶液.
A、①⑥⑦⑧ B、③④⑤⑨⑩ C、②③⑤⑩ D、③④⑤⑦15. 镁铝性质相似,下表中对两者的对比不正确的是( )选项
反应
铝
镁
A
与非金属
能被Cl2、O2氧化
能与N2、O2反应
B
与水
能与沸水反应
反应很困难
C
与碱
能溶于强碱溶液
不反应
D
与某些氧化物
能与Fe2O3、MnO2、Cr2O3等
金属氧化物发生铝热反应
能在CO2中燃烧
A、A B、B C、C D、D16. 甲、乙两烧杯中各盛有100mL 3 mol/L的盐酸和氢氧化钠溶液,向两烧杯中加入等质量的铝粉,反应结束后生成气体的体积比为甲:乙 = 1:2,则加入铝粉的质量为( )A、5.4g B、3.6g C、2.7g D、1.8g17. 下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解” 现象的是( )①向饱和碳酸钠溶液中通入过量的CO2; ②向 NaAlO2溶液中逐滴加入过量的稀盐酸;
③向AlCl3溶液中逐滴加入过量的稀氢氧化钠溶液; ④向硅酸钠溶液中逐滴加入过量的盐酸
A、①② B、①③ C、①④ D、②③二、填空题
-
18. 有A、B、C、D四种均含有铝元素的化合物,它们之间存在如下的反应关系:
①A+NaOH=D+H2O
②B=A+H2O
③C+NaOH(适量)=B+NaCl
④C+D+H2O=B+NaCl
则A是、C是(填化学式)
19.某铝土矿中主要含有Al2O3、Al(OH)3、AlO(OH),还含有Fe2O3等杂质.利用拜耳法生产氧化铝的流程如图所示:

(1)粉碎后的铝土矿碱浸时应在高温下进行,其目的是 .
(2)AlO(OH)与NaOH反应的化学方程式为 .
(3)在稀释、结晶过程中:稀释的目的是 ;加Al(OH)3晶核的目的是促进Al(OH)3的析出.上述“稀释、结晶”工艺,也可用通入足量的 气体的方法来代替.
(4)浓缩所得的NaOH溶液由于吸收了空气中的CO2而含有杂质,该杂质可通过苛化反应除去,写出苛化反应的化学方程式: .
(5)该生产流程能实现 (填化学式)的循环利用.
20.将一定质量的镁铝合金样品全部溶于100mL某浓度的盐酸中.向所得溶液中滴加5.0mol/L的NaOH溶液,生成沉淀质量与加入的NaOH溶液体积关系如图所示.
(1)19.4g沉淀中含有Al(OH)3的质量为 ;
(2)盐酸的物质的量浓度为 .
 21. A同学学习化学后知道,镁在氧气中燃烧会生成白色的氧化镁固体.但他在空气中点燃镁条时,却发现在生成的白色固体中还夹杂着少量的淡黄色固体.
21. A同学学习化学后知道,镁在氧气中燃烧会生成白色的氧化镁固体.但他在空气中点燃镁条时,却发现在生成的白色固体中还夹杂着少量的淡黄色固体.物 质
MgO
MgCl2
Mg3N2
Mg(NO3)2
MgCO3
Mg(OH)2
颜 色
白色
白色
淡黄色
白色
白色
白色
[提出问题]为什么会生成淡黄色固体?
[查阅资料]该同学查阅资料,记录了右
表中几种物质的颜色:
(1)其他同学认为不必查阅氯化镁的颜色,理由是 ;
(2)[提出猜想]分析资料,A同学认为淡黄色固体可能是由镁与空气中的 反应生成的;
(3)[实验探究]该同学设计实验证实了自己的猜想,他的方案可能是 将点燃的镁条伸人充满氮气的集气瓶中,观察是否生成淡黄色的固体 ;
(4)[实验结论]根据该同学的实验结果,写出镁条在空气中燃烧时发生的两个反应的化学方程式: 、 ;
(5)[反思与评价]通过上述实验,你对燃烧有什么新的认识? .
三、综合题
-
22. 把河沙跟镁粉按一定质量比例混合均匀(15:24),装入试管中加热,大约1min发生剧烈反应,待生成的混合物冷却后放入盛有稀硫酸的烧杯中,即产生气泡,并伴有爆鸣声,产生一种气态氢化物.(1)、写出河沙跟镁粉在加热条件下反应的方程式,并标明是放热还是吸热: , .(2)、写出生成的混合物放入稀硫酸中发生反应的方程式: .(3)、写出产生“爆鸣声”的化学方程式: .23. 某无色工业废水中可能含有Na+、Mg2+、Al3+、Cl-、SO42-中的几种离子。
a.取少许该废水于试管中,加入足量的Ba(NO3)2溶液和稀硝酸,产生白色沉淀,充分反应后过滤,向滤液中加入AgNO3溶液无沉淀产生。
b.另取10mL该废水于试管中,滴加NaOH溶液先产生白色沉淀,后部分沉淀溶解。生成沉淀的物质的量随加入NaOH的物质的量关系如下图所示。
根据上述实验和图中数据:(1)、该废水中一定不含有的离子有(填离子符号);(2)、写出A→B 过程中发生反应的离子方程式:;(3)、该废水中,c(Al3+)=;(4)、①实验室配制100mL2mol/L的NaOH溶液时,用到的玻璃仪器除烧杯、玻璃棒、量筒外,还需要(填仪器名称)。②下列操作使所配溶液浓度偏大的是(填写字母)。
A.称量用了生锈的砝码
B.将NaOH放在纸张上称量
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中
D.往容量瓶转移时,有少量液体贱出
E.未洗涤溶解NaOH的烧杯
F.定容时仰视刻度线
G.容量瓶未干燥即用来配制溶液
24. 根据要求填空:(1)、镁燃烧不能用CO2灭火,用化学方程式表示其理由 .(2)、用H2O2和稀H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜,请写出表示该过程的化学方程式 .(3)、在NaAlO2溶液中通入过量的CO2(用离子方程式表示)(4)、污水及自来水处理的方法有很多.Fe2(SO4)3净水的原理是 .
使用时发现Fe2(SO4)3 并不能使酸性废水中的悬浮物沉降除去,其原因是 .
在酸性环境下,向含重铬酸根的废水中加入FeSO4溶液,然后调节pH,使生成的Cr3+转化为Cr(OH)3 , 写出第一步反应的离子方程式 .
(5)、锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱.但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成Zn(NH3)42+ , 则下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是 .①硫酸铝和氨水 ②偏铝酸钠和稀盐酸 ③硫酸锌和氢氧化钠 ④硫酸锌和氨水.
25. 铝是一种很重要的金属,可以发生一系列反应制备物质.
回答下列问题:
(1)、反应①可以用于(说出一条).(2)、②③反应产生等量氢气消耗的NaOH与H2SO4的物质的量之比为 .(3)、反应④的离子反应的方程式为(4)、用反应⑥制备Al(OH)3 , 最好是向Al2(SO4)3溶液中滴加 , 离子方程式为 .(5)、工业上常用反应⑦制备金属铝,制备过程的方程式是