浙教版科学八年级上册 溶液复习专题
试卷更新日期:2018-09-27 类型:二轮复习
一、单选题
-
1. 如图是恒温下蒸发溶剂过程的示意图,与丙烧杯内溶液的溶质质量分数一定相同的是( )
 A、甲 B、甲和乙 C、乙和丁 D、丁2. 某物质(仅含一种溶质)的溶液在t℃时,恒温蒸发掉10 g水,析出了2g晶体,再恒温蒸发掉10 g水,又析出了3g晶体,则下列说法正确的是( )A、原溶液在t℃时一定是不饱和溶液 B、原溶液一定是稀溶液 C、最后剩余的溶液一定比原溶液稀 D、最后剩余溶液的溶质质量分数比原溶液的溶质质量分数小3. 将相同质量的甲、乙两种不同溶质的溶液同时蒸发掉10g水,并冷却到T℃时,分别析出2g甲和3g乙物质(均不带结晶水),则下列说法正确的是( )A、T℃时,甲、乙两种物质的溶解度可能相同 B、T℃时,甲物质的溶解度一定大于乙 C、T℃时,甲物质的溶解度一定小于乙 D、将析出晶体后的甲、乙两种饱和溶液混合后(甲、乙不反应),溶液仍饱和4. 向两份质量都是100克的某固体物质的水溶液中,分别加入10克该物体后,第一份溶液刚好温度为t℃时的饱和溶液,第二份仍是t℃时的不饱和溶液,则这两份溶液中原来溶质质量分数大的是( )A、第一份溶液 B、第二份溶液 C、两份溶液相同 D、无法比较5. 如图,用下列实验操作可完成两个实验。甲实验为粗盐中难溶性杂质的去除,乙实验为 配制溶质的质量分数为 10%的氯化钠溶液。下列说法中,正确的是( )
A、甲 B、甲和乙 C、乙和丁 D、丁2. 某物质(仅含一种溶质)的溶液在t℃时,恒温蒸发掉10 g水,析出了2g晶体,再恒温蒸发掉10 g水,又析出了3g晶体,则下列说法正确的是( )A、原溶液在t℃时一定是不饱和溶液 B、原溶液一定是稀溶液 C、最后剩余的溶液一定比原溶液稀 D、最后剩余溶液的溶质质量分数比原溶液的溶质质量分数小3. 将相同质量的甲、乙两种不同溶质的溶液同时蒸发掉10g水,并冷却到T℃时,分别析出2g甲和3g乙物质(均不带结晶水),则下列说法正确的是( )A、T℃时,甲、乙两种物质的溶解度可能相同 B、T℃时,甲物质的溶解度一定大于乙 C、T℃时,甲物质的溶解度一定小于乙 D、将析出晶体后的甲、乙两种饱和溶液混合后(甲、乙不反应),溶液仍饱和4. 向两份质量都是100克的某固体物质的水溶液中,分别加入10克该物体后,第一份溶液刚好温度为t℃时的饱和溶液,第二份仍是t℃时的不饱和溶液,则这两份溶液中原来溶质质量分数大的是( )A、第一份溶液 B、第二份溶液 C、两份溶液相同 D、无法比较5. 如图,用下列实验操作可完成两个实验。甲实验为粗盐中难溶性杂质的去除,乙实验为 配制溶质的质量分数为 10%的氯化钠溶液。下列说法中,正确的是( )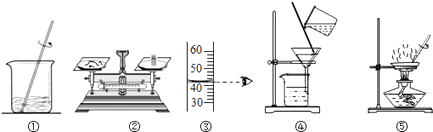 A、甲实验的步骤是①④⑤,其中去除杂质的关键步骤是蒸发 B、甲实验各步操作中,玻璃棒的作用都是相同的 C、乙实验若按照②③①的步骤进行操作,②中称取食盐为 5g,则配制的溶液浓度偏大 D、乙实验中,若①所用的烧杯内壁沾有水,对配制的溶液浓度无影响6. 20℃时,NaCl溶解于水的实验数据如下表。则下列叙述正确的是( )
A、甲实验的步骤是①④⑤,其中去除杂质的关键步骤是蒸发 B、甲实验各步操作中,玻璃棒的作用都是相同的 C、乙实验若按照②③①的步骤进行操作,②中称取食盐为 5g,则配制的溶液浓度偏大 D、乙实验中,若①所用的烧杯内壁沾有水,对配制的溶液浓度无影响6. 20℃时,NaCl溶解于水的实验数据如下表。则下列叙述正确的是( )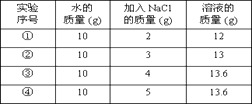 A、②中所得溶液是饱和溶液 B、20℃时10g水最多能溶解4g NaCl C、③④溶液的溶质质量分数相等 D、①所得溶液的溶质质量分数为20%7. 饱和食盐水在室温下放置一段时间,有少量晶体析出。在此变化过程中( )A、溶液的质量会减少 B、食盐的溶解度会减小 C、食盐水的溶质质量分数会减小 D、溶液的体积会增大8. 关于溶液下列说法正确的是( )A、饱和溶液一定是浓溶液 B、t℃时,100克某物质的饱和溶液中含该溶质18克,则该物质在t℃时溶解度是18克 C、饱和溶液指一定温度下一定量溶剂中不能继续溶解某种溶质的溶液 D、不饱和溶液加溶剂可以变为饱和溶液9. 如图为氯化铵和硫酸钠的溶解度曲线,下列说法错误的是( )
A、②中所得溶液是饱和溶液 B、20℃时10g水最多能溶解4g NaCl C、③④溶液的溶质质量分数相等 D、①所得溶液的溶质质量分数为20%7. 饱和食盐水在室温下放置一段时间,有少量晶体析出。在此变化过程中( )A、溶液的质量会减少 B、食盐的溶解度会减小 C、食盐水的溶质质量分数会减小 D、溶液的体积会增大8. 关于溶液下列说法正确的是( )A、饱和溶液一定是浓溶液 B、t℃时,100克某物质的饱和溶液中含该溶质18克,则该物质在t℃时溶解度是18克 C、饱和溶液指一定温度下一定量溶剂中不能继续溶解某种溶质的溶液 D、不饱和溶液加溶剂可以变为饱和溶液9. 如图为氯化铵和硫酸钠的溶解度曲线,下列说法错误的是( )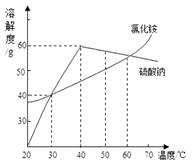 A、30℃时,氯化铵、硫酸钠的溶解度相等 B、氯化铵的溶解度随温度的升高而增大 C、将60℃的硫酸钠饱和溶液降温至40℃,有晶体析出 D、在30℃~70℃范围内,硫酸钠饱和溶液在40℃时溶质的质量分数最大10. 已知30℃时,氯化钠的溶解度为36g.在该温度下,将20g 氯化钠固体加入到30g 水中,充分溶解,形成的溶液中溶质的质量分数为( )A、26.47% B、37.5% C、40% D、50%
A、30℃时,氯化铵、硫酸钠的溶解度相等 B、氯化铵的溶解度随温度的升高而增大 C、将60℃的硫酸钠饱和溶液降温至40℃,有晶体析出 D、在30℃~70℃范围内,硫酸钠饱和溶液在40℃时溶质的质量分数最大10. 已知30℃时,氯化钠的溶解度为36g.在该温度下,将20g 氯化钠固体加入到30g 水中,充分溶解,形成的溶液中溶质的质量分数为( )A、26.47% B、37.5% C、40% D、50%二、填空题
-
11. 根据如表回答相关问题.
温度(℃)
0
20
40
60
80
100
溶解度(g/100g水)
KNO3
13.3
31.6
63.9
110.0
169.0
246.0
NaCl
35.7
36.0
36.6
37.3
38.4
39.8
①表中两种物质的溶解度相等的温度范围是在℃.
②20℃时,硝酸钾的溶解度是31.6g/100g水,其含义是 . 该温度下,将20gKNO3放入50g水中,充分搅拌,所得溶液的质量是 g.要进一步提高该溶液的溶质质量分数,可进行的操作是 .
③硝酸钾溶液中含有少量氯化钠杂质,提纯的方法是 .
④60℃时,对100g硝酸钾饱和溶液(如A烧杯)进行如下操作,请回答相关问题:

上述溶液中所含溶质的质量DE(填“>”或“<”或“=”,下同),溶液不饱和的是(用A,B,C,D,E填空),溶液B,C,E中溶质质量分数的大小关系是 .
12. KCl在不同温度下溶解度的数据如下表:温度℃
0
10
20
30
40
50
60
70
80
90
100
溶解度/g
27.6
31.0
34.0
37.0
40.0
42.6
45.5
48.3
51.1
54.0
56.7
(1)、60℃时,100g水中最多可溶解KClg.(2)、90℃时,100g饱和KCl溶液冷却到30℃时,溶液的质量(选填“>”或“<”或“=”)100g.(3)、40℃时,KCl饱和溶液中溶质质量分数为;该溶液升温到60℃时,溶液属于溶液(选填“饱和”或“不饱和”).13. 下列为氯化钠和氯化铵在不同温度时的溶解度。回答下列问题:温度/℃
0
10
20
30
40
50
氯化铵溶解度/g
29.4
33.3
37.2
41.4
45.8
50.4
氯化钠溶解度/g
35.7
35.8
36.0
36.3
36.6
37.0
(1)、由表中数据可知,溶解度随温度变化较大的物质是。(2)、20 ℃时100 g水最多只能溶解氯化钠g,氯化钠与氯化铵溶解度相等的温度在℃之间。(3)、向烧杯中加入100 g水和50.0 g氯化铵配成50 ℃的溶液,再冷却到20 ℃,烧杯中析出固体为g。14. 甲、乙两图分别表示氯化钠和硝酸钾在水中的溶解度曲线.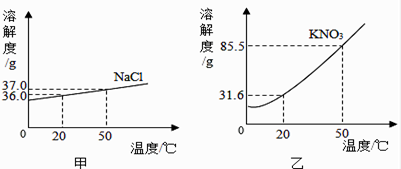 (1)、比较甲、乙两图可知:影响固体物质溶解度曲线陡斜程度的因素是 , 两种物质中 的溶解度受温度影响更小.
(1)、比较甲、乙两图可知:影响固体物质溶解度曲线陡斜程度的因素是 , 两种物质中 的溶解度受温度影响更小.
(2)、20℃时硝酸钾的溶解度为 .
(3)、若将20℃时硝酸钾的饱和溶液升温到50℃,此时溶液为 (填“饱和溶液”或“不饱和溶液”),溶液中硝酸钾的质量分数(填“变大”、“变小”或“不变”).
15. 泡菜具有独特的风味,适合制作泡菜的食盐水浓度是4%,在配制4%的食盐水2000g时,下列做法:①用80g食盐和2000g水配制溶液;②称量食盐时(1克以下用游码),食盐放在右盘的纸上;③量水的体积时,俯视量筒;④溶解食盐的烧杯内壁是潮湿的;其单一错误会导致溶液浓度偏小的是 .
三、解答题
-
16. 某温度时,在 100g 水中最多能溶硝酸钾 25g,现有该温度下 500g 硝酸钾溶液,加热蒸发掉 300g 水以后,冷却到原温度下,发现有 50g 硝酸钾晶体析出,请计算:(1)、蒸发并冷却到原温度后,溶液中有多少克硝酸钾?此时溶液中硝酸钾的质量分数是多少?(2)、蒸发前的溶液中,硝酸钾的质量分数是多少?17. 汽车蓄电池中稀硫酸的溶质质量分数为 28%,密度为 1.2 克/厘米3。若要在实验室用溶质质量分数为 98%的浓硫酸配制这种稀硫酸 630 克。求:(1)、630 克稀硫酸的体积是多少毫升?(2)、需要浓硫酸多少克?18. 常温下将20 g 14%的NaCl溶液和30 g 24%的NaCl溶液混合。计算:(1)、该混合溶液的质量分数;(2)、在1 000 g水中需溶入多少克氯化钠才能使其浓度恰好与上述混合液的浓度相等。19. 预防 H7N9 病毒最有效的预防方法之一就是用消毒液对禽类养殖、销售、宰杀、加工场所进行消毒。二氧化氯消毒液是国际上公认的新一代强力、安全、高效的消毒剂,它能够迅速、彻底杀灭各种细菌和病毒。二氧化氯消毒液瓶上的标签如下表。
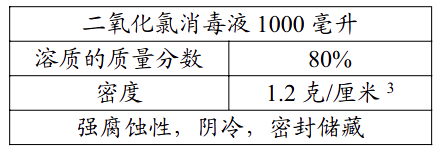 (1)、1000 毫升该二氧化氯消毒液的质量是克;(2)、欲配制 30 千克质量分数为 20%的稀二氧化氯消毒液用来消毒,需要多少千克这种二氧化氯消毒液和多少千克水?(写出计算过程)20. 溶液与人类的生活息息相关,溶液的配制是日常生活和化学实验中的常见操作。(1)、在农业上,常需要用质量分数为16%的氯化钠溶液来选种,现要配制200kg这种溶液,需要氯化钠的质量为多少kg。(2)、化学实验室现有质量分数为98%的浓硫酸,但在实验中常用到较稀的硫酸,要把50g上述浓硫酸稀释为质量分数为20%(密度为1.14g/cm3)的硫酸,稀释后20%硫酸溶液体积为多少mL(计算结果保留至0.1)。
(1)、1000 毫升该二氧化氯消毒液的质量是克;(2)、欲配制 30 千克质量分数为 20%的稀二氧化氯消毒液用来消毒,需要多少千克这种二氧化氯消毒液和多少千克水?(写出计算过程)20. 溶液与人类的生活息息相关,溶液的配制是日常生活和化学实验中的常见操作。(1)、在农业上,常需要用质量分数为16%的氯化钠溶液来选种,现要配制200kg这种溶液,需要氯化钠的质量为多少kg。(2)、化学实验室现有质量分数为98%的浓硫酸,但在实验中常用到较稀的硫酸,要把50g上述浓硫酸稀释为质量分数为20%(密度为1.14g/cm3)的硫酸,稀释后20%硫酸溶液体积为多少mL(计算结果保留至0.1)。