北京市西城区2017-2018学年中考化学二模考试试卷
试卷更新日期:2018-09-26 类型:中考模拟
一、单选题
-
1. 空气成分中,体积分数最大的是( )A、N2 B、O2 C、CO2 D、稀有气体2. 下列图标中,表示“禁止燃放鞭炮”的是( )
A、 B、
B、 C、
C、 D、
D、 3. 铝片能压成铝箔,说明铝具有良好的( )A、导电性 B、导热性 C、延展性 D、抗腐蚀性4. 下列符号能表示两个氧分子的是( )A、2O B、2O2 C、O2 D、2H2O25. CO2 + 2Mg =C + 2MgO,该反应属于( )A、化合反应 B、分解反应 C、复分解反应 D、置换反应6. 下列物质必须密封保存的是( )A、氢氧化钠 B、氯化钠 C、石灰石 D、金刚石7. 下列关于甲醛(CH2O)的说法中,正确的是( )A、甲醛由4个原子构成 B、1个甲醛分子中含有1个水分子 C、甲醛由3种元素组成 D、甲醛中碳、氢元素质量比为1∶28. 下列措施不利于环境保护的是( )A、植树造林 B、垃圾分类处理 C、减少使用一次性塑料袋 D、大量使用化石燃料9. 用图进行实验,下列说法中错误的是( )
3. 铝片能压成铝箔,说明铝具有良好的( )A、导电性 B、导热性 C、延展性 D、抗腐蚀性4. 下列符号能表示两个氧分子的是( )A、2O B、2O2 C、O2 D、2H2O25. CO2 + 2Mg =C + 2MgO,该反应属于( )A、化合反应 B、分解反应 C、复分解反应 D、置换反应6. 下列物质必须密封保存的是( )A、氢氧化钠 B、氯化钠 C、石灰石 D、金刚石7. 下列关于甲醛(CH2O)的说法中,正确的是( )A、甲醛由4个原子构成 B、1个甲醛分子中含有1个水分子 C、甲醛由3种元素组成 D、甲醛中碳、氢元素质量比为1∶28. 下列措施不利于环境保护的是( )A、植树造林 B、垃圾分类处理 C、减少使用一次性塑料袋 D、大量使用化石燃料9. 用图进行实验,下列说法中错误的是( ) A、能证明分子在不断运动 B、浓盐酸与浓氨水都具有挥发性 C、氯化氢分子比氨分子运动得快 D、实验过程中发生了化学变化10. 根据下图所示实验,能达到实验目的的是( )
A、能证明分子在不断运动 B、浓盐酸与浓氨水都具有挥发性 C、氯化氢分子比氨分子运动得快 D、实验过程中发生了化学变化10. 根据下图所示实验,能达到实验目的的是( )A.检验CH4燃烧生成CO2和H2O
B.证明稀盐酸与
NaOH反应
C.测定空气中O2的含量
D.比较呼出气体和空气中CO2的含量



 A、A B、B C、C D、D11. 40 ℃时,向下列4只盛有100 g水的烧杯中,分别加入不同质量的甲、乙固体,充分溶解。
A、A B、B C、C D、D11. 40 ℃时,向下列4只盛有100 g水的烧杯中,分别加入不同质量的甲、乙固体,充分溶解。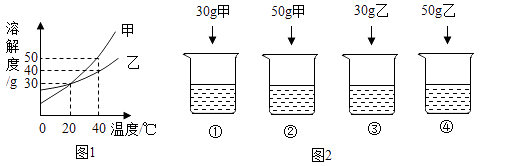
②中溶液的溶质质量分数约为( )
A、30% B、33.3% C、40% D、50 %12. 40 ℃时,向下列4只盛有100 g水的烧杯中,分别加入不同质量的甲、乙固体,充分溶解。
上述溶液为不饱和溶液的是( )
A、①② B、①④ C、②④ D、①③二、填空题
-
13. 请从A或B两题中任选一个作答,若两题均作答,按A计分。
补齐物质与其用途的连线
B 补齐物质与其俗称的连线


三、综合题
-
14. 水是生命之源。
(1)、电解水实验如图所示,试管2中生成的气体是 , 该反应的化学方程式是。 (2)、利用“新能源制氢设备”(如图)电解18 kg水,可得氢气的质量为kg。
(2)、利用“新能源制氢设备”(如图)电解18 kg水,可得氢气的质量为kg。 15. 金属在日常生活中应用广泛。(1)、用锌片和硫酸铜溶液的反应可呈现“铁树开花”的美景(如图)。该反应的化学方程式是。
15. 金属在日常生活中应用广泛。(1)、用锌片和硫酸铜溶液的反应可呈现“铁树开花”的美景(如图)。该反应的化学方程式是。 (2)、铁制品在喷漆前需放入稀盐酸中除锈(铁锈主要成分是Fe2O3)。除铁锈的化学方程式是。16. 光合作用对人类有重要意义。(1)、绿色叶片通过光合作用,可将水和二氧化碳转化为葡萄糖(C6H12O6),并释放出氧气。C6H12O6相对分子质量的计算式为。(2)、科学家利用“人工树叶”模拟植物的光合作用,可获得甲烷和氧气,其反应的微观示意图如下:
(2)、铁制品在喷漆前需放入稀盐酸中除锈(铁锈主要成分是Fe2O3)。除铁锈的化学方程式是。16. 光合作用对人类有重要意义。(1)、绿色叶片通过光合作用,可将水和二氧化碳转化为葡萄糖(C6H12O6),并释放出氧气。C6H12O6相对分子质量的计算式为。(2)、科学家利用“人工树叶”模拟植物的光合作用,可获得甲烷和氧气,其反应的微观示意图如下:
该反应的化学方程式是。
17. 阅读下面科普短文。
纳豆是以黄豆为原料发酵而成的食品。新鲜纳豆表面附有一层白色黏液,黏液中含有丰富的蛋白质和纳豆激酶。食用纳豆可以调节肠道功能、预防骨质疏松、降低胆固醇和血压。其中的纳豆激酶还有很好的溶解血栓的功能。
为研究纳豆固态发酵的最佳条件,实验人员以黄豆为原料,在相同发酵时间下,测定黄豆初始含水量和发酵温度与纳豆激酶含量和黏液产率的关系(如图1、图2)。

另外发酵时间对纳豆激酶含量和黏液产率也有影响。22小时达到最大值,当超过22小时,纳豆激酶含量和黏液产率会因有害产物积累过多而逐渐减少。
食用纳豆的方法很多。可直接将调味料与纳豆混合拌入米饭食用;也可将调味好的纳豆拌入蔬菜中或直接与水果混合食用。
依据文章内容,回答下列问题:
(1)、纳豆中含有的营养素是(答1条即可)。(2)、食用纳豆可以预防骨质疏松,说明纳豆可能含有元素。(3)、依据图2分析,最佳发酵温度是_____(填序号,下同)。A、38 ℃ B、42 ℃ C、46 ℃ D、50 ℃(4)、影响纳豆固态发酵的因素有。(5)、下列说法正确的是_____。A、高血压患者可适当食用纳豆 B、发酵时间越长,纳豆激酶含量越高 C、食用纳豆时配上蔬菜和水果营养更丰富18. 请从A或B两题中任选一个作答,若两题均作答,按A计分。
A
B
⑴实验1中反应的化学方程式是。
⑵实验2中,加热液体时可观察到的现象是。
⑴实验1的现象:剧烈燃烧, , 放热,生成黑色固体。
⑵实验2中,石蕊溶液变红的原因是(用化学方程式表示)。
19. 依据下图所示装置进行实验。 (1)、A中的现象:白色浑浊、。(2)、向B中加入某试剂,出现白色浑浊。产生该现象的化学方程式是。20. 实验室配制100 g 溶质质量分数为6%的氯化钠溶液。实验操作如下:
(1)、A中的现象:白色浑浊、。(2)、向B中加入某试剂,出现白色浑浊。产生该现象的化学方程式是。20. 实验室配制100 g 溶质质量分数为6%的氯化钠溶液。实验操作如下: (1)、正确的实验操作顺序是(填序号)。(2)、操作⑤中量筒的量程是 (填“10 mL”、“50 mL”或“100 mL”)。(3)、若操作①中有部分固体洒落桌面,所得溶液的溶质质量分数会 (填“偏大”、“不变”或“偏小”)。
(1)、正确的实验操作顺序是(填序号)。(2)、操作⑤中量筒的量程是 (填“10 mL”、“50 mL”或“100 mL”)。(3)、若操作①中有部分固体洒落桌面,所得溶液的溶质质量分数会 (填“偏大”、“不变”或“偏小”)。
四、流程题
-
21. KMnO4是锰的重要化合物,工业上常用软锰矿(主要成分为MnO2)制KMnO4。工艺流程如下(设备1~4中都含有水):
资料:K2CO3易溶于水
 (1)、设备1涉及的下列物质中,属于氧化物的是_____(填序号,下同)。A、KOH B、MnO2 C、O2(2)、设备2涉及的物质中,锰元素化合价为+6价的是。(3)、在“进一步处理”过程中,可将K2CO3转化为KOH,应加入的物质是_____。A、CaCO3 B、KCl C、Ca(OH)2(4)、上述流程中可以循环使用的物质有H2O、。
(1)、设备1涉及的下列物质中,属于氧化物的是_____(填序号,下同)。A、KOH B、MnO2 C、O2(2)、设备2涉及的物质中,锰元素化合价为+6价的是。(3)、在“进一步处理”过程中,可将K2CO3转化为KOH,应加入的物质是_____。A、CaCO3 B、KCl C、Ca(OH)2(4)、上述流程中可以循环使用的物质有H2O、。
五、科学探究题
-
22. 用图装置(夹持仪器略去)研究可燃物的燃烧条件。

实验过程:①通入N2 , 将W管右侧部分放入热水中,a、b处白磷均不燃烧;②通入空气,a处白磷不燃烧,b处白磷燃烧。
资料:白磷的着火点为40 ℃,P2O5能与H2O反应
(1)、白磷燃烧的化学方程式是。(2)、实验过程中,能说明可燃物燃烧需要氧气的现象是。
(3)、关于该实验的说法中,正确的是_____(填序号)。A、湿棉花可以吸收白烟 B、烧杯中热水的作用是提供热量 C、②中,a处白磷不燃烧的原因是温度没有达到着火点23. 某实验小组做“滴水生火”实验,向包裹过氧化钠(Na2O2)的棉花上滴水,观察到棉花燃烧。资料:Na2O2与H2O反应生成O2和NaOH
(实验1)验证反应的生成物
步骤
操作
现象
①
取0.5 g Na2O2固体于锥形瓶中,加入50 mL蒸馏水,得溶液A
固体全部消失,产生大量气泡
②
将带火星的木条伸入锥形瓶
_____
③
取5 mL溶液A于试管中,滴加1滴酚酞溶液
溶液变红
(1)、证明②中有O2生成的现象是。(2)、依据③的现象,判断溶液A呈(填“酸性”、“碱性”或“中性”)。(3)、【发现问题】③中溶液变红后,约2分钟褪为无色。【查阅资料】a.Na2O2与H2O反应分为两步:
①Na2O2与H2O反应生成H2O2和NaOH ②H2O2分解
b.通常条件下,NaOH溶液与MnO2不反应
c.H2O2有漂白性,能使变红的酚酞溶液褪色
d.向5 mL 不同浓度的NaOH溶液中滴加1滴酚酞溶液,现象如下表:
NaOH溶液的浓度
30%
10%
1%
现象
变红,15 s后褪色
变红,40 s后褪色
变红,10分钟内
不褪色
【猜想与假设】本实验中,溶液褪色的原因可能是:
a.生成的O2
b.溶液中的H2O2
c.溶液中NaOH的浓度
(实验2)验证猜想
编号
实验
I

II
取10 mL 溶液A于试管中,加入适量MnO2 , 将带火星的木条伸入试管。产生无色气体,带火星的木条复燃
III
i. 取10 mL 溶液A于试管中,……,过滤
ii. 取5 mL滤液于试管中,滴加1滴酚酞溶液。溶液变红,10分钟内不褪色
【实验结论】猜想a不成立,猜想b成立,猜想c不成立
综合以上信息,回答下列问题:
实验I的现象是。
(4)、实验II的目的是。产生无色气体的原因是(用化学方程式表示)。(5)、补全实验i:取10 mL 溶液A于试管中, , 过滤。
-
-