北京市石景山区2017-2018学年中考化学二模考试试卷
试卷更新日期:2018-09-26 类型:中考模拟
一、单选题
-
1. 空气中体积分数约为78%的气体是( )A、氮气 B、氧气 C、二氧化碳 D、稀有气体2. 为了防止骨质疏松,人体需要摄入的元素是( )A、锌 B、钙 C、铁 D、碘3. 下列物质在氧气中燃烧,发出白光、生成使澄清石灰水变浑浊气体的是( )A、木炭 B、镁条 C、红磷 D、铁丝4. 下列物质中,属于氧化物的是( )A、MnO2 B、NaCl C、NaOH D、H2SO45. 下列物质放入水中,能形成溶液的是( )A、碳酸钙 B、面粉 C、食盐 D、植物油6. 下列物质中属于纯净物的是( )A、空气 B、粗盐 C、糖水 D、高锰酸钾7. 下列不是NaOH俗称的是( )A、烧碱 B、火碱 C、纯碱 D、苛性钠8. 玻璃棒是常用的实验仪器。下列实验操作中,不需要使用玻璃棒的是( )A、过滤 B、稀释浓硫酸 C、称量 D、蒸发9. 市场上销售的加碘食盐、含氟牙膏中,碘、氟是指( )A、单质 B、分子 C、元素 D、原子10. 诗词、谚语是中华民族灿烂文化的结晶。下列语句中隐含着物质的变化,其中只隐含物理变化的是( )A、只要功夫深,铁杵磨成针 B、野火烧不尽,春风吹又生 C、春蚕到死丝方尽,蜡炬成灰泪始干 D、爆竹声中一岁除,春风送暖入屠苏11. 加热高锰酸钾制取氧气反应过程中,质量符合下图变化规律的是( )
 A、产生氧气的质量 B、反应前后钾元素的质量 C、高锰酸钾的质量 D、固体中氧元素的质量12. 铼(Re)可用于制造卫星和火箭的外壳。其原子核内有75个质子。铼的制取过程如下:从冶炼辉钼矿的烟道尘中获得Re2O7 , 与KCl反应得到高铼酸钾(KReO4),再与氢气反应制得铼:2KReO4+7H2 =2Re + 2KOH + 6H2O。下列说法错误的是( )A、铼元素属于金属元素 B、一个铼原子中核外电子数为75 C、Re2O7读作七氧化二铼 D、KReO4与氢气制取铼的反应为置换反应
A、产生氧气的质量 B、反应前后钾元素的质量 C、高锰酸钾的质量 D、固体中氧元素的质量12. 铼(Re)可用于制造卫星和火箭的外壳。其原子核内有75个质子。铼的制取过程如下:从冶炼辉钼矿的烟道尘中获得Re2O7 , 与KCl反应得到高铼酸钾(KReO4),再与氢气反应制得铼:2KReO4+7H2 =2Re + 2KOH + 6H2O。下列说法错误的是( )A、铼元素属于金属元素 B、一个铼原子中核外电子数为75 C、Re2O7读作七氧化二铼 D、KReO4与氢气制取铼的反应为置换反应二、填空题
-
13. 下图是我国能源消费结构比例。
 (1)、我国能源消费占比最小的化石燃料的是。(2)、除水力、风能、核能外,人们正在利用和开发的能源还有。14. 生活用品中蕴含着丰富的化学知识。
(1)、我国能源消费占比最小的化石燃料的是。(2)、除水力、风能、核能外,人们正在利用和开发的能源还有。14. 生活用品中蕴含着丰富的化学知识。用品
小苏打
管道通
有效成分
NaHCO3
NaOH
(1)、小苏打能用于治疗胃酸(主要成分为盐酸)过多症。用化学方程式表示其原因。(2)、管道通在使用时禁止与皮肤接触,其原因是。15. 水是一种重要的自然资源,可以制取氢气。下图发生反应的化学方程式为。 16. 5%的葡萄糖溶液可用于医疗救护。现配制500 g质量分数为5%的葡萄糖溶液需要葡萄糖的质量为 g。
16. 5%的葡萄糖溶液可用于医疗救护。现配制500 g质量分数为5%的葡萄糖溶液需要葡萄糖的质量为 g。三、简答题
-
17. 生活中用到的钢铁制品,可通过铁矿石冶炼生产。工业上用一氧化碳和赤铁矿(主要成分为氧化铁)炼铁反应的化学方程式为。18. 阅读下面科普短文。
你吃过木糖醇口香糖吗?
木糖醇为白色固体,极易溶于水,溶解时吸收大量热,甜度与蔗糖相当。
木糖醇广泛存在于各种水果、蔬菜、谷类中,但含量很低。商品木糖醇是将玉米芯、甘蔗渣等农作物进行深加工制得的。我国木糖醇生产工艺路线如下:原料→水解→中和→……. →加氢、结晶→包装。其中原料水解时用硫酸做催化剂,再用碳酸钙将硫酸除去。
龋病是人类常见的一种口腔疾病,其发生过程中不可缺少的微生态环境是牙菌斑。目前普遍认为,牙菌斑中的细菌在代谢食物中糖类的过程中产生酸性物质,酸性物质可导致牙釉质溶解,进而形成龋病。牙菌斑pH 变化可反映牙菌斑内产生酸性物质的情况。
木糖醇不致龋且有防龋齿的作用。第三军医大学韩旭对木糖醇防龋过程进行了研究,部分内容如下。
研究1:用10%的蔗糖、葡萄糖、木糖醇溶液漱口,牙菌斑pH的变化

研究2:用蔗糖溶液涑口后咀嚼口香糖,牙菌斑pH的变化

研究表明,饭后咀嚼木糖醇口香糖可以起到防龋的作用,可以明显降低患龋率。
依据文章内容,回答下列问题。
(1)、木糖醇生产中用碳酸钙将硫酸除去,发生反应的化学方程式为。(2)、龋病的形成是(填“酸性”或“碱性”)物质导致。(3)、根据研究1,木糖醇不致龋的原因是。(4)、根据研究2,可以得出的结论是。(5)、下列有关木糖醇与蔗糖的说法中,正确的是______(填序号)。A、甜度相当 B、均能形成溶液 C、分别食用蔗糖、木糖醇,蔗糖对牙菌斑酸性变化影响小于木糖醇19. 根据下图所示实验,Y烧杯中溶液由红色变为无色。 (1)、该实验可证明分子具有的性质是。(2)、请用化学方程式表示红色变为无色的原因。(3)、该实验得出氢氧化钠的性质有。20. 如图所示,在一去盖塑料瓶上打3个孔,在一根细铁丝上穿2张用紫色石蕊溶液浸泡过的纸条(其中一干、一湿)放入塑料瓶中,在塑料瓶外点燃高低两支蜡烛,火焰分别与高低两个孔持平,通入CO2。
(1)、该实验可证明分子具有的性质是。(2)、请用化学方程式表示红色变为无色的原因。(3)、该实验得出氢氧化钠的性质有。20. 如图所示,在一去盖塑料瓶上打3个孔,在一根细铁丝上穿2张用紫色石蕊溶液浸泡过的纸条(其中一干、一湿)放入塑料瓶中,在塑料瓶外点燃高低两支蜡烛,火焰分别与高低两个孔持平,通入CO2。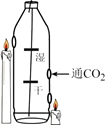 (1)、两张纸条出现的现象是 , 其原因是。(2)、低蜡烛先熄灭,高蜡烛后熄灭,说明二氧化碳具有的性质是。21. 利用下图所示装置进行实验。
(1)、两张纸条出现的现象是 , 其原因是。(2)、低蜡烛先熄灭,高蜡烛后熄灭,说明二氧化碳具有的性质是。21. 利用下图所示装置进行实验。实验装置
实验步骤

Ⅰ. 取适量生石灰于集气瓶中
Ⅱ. 将盛有白磷的燃烧匙伸入瓶中,塞紧瓶塞
Ⅲ. 将注射器中的10 mL水推入瓶内
(1)、生石灰与水发生反应的化学方程式为。(2)、推入水前白磷不燃烧,推入水后一段时间白磷发生燃烧,说明可燃物燃烧的条件之一是。22. 为探究浓度对过氧化氢分解反应速率的影响,同学们设计了如下三个实验:二氧化锰放在气球中,实验时将二氧化锰同时倒入试管中,在反应结束前的某一时间同时观察,现象如图所示。 (1)、过氧化氢与二氧化锰混合时发生反应的化学方程式为。(2)、②中所取过氧化氢溶液体积和二氧化锰质量分别为。(3)、该实验得出的结论是。
(1)、过氧化氢与二氧化锰混合时发生反应的化学方程式为。(2)、②中所取过氧化氢溶液体积和二氧化锰质量分别为。(3)、该实验得出的结论是。四、流程题
-
23. 复印用的墨粉中含有Fe3O4粉末。制备Fe3O4的主要流程如下。
 (1)、①中发生反应的化学方程式为。(2)、试剂X为。(3)、操作Y为。(4)、流程③反应前后,各物质中元素化合价发生改变的是(填元素符号)。
(1)、①中发生反应的化学方程式为。(2)、试剂X为。(3)、操作Y为。(4)、流程③反应前后,各物质中元素化合价发生改变的是(填元素符号)。五、科学探究题
-
24. 实验小组的同学将CO2通入氢氧化钠溶液时,没有观察到明显现象。为了能通过实验现象证明二氧化碳与氢氧化钠确实发生了反应,进行了以下探究。
【提出问题】如何能观察到反应的变化过程?
【查阅资料】
NaOH、Na2CO3在水中的溶解度
温度/℃
0
10
20
30
NaOH
42
51
109
119
Na2CO3
7.1
12.2
21.8
39.7
NaOH、Na2CO3在乙醇中的溶解度
温度/℃
NaOH
Na2CO3
18.5~25
17.3
不溶
【进行实验】注:乙醇在实验中只作为溶剂,不参与化学反应。
实验
实验装置
实验操作
实验现象
1

打开止水夹,通入 CO2 , 气球明显鼓起后关闭止水夹
一段时间后,气球明显变瘪
2

室温下,向10mL澄清饱和的NaOH溶液中通入适量CO2
试管内壁出现白色固体
3

① 室温下,向10mL饱和的NaOH乙醇溶液中缓慢通入适量CO2
甲中出现白色沉淀,乙中无明显现象
② 滴入稀盐酸
甲中有气泡生成,乙中澄清石灰水变浑浊
【解释与结论】
(1)、二氧化碳与氢氧化钠反应的化学方程式为。(2)、实验1中,气球明显变瘪的原因是。(3)、实验2中,试管内壁上出现白色固体的原因是。(4)、实验3甲中出现白色沉淀的原因是。(5)、实验3中操作②的目的是。(6)、【反思与评价】实验1是从(填“反应物消耗”或“新物质生成”)角度证明化学反应发生。
-