浙教版科学2018-2019学年九年级上学期 1.4 氢氧化钠和氢氧化钙(第2课时) 同步练习
试卷更新日期:2018-09-26 类型:同步测试
一、基础题
-
1. 氢氧化钙俗称( )A、烧碱 B、纯碱 C、熟石灰 D、石灰石2. 下列气体中,可用固体NaOH干燥的是( )A、H2 B、CO2 C、SO2 D、HCl3. 下列关于氢氧化钠的描述中错误的是( )A、对皮肤有强烈的腐蚀作用 B、水溶液能使石蕊溶液变红 C、易溶于水,溶于水时放出大量的热 D、能去除油污,可作炉具清洁剂4. 氢氧化钠溶液和氢氧化钙溶液具有相似的化学性质,其本质原因是( )A、都能与指示剂作用 B、都能解离出氢氧根离子 C、都能解离出金属阳离子 D、都含有氢元素和氧元素5. 某同学进行碱的化学性质实验记录的现象中,与事实不相符的是( )A、在Ca(OH)2 溶液中滴加几滴石蕊试液,溶液呈红色 B、在澄清石灰水中加入稀盐酸,无明显变化 C、在NaOH溶液中通入CO2 , 没有白色沉淀生成 D、在NaOH溶液中加入CuSO4溶液,有蓝色沉淀生成6. 将下列各名词填在与之相对应的空格中。(填序号)
①溶解 ②挥发性 ③酸性 ④碱性 ⑤乳化 ⑥潮解
(1)、氢氧化钠固体露置在空气中,表面变潮湿是现象;
(2)、打开装有浓盐酸的试剂瓶瓶塞,瓶口出现白雾,这是浓盐酸的造成的;
(3)、在洗去餐具上的油污时,洗洁精起到了作用。7. 化学反应常伴随能量变化,如图所示,在装有水的烧杯中放入一定质量的生石灰固体,反应片刻后可观察到玻璃管中的有色液体柱将(填“上升”“下降”或“不变”),请写出反应后所得溶液中溶质的化学式。 8. 对知识的归纳和总结是学好科学的重要方法。在学习了碱的性质后,小红同学总结了氢氧化钠的四条化学性质(如图),即氢氧化钠与图中四类物质能够发生化学反应。
8. 对知识的归纳和总结是学好科学的重要方法。在学习了碱的性质后,小红同学总结了氢氧化钠的四条化学性质(如图),即氢氧化钠与图中四类物质能够发生化学反应。 (1)、为了验证氢氧化钠与酸碱指示剂反应,将无色酚酞试液滴入氢氧化钠溶液中,溶液由无色变成色。(2)、利用氢氧化钠与酸反应的性质,可以除去氯化钠溶液中少量的氢氧化钠杂质,请写出该化学反应的方程式。
(1)、为了验证氢氧化钠与酸碱指示剂反应,将无色酚酞试液滴入氢氧化钠溶液中,溶液由无色变成色。(2)、利用氢氧化钠与酸反应的性质,可以除去氯化钠溶液中少量的氢氧化钠杂质,请写出该化学反应的方程式。二、中档题
-
9. 欲除去氢氧化钠溶液中的少量杂质氢氧化钙,可以选用的试剂( )A、氢氧化钾溶液 B、碳酸钠溶液 C、氯化钡溶液 D、稀盐酸10. 下列有关NaOH的实验方案中,正确的是( )A、用熟石灰和纯碱为原料制取NaOH B、用酚酞溶液检验NaOH溶液是否变质 C、用NaOH固体干燥CO2气体 D、用CaCl2溶液除去NaOH溶液中少量的Na2CO311. 一定温度下,一定质量的氢氧化钠固体溶于水制成溶液。下列有关的量不随水的质量改变而改变的是( )A、溶液质量分数 B、溶液的pH C、氢氧化钠的溶解度 D、最多能吸收二氧化碳的质量12. 学习碱的性质时,同学们在实验室中做“检测氢氧化钙性质”的实验,实验方案如图所示(说明:实验中使用的药品均是溶液)。请回答下列问题:
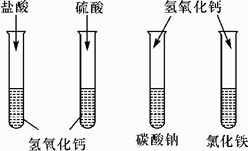 (1)、写出盐酸加入氢氧化钙中反应的化学方程式:;在实验过程中,并没有观察到该反应的明显现象,请你写出一种能够观察到变化发生的方法:。(2)、实验结束后,同学们将四支试管中的物质全部倒入废液缸中。为了处理废液废渣,首先对废液缸中物质的成分进行初步分析,过程如图所示:
(1)、写出盐酸加入氢氧化钙中反应的化学方程式:;在实验过程中,并没有观察到该反应的明显现象,请你写出一种能够观察到变化发生的方法:。(2)、实验结束后,同学们将四支试管中的物质全部倒入废液缸中。为了处理废液废渣,首先对废液缸中物质的成分进行初步分析,过程如图所示: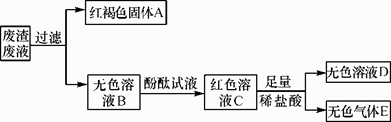
由上述分析可知:
①无色气体E的化学式是
②固体A中一定含有碳酸钙和 。
③无色溶液B中使酚酞试液变红的物质是 。
④无色溶液D中的溶质有酚酞、 ,可能还有HCl。
三、拓展题
-
13. 治污水是“五水共治”内容之一,根据国家标准,废水排放时铅元素的含量不允许超过1.0毫升/升,蓄电池生产企业往往采用化学沉淀法处理Pb2- , 其中以氢氧化物沉淀法应用较多。(1)、根据图表信息,沉淀剂除了NaOH外,还可使用的两种钠盐是。
20 ℃时,各种铅的化合物在水中的溶解度
物质
溶解度/克
物质
溶解度/克
Pb(NO3)2
54.3
PbCO3
7.3×10-3
Pb(OH)2
1.6×10-4
PbS
6.8×10-13
(2)、在弱碱性环境中,氢氧化铅的沉淀更完全,此时废水经沉淀过滤后,检测出铅元素含量仅为0.020 7毫克/升,假设废水中的铅元素全部以Pb(OH)2形式存在,请你通过计算确定,此时1升废水中溶解的Pb(OH)2是多少毫克?
(3)、某蓄电池生产企业购得40%的烧碱溶液100千克,若废水处理时需要溶质质量分数为10%的NaOH溶液,则应对所购烧碱溶液加水千克进行稀释。