安徽省宿州市十三校2017-2018学年高一上学期化学期中考试试卷
试卷更新日期:2018-09-19 类型:期中考试
一、单选题
-
1. 航天探测发现,金星是一个被浓密大气层包围的固体球,大气层的成分之一是三氧化碳(C2O3),实验证明它的化学性质与一氧化碳相似。下列关于三氧化二碳的性质的说法中错误的是( )A、可燃性 B、阻燃性 C、有氧化性 D、有还原性2. 化学与社会生活、科学、技术关系密切,下列表达正确的是( )A、氯气有毒,不能用于饮用水杀菌、消毒 B、家用84消毒液,应该密封避光保存 C、储有钠的仓库着火,立即使用泡沫灭火剂灭火 D、H2+Cl2 2HCl,工业采用该条件生产盐酸3. 2017年诺贝尔化学奖被瑞典、美国和英国三位化学家获得:表彰他们“将低温电子显微镜技术用于溶液中生物分子结构的高分辨率测定”。结合以上信息,下列说法错误的是( )A、化学家已经可以在微观层面上操纵分子、认识分子和制造分子 B、化学与生物学关系密切,化学研究技术促进了生物学发展 C、现在很多新技术已成为化学研究的重要手段 D、化学属于实验科学,分子微观结构的研究不是主流,不需要投入过多精力4. 下列逻辑关系图示中正确的是( )A、
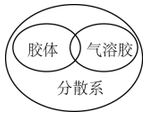 B、
B、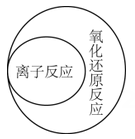 C、
C、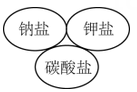 D、
D、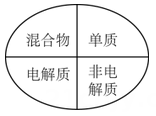 5. 下列有关物质的量的说法中正确的是()A、摩尔是国际七个基本物理量之一 B、阿伏加德罗常数约为6.02×1023 C、标况下的气体摩尔体积为22.4L D、1molH2O的质量为18g6. 下列说法正确的是( )A、NaHSO4能电离出H+ , 但NaHSO4不属于酸,而属于盐 B、盐酸、浓硫酸都属于酸,也都属于化合物 C、Na2O,Na2O2 , CaO都溶于水生成碱,它们都属于碱性氧化物 D、CaCO3、BaSO4等难溶性盐,属于非电解质7. 下列无色溶液中的离子组可以大量共存的是( )A、K+、Na+、CO32-、SO42- B、K+、Cu2+、Cl-、SO42- C、Ba2+、H+、NO3-、SO42- D、H+、Ca2+、ClO-、NO3-8. 下列叙述中正确的是( )A、标准状况下,1LHCl和1LH2O的物质的量相同 B、标准状况下,1gH2和14gN2的体积相同 C、28gCO的体积为22.4L D、两种物质的物质的量相同,则它们在标准状况下的体积也相同9. 用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移溶液、定容等操作。下列图示对应的操作规范的是( )A、
5. 下列有关物质的量的说法中正确的是()A、摩尔是国际七个基本物理量之一 B、阿伏加德罗常数约为6.02×1023 C、标况下的气体摩尔体积为22.4L D、1molH2O的质量为18g6. 下列说法正确的是( )A、NaHSO4能电离出H+ , 但NaHSO4不属于酸,而属于盐 B、盐酸、浓硫酸都属于酸,也都属于化合物 C、Na2O,Na2O2 , CaO都溶于水生成碱,它们都属于碱性氧化物 D、CaCO3、BaSO4等难溶性盐,属于非电解质7. 下列无色溶液中的离子组可以大量共存的是( )A、K+、Na+、CO32-、SO42- B、K+、Cu2+、Cl-、SO42- C、Ba2+、H+、NO3-、SO42- D、H+、Ca2+、ClO-、NO3-8. 下列叙述中正确的是( )A、标准状况下,1LHCl和1LH2O的物质的量相同 B、标准状况下,1gH2和14gN2的体积相同 C、28gCO的体积为22.4L D、两种物质的物质的量相同,则它们在标准状况下的体积也相同9. 用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移溶液、定容等操作。下列图示对应的操作规范的是( )A、 称量
B、
称量
B、 溶解
C、
溶解
C、 转移溶液
D、
转移溶液
D、 定容
10. 下列制备Fe(OH)3胶体及胶体的性质表达正确的是( )A、向沸腾的蒸馏水中滴加1mol/L的FeCl3溶液,边加边搅拌至溶液呈红褐色 B、用1L1mol/L 的FeCl3溶液成功制备了Fe(OH)3胶体,其含胶体微粒数为6.02×1023 C、检验Fe(OH)3胶体制备成功的方法: 用光束通过液体观察有丁达尔效应 D、向Fe(OH)3胶体中滴加盐酸至过量,会产生红褐色沉淀11. 一团棉花包裹少量过氧化钠放在石棉网上,将CO2气体缓缓通入棉花中的过氧化钠上,棉花很快燃烧起来,实验分析可知,下列表达错误的是( )A、反应生成的O2有利于棉花燃烧 B、过氧化钠与CO2反应放热 C、CO2对棉花燃烧起助燃作用 D、过氧化钠与CO2反应属于氧化还原反应12. 下列离子方程式没有错误的是( )A、金属钠加入水中: Na+H2O=Na++OH-+H2↑ B、氢氧化钡溶液中加入稀硫酸: Ba2++OH-+H++SO42-=BaSO4↓+H2O C、过氧化钠与水反应获得碱性溶液: 2O2-+2H2O=4OH-+O2↑ D、实验室用石灰石与盐酸制取CO2:CaCO3+2H+=Ca2++H2O+CO2↑13. 实验室里做钠跟水反应的实验时,用到的仪器和药品是( )
定容
10. 下列制备Fe(OH)3胶体及胶体的性质表达正确的是( )A、向沸腾的蒸馏水中滴加1mol/L的FeCl3溶液,边加边搅拌至溶液呈红褐色 B、用1L1mol/L 的FeCl3溶液成功制备了Fe(OH)3胶体,其含胶体微粒数为6.02×1023 C、检验Fe(OH)3胶体制备成功的方法: 用光束通过液体观察有丁达尔效应 D、向Fe(OH)3胶体中滴加盐酸至过量,会产生红褐色沉淀11. 一团棉花包裹少量过氧化钠放在石棉网上,将CO2气体缓缓通入棉花中的过氧化钠上,棉花很快燃烧起来,实验分析可知,下列表达错误的是( )A、反应生成的O2有利于棉花燃烧 B、过氧化钠与CO2反应放热 C、CO2对棉花燃烧起助燃作用 D、过氧化钠与CO2反应属于氧化还原反应12. 下列离子方程式没有错误的是( )A、金属钠加入水中: Na+H2O=Na++OH-+H2↑ B、氢氧化钡溶液中加入稀硫酸: Ba2++OH-+H++SO42-=BaSO4↓+H2O C、过氧化钠与水反应获得碱性溶液: 2O2-+2H2O=4OH-+O2↑ D、实验室用石灰石与盐酸制取CO2:CaCO3+2H+=Ca2++H2O+CO2↑13. 实验室里做钠跟水反应的实验时,用到的仪器和药品是( )①试管夹 ②镊子 ③小刀 ④滤纸 ⑤研钵 ⑥烧杯 ⑦坩埚 ⑧石棉网 ⑨玻璃片 ⑩药匙
A、①②③④ B、②③④⑥ C、③④⑧⑨⑩ D、②⑤⑦⑨⑩14. 下列物质长期放置在空气中,变质过程中没发生氧化还原反应的是( )A、漂白粉 B、Na2O C、Na D、Na2O215. 点燃黑火药在发生爆炸时发生如下反应2KNO3+3C+S=K2S+N2↑+3CO2↑,下列说法正确的是( )A、KNO3是氧化剂,C和S是还原剂 B、产生22.4L气体,转移电子的物质的量为3mol C、N2和CO2都是氧化产物 D、单质碳发生氧化反应16. 设NA为阿伏加德罗常数值,下列说法正确的是( )A、56g铁粉与标况下22.4L氯气充分反应,转移电子数3NA B、78gNa2O2与水完全反应后转移电子数为2NA C、16.8gFe粉在氧气中完全燃烧转移电子数为0.8NA D、64g铜粉加入到1L lmo/L 的氯化铁溶液充分反应,转移电子数为2NA17. 下列说法正确的是( )A、有单质参加又有单质生成的反应,一定属于氧化还原反应 B、Ag++Cl-=AgCl↓的反应属于化合反应 C、从1L1mol/L的H2SO4溶液中取出10mL该溶液,取出液H+浓度为2mol/L D、一种元素化合价升高时必然有另一种元素化合价降低18. 在甲、乙、丙、丁四个烧杯内分别放入等质量(少量) 的钠、氧化钠、过氧化钠和氢氧化钠,然后各加入100mL 水,使固体完全溶解,则溶液的物质的量浓度最大的烧杯是( )A、甲 B、乙 C、丙 D、丁二、综合题
-
19. 碳、钠、氯、铁等元素形成的单质及化合物在社会生活中应用广泛。请完成下列有关问题:(1)、 工业用氯气与消石灰生产漂白粉,漂白粉的有效成分在水溶液中的电离方程式为 。(2)、氯化亚铁溶液中滴入几滴KSCN 溶液无明显变化,再滴加少最氯水溶液变成红色,写出该变化过程中的化学方程式,开标出电子转移的方向与数目: 。(3)、实现C2O42- →CO2的转化必须加入 (选填: 氧化剂、还原剂、酸)。(4)、一个钠离子的质量为 (保留三位有效数宁)。(5)、 CO、CO2、O3(臭氧)三种气体,含有的氧原子数相等,则三种气体在同温同压下的体积比为 。20. 某工厂用废铜铁合金制取生产油漆的颜料铁红(Fe2O3),并回收铜的流程如下:

完成下列问题:
(1)、上述三个过程中发生了氧化还原反应的是(填符号①②③)。(2)、固体1的名称;红褐色固体的化学式 。(3)、写出整个②过程发生反应的离子方程式: ; ; 。三、实验题
-
21. 某次实验需用480mL、0.5mol/L 的稀硫酸,某同学用98%的浓硫酸(ρ=1.84g/cm3) 进行配制,请回答下列问题:(1)、实验需要的玻璃仪器除了烧杯,胶头滴管、量筒、玻璃棒,还需要;(2)、计算: 需用量筒量取浓硫酸的体积为 mL;(3)、配制过程:
①用量筒量取所需的浓硫酸
②将浓硫酸缓缓注入盛有适量蒸馏水的烧杯中,边加边搅拌,冷却至室温
③用玻璃棒引流将烧杯中的溶液转移到已经检漏的合适规格的容量瓶中
④洗涤烧杯和玻璃棒2~3 次,洗涤液也注入容量瓶中,轻轻摇动容量瓶,使溶液混合均匀
⑤向容量流中加入蒸馏水,在距离刻度1~2cm 时,然后定容
⑥盖好瓶塞,反复上下颠倒,摇匀;
⑦将配制好的溶液转移至试剂瓶中待用。
上述步骤中一定用到胶头滴管的有(填序号);
若步骤⑤定容时加水超过刻度线,应该如何处置:。
(4)、在横线上填写下列各种情况对所配制溶液浓度的影响(选填“偏高”、“偏低”或“无影响”).①所用的浓硫酸长时间放置在密封不好的容器中;
②用量筒量取浓硫酸时仰视液面。
22. 实验室制备氯气的反应原理为MnO+4HCl( 浓) MnCl2+Cl2↑+2H2O,然后用制取的气体进行性质实验。请完成下列问题: (1)、制取氯气的反应中还原剂与氧化剂的物质的量之比为;(2)、氯气不溶于饱和食盐水,装置②的作用:;浓硫酸的作用: ;(3)、④布条上现象: ;⑤布条上现象: ;(4)、NaOH 溶液中发生反应的主要离子方程式为。
(1)、制取氯气的反应中还原剂与氧化剂的物质的量之比为;(2)、氯气不溶于饱和食盐水,装置②的作用:;浓硫酸的作用: ;(3)、④布条上现象: ;⑤布条上现象: ;(4)、NaOH 溶液中发生反应的主要离子方程式为。四、计算题
-
23. 将44.8L(STP)氯化氢气体溶于1027mL的水(密度为1.00g/cm3) 中,所得盐酸的密度为1.1g/cm3 , 请完成下列问题。(写出解题过程)(1)、该盐酸中溶质的物质的量浓度是多少?(2)、取这种盐酸100mL,加入足量的锌充分反应后所得气体体积(STP)为多少?