浙教版科学2018-2019学年九年级上学期 2.2 金属的活动性顺序(第2课时) 同步练习
试卷更新日期:2018-09-18 类型:同步测试
一、基础题
-
1. 下列金属活动性最强的是( )A、Cu B、Zn C、Fe D、Mg2. 某电镀厂的电镀液中含有金盐,为了回收其中的金元素,技术人员制作了如图的“吸金球”。“吸金球”是装入一些“吸金”物质的纱袋。把“吸金球”浸入电镀液,能“吸”出盐溶液中的金。据上所述,“吸金球”中的“吸金”物质可能是( )
 A、活性炭(C) B、磁石(主要成分是Fe3O4) C、铁屑(Fe) D、胆矾(CuSO4·5H2O)3. 下图所示反应,有关说法错误的是( )
A、活性炭(C) B、磁石(主要成分是Fe3O4) C、铁屑(Fe) D、胆矾(CuSO4·5H2O)3. 下图所示反应,有关说法错误的是( ) A、铝丝需要砂纸打磨 B、溶液由蓝色变为无色 C、金属活动性强弱:Al>Cu D、反应的化学方程式为:Al+CuSO4===Cu+AlSO44. 有X、Y、Z三种金属,根据下列有关化学反应方程式可知,三种金属的活动性顺序是( )
A、铝丝需要砂纸打磨 B、溶液由蓝色变为无色 C、金属活动性强弱:Al>Cu D、反应的化学方程式为:Al+CuSO4===Cu+AlSO44. 有X、Y、Z三种金属,根据下列有关化学反应方程式可知,三种金属的活动性顺序是( )①Z+YSO4===Y+ZSO4;②X+YSO4===Y+XSO4;③Z+H2SO4(稀)===ZSO4+H2↑;④X与硫酸不反应
A、Z>X>Y B、X>Z>Y C、Z>Y>X D、Y>X>Z5. 将铜丝插入下列溶液中,有明显现象的( )A、HCl溶液 B、AgNO3溶液 C、MgSO4溶液 D、Ba(OH)2溶液6. 实验室的废酸液不能直接倒入下水道,是因为 , 工厂师傅在切割钢板时,常用硫酸铜溶液画线,所画之处显红色,请猜测其中的化学原理(写出化学方程式),该反应类型属于。
7. 根据金属活动性顺序,回答下列问题:(1)、写出将锌放进硫酸铜与硫酸钠的混合溶液中发生反应的化学方程式:。
(2)、将铁粉和铜粉的混合物放进稀硫酸中,可以除去其中的铁粉,写出该反应的化学方程式:。
(3)、在混有CuCl2的FeCl2溶液中加入足量的铁粉,充分反应后过滤可以得到较为纯净的FeCl2 , 写出该反应的化学方程式:。
二、中档题
-
8. 现有铬、铜和银三种金属,将金属铬和银分别放入硫酸铜溶液中,观察到铬表面有红色物质析出,银表面无明显现象,则这三种金属活动性顺序由强到弱排列的是( )
A、铬>铜>银 B、铜>铬>银 C、铬>银>铜 D、银>铬>铜9. 下列现象和事实,可用金属活动性作出合理解释的是( )①相同几何外形的金属镁、铝分别与相同浓度的稀盐酸反应,镁反应更剧烈,说明镁比铝的金属活动性强 ②用硫酸铜、石灰水配制农药波尔多液时,不能用铁制容器盛放 ③尽管金属的种类很多,但在自然界中,仅有少数金属(银、铂、金)以单质形式存在
④金属铝比金属锌更耐腐蚀,说明锌比铝的金属性强
A、①②③ B、①② C、③④ D、①②③④10. 为了验证“Fe,Cu,Ag三种金属的活动性由强到弱”,小明设计了如图所示的实验,其中可以达到实验目的的组合是( ) A、①② B、①③ C、②④ D、③④11. 在试管中放入一根镁条(已除去氧化膜),往其中加入硝酸银溶液至浸没镁条,现察到如下现象:
A、①② B、①③ C、②④ D、③④11. 在试管中放入一根镁条(已除去氧化膜),往其中加入硝酸银溶液至浸没镁条,现察到如下现象:①镁条表面迅速覆盖一层疏松的固体物质,经检验发现生成的固体物质中有单质银
②镁条表面有明显的气泡现象,经检验发现气泡中有氢气
对于上述实验现象的分析错误的是( )
A、镁能从硝酸银溶液中置换出银 B、镁跟硝酸银溶液反应会生成氢气 C、镁投入硝酸银溶液中只发生2AgNO3+Mg=Mg(NO3)2+2Ag D、根据该实验可判断镁比银化学活动性强12. 往一定量的氯化铜溶液中加入过量的锌粒,如图是反应过程中某物质的质量随加入锌粒的质量变化关系,则这种物质不可能是( ) A、生成的铜 B、溶液中的水 C、生成的氯化锌 D、参加反应的氯化铜13. 下列图像不能正确反映对应变化关系的是( )
A、生成的铜 B、溶液中的水 C、生成的氯化锌 D、参加反应的氯化铜13. 下列图像不能正确反映对应变化关系的是( ) A、向一定量的AgNO3和Zn(NO3)2混合溶液中加入铁粉 B、向等质量的锌粉和铁粉中,分别加入相同质量分数的稀盐酸 C、常温下,向硝酸钾的不饱和溶液中加入硝酸钾晶体 D、向一定量的稀盐酸中加入过量的NaOH溶液14. 运用酸、碱、盐的性质可以解决工业生产中的许多问题。(1)、工业上常选用来除去铁锈(写出一种具体物质)。(2)、某工厂向含有AgNO3、Cu(NO3)2的废水中加入一定量的锌粉(Zn)以回收金属,充分反应后,得到的金属组成可能有哪几种情况?。
A、向一定量的AgNO3和Zn(NO3)2混合溶液中加入铁粉 B、向等质量的锌粉和铁粉中,分别加入相同质量分数的稀盐酸 C、常温下,向硝酸钾的不饱和溶液中加入硝酸钾晶体 D、向一定量的稀盐酸中加入过量的NaOH溶液14. 运用酸、碱、盐的性质可以解决工业生产中的许多问题。(1)、工业上常选用来除去铁锈(写出一种具体物质)。(2)、某工厂向含有AgNO3、Cu(NO3)2的废水中加入一定量的锌粉(Zn)以回收金属,充分反应后,得到的金属组成可能有哪几种情况?。
三、拓展题
-
15. 金属在日常生活中有着广泛的用途,常见金属的活动性顺序如图:

请回答下面问题:
(1)、金属活动性顺序表中的X是元素。
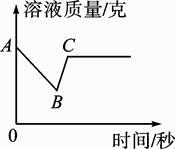
(2)、把一根用砂纸打磨过的铝丝浸入硫酸铜溶液中,过了一会儿,观察到的现象有 , 该反应的化学方程式为。(3)、向一定质量AgNO3和Cu(NO3)2的混合溶液中加入过量的Zn粉,溶液质量随反应时间的变化情况如图所示,图中B点溶液中含有的溶质有。