浙教版科学2018-2019学年九年级上学期 2.2 金属与氧气、酸的反应(第1课时) 同步练习
试卷更新日期:2018-09-18 类型:同步测试
一、基础题
-
1. 收藏家收藏清末铝制品,至今保存十分完好,该艺术品不易锈蚀的主要原因是( )A、铝不易发生化学反应 B、铝的氧化物容易发生化学反应 C、铝不易被氧化 D、铝易被氧化,但氧化铝具有保护内部铝的作用2. 下列金属在一定条件下能与氧气反应,且生成物为黑色固体的一组是( )
①Mg ②Al ③Fe ④Au ⑤Cu
A、①和③ B、只有③ C、③④⑤ D、③和⑤3. 下列金属单质不能与稀盐酸反应放出氢气的是( )A、Cu B、Zn C、Mg D、Fe4. 钛(Ti)是一种广泛应用于航空、航天等领域的重要金属。工业上制钛的化学方程式为:TiCl4+2Mg=Ti+2MgCl2 ,该反应属于( )
A、化合反应 B、分解反应 C、置换反应 D、复分解反应5. 下列关于金属与氧气反应的说法中正确的是( )A、红热的铁丝在空气中能燃烧 B、根据金属与氧气反应的难易程度,可以初步比较一些金属的活动性 C、各种金属在常温下都能与氧气反应 D、在较高温度下能与氧气反应的金属,在常温下也能与氧气反应6. 每到冬天,市场上便有一种“热宝”出售,它是一个装有化学药品的小袋。使用时,撕去它的保护膜贴在身体上,不久便会产生热量。已知小袋中装有铁粉、碳粉和少量氯化钠。
(1)、取小袋内物质,加入稀盐酸中,发生反应的化学方程式为。
(2)、将袋内物质放在足量O2中燃烧,写出反应的化学方程式:①;②。
二、中档题
-
7. 关于下列实验现象,描述错误的是( )A、光亮的铜丝放入稀硫酸中,溶液变为蓝色,产生大量气泡 B、镁条在空气中剧烈燃烧,发出耀眼的白光,生成白色固体 C、铁丝在氧气中剧烈燃烧,火星四射,生成黑色固体 D、氢气在空气中燃烧,产生淡蓝色火焰,放出大量的热8. 将几粒锌粒浸入到稀硫酸中,下列叙述中正确的是( )
①锌粒表面产生气泡 ②不会发生反应
③锌粒的质量减轻 ④液体的质量减轻
A、①③ B、①④ C、② D、①③④9. 下列叙述正确的是( )A、锌、铜等金属能置换出酸中的氢气 B、能生成单质和化合物的反应是置换反应 C、不能用金属铜与稀硫酸反应制取氢气 D、可用盐酸除去铝粉中的锌粉10. 有A、B两种金属放入等质量分数的稀硫酸中,生成氢气的质量与反应时间的关系如图所示,下列结论合理的是( ) A、金属活动性A>B B、生成氢气的质量A>B C、反应的硫酸质量A<B D、反应的金属质量A<B11. 将足量的稀盐酸加入一定量的锌、铜混合物中,写出其中反应的化学方程式。下图是实验过程生成气体或剩余固体的质量随反应时间的变化关系图,其中表示正确的是(填选项)。
A、金属活动性A>B B、生成氢气的质量A>B C、反应的硫酸质量A<B D、反应的金属质量A<B11. 将足量的稀盐酸加入一定量的锌、铜混合物中,写出其中反应的化学方程式。下图是实验过程生成气体或剩余固体的质量随反应时间的变化关系图,其中表示正确的是(填选项)。A.
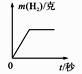 B.
B. 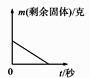 C.
C. 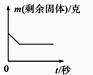
三、拓展题
-
12. 小明把过量锌粒加入有盐酸的试管中,发现随着反应的进行,产生气体的速度逐渐加快,一段时间后逐渐减慢,最后停止产生气体。在反应过程中,溶液的温度也先随之升高,最后下降到室温。于是,小明设计实验来探究“一定质量的某种金属和同体积盐酸反应快慢的影响因素”。测得实验数据如下:
某金属与同体积盐酸溶液反应实验数据表
盐酸溶
液浓度
反应开始时酸
溶液的温度
反应开始到2分钟
产生的气体体积
反应结束共产
生气体体积
5%
20 ℃
10毫升
60毫升
10%
20 ℃
19毫升
118毫升
15%
20 ℃
28毫升
175毫升
5%
35 ℃
28毫升
60毫升
10%
35 ℃
72毫升
118毫升
15%
35 ℃
103毫升
175毫升
(1)、分析实验数据得出:一定质量的某种金属和同体积盐酸反应,影响金属和酸反应快慢的主要因素有。
(2)、可以通过比较的实验数据来确定金属和酸反应的快慢。
(3)、过量锌粒加入盐酸中,反应开始的一段时间,反应速率逐渐加快,而不是逐渐减慢。请分析原因:。
13. 铝箔是现代生活中常见的包装材料,放置久了,其银白色光泽会变暗淡,故又称假银箔。(1)、小柯用放置很久的铝箔与稀盐酸反应,产生氢气质量和反应时间关系如图所示。在0~t1时间段内,铝箔表面看不到明显的气泡,原因是。在t2~t3时间段产生气泡的速度逐渐放缓,直到反应停止时,铝箔还有大量剩余。t2~t3时间段产生气泡速度放缓的原因是。 (2)、为进一步测量铝箔中单质铝的质量分数,小柯取1.9克铝箔样品与50.0克稀盐酸充分反应(2Al+6HCl=2AlCl3+3H2↑),铝箔完全溶解后剩余溶液的总质量为51.7克。计算样品中单质铝的质量分数。
(2)、为进一步测量铝箔中单质铝的质量分数,小柯取1.9克铝箔样品与50.0克稀盐酸充分反应(2Al+6HCl=2AlCl3+3H2↑),铝箔完全溶解后剩余溶液的总质量为51.7克。计算样品中单质铝的质量分数。