天津市武清区2017-2018学年高二上学期化学期中考试试卷
试卷更新日期:2018-09-13 类型:期中考试
一、单选题
-
1. 下列说法正确的是( )A、放热的反应在常温下一定很易发生 B、吸热反应在一定条件下也能发生 C、动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程 D、植物通过光合作用将CO2转化为葡萄糖是太阳能转变成热能的过程2. 下列措施肯定能使反应速率增大的是( )A、适当升高温度 B、增大反应物的量 C、增大压强 D、减小生成物的量3. 下列关于盖斯定律的说法错误的是( )A、不管反应是一步完成还是分几步完成,其反应热相同 B、反应热只与反应体系的始态和终态有关,而与反应的途径无关 C、有些反应的反应热不能直接测得,可通过盖斯定律间接计算得到 D、根据盖斯定律,热化学方程式中△H直接相加即可得总反应热4. 甲、乙两容器都在进行A→B的反应,甲容器内每分钟减少了4molA,乙容器内每分钟减少了2molA,则甲容器内的反应速率比乙容器内的反应速率要( )A、快 B、慢 C、相等 D、无法判断5. 在带有活塞的密闭容器中发生反应:Fe2O3(s)+3H2(g)=2Fe(s)+3H2O(g),采用下列措施不能改变反应速率的是( )A、加热 B、保持容器体积不变,增加通入H2的量 C、充入N2 , 保持容器内压强不变 D、充入N2 , 保持容器内体积不变6. 下列事实中能用平衡移动原理解释的是( )A、使用催化剂可加快氨的合成速率 B、在FeSO4溶液中,加入铁粉以防止氧化 C、由H2蒸气、I2蒸气、HI组成的平衡体系加压后颜色变深 D、硫酸工业生产中,通入过量空气以提高SO2的利用率7. 下列说法中正确的是( )A、增大反应物浓度,能增大活化分子百分数,所以反应速率增大 B、使用正催化剂,能增大活化分子百分数,所以反应速率增大 C、对于任何反应,增大压强都可加快反应速率 D、升高温度,只能增大吸热反应的反应速率8. 下列有关“电离平衡”的叙述正确的是( )A、电解质在溶液里达到电离平衡时,分子的浓度和离子的浓度相等 B、电离平衡时,由于分子和离子的浓度不断发生变化,所以说电离平衡是静态平衡 C、电离平衡是相对的、暂时的,外界条件改变时,平衡就会发生移动 D、电解质达到电离平衡后,各种离子的浓度相等9. pH=2的A、B两种酸溶液各取1mL,分别加水稀释到1000mL,其溶液的pH与溶液体积(V)的关系如图所示,则下列说法错误的是( )
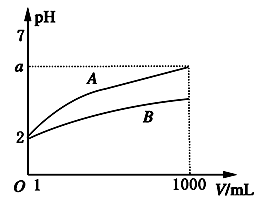 A、稀释后A溶液的酸性比B溶液弱 B、a=5时,A是强酸,B是弱酸 C、若A,B都是弱酸,则5>a>2 D、A,B两种酸溶液物质的量浓度一定相等10. 在下列溶液中,对应组离子一定能够大量共存的是( )A、使酚酞试液变红的溶液:Na+、Cl-、SO42-、Fe3+ B、使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl- C、pH=12的溶液:K+、Ba2+、Cl-、Br- D、碳酸氢钠溶液: K+、SO42-、Cl-、H+11. 根据热化学方程式(在101kPa时):S(s)+O2(g)=SO2(g) △H=-297.23kJ/mol分析下列说法中错误的是( )A、S(g)+O2(g)=SO2(g)放出的热量等于297.23kJ B、S(g)+O2(g)=SO2(g)放出的热量大于297.23kJ C、1molS(s)完全燃烧放热为297.23kJ D、形成1molSO2(g)的化学键释放的总能量大于断裂1molS(s)和1molO2(g)的化学键所吸收的总能量12. 如图表示容积固定的2L密闭容器中进行的某一可逆反应:A(g)+2B(g 2C(g),以B的浓度改变表示的反应速度v正、v逆与时间的关系如图。已知v的单位为mol/(L·s),则图中阴影部分的面积可表示为 ( )
A、稀释后A溶液的酸性比B溶液弱 B、a=5时,A是强酸,B是弱酸 C、若A,B都是弱酸,则5>a>2 D、A,B两种酸溶液物质的量浓度一定相等10. 在下列溶液中,对应组离子一定能够大量共存的是( )A、使酚酞试液变红的溶液:Na+、Cl-、SO42-、Fe3+ B、使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl- C、pH=12的溶液:K+、Ba2+、Cl-、Br- D、碳酸氢钠溶液: K+、SO42-、Cl-、H+11. 根据热化学方程式(在101kPa时):S(s)+O2(g)=SO2(g) △H=-297.23kJ/mol分析下列说法中错误的是( )A、S(g)+O2(g)=SO2(g)放出的热量等于297.23kJ B、S(g)+O2(g)=SO2(g)放出的热量大于297.23kJ C、1molS(s)完全燃烧放热为297.23kJ D、形成1molSO2(g)的化学键释放的总能量大于断裂1molS(s)和1molO2(g)的化学键所吸收的总能量12. 如图表示容积固定的2L密闭容器中进行的某一可逆反应:A(g)+2B(g 2C(g),以B的浓度改变表示的反应速度v正、v逆与时间的关系如图。已知v的单位为mol/(L·s),则图中阴影部分的面积可表示为 ( )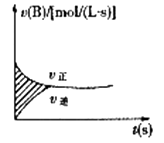 A、A物质的量浓度的减少值 B、B物质的量浓度的减少值 C、C物质的量增加值 D、B物质的量减少值13. 在温度不变的条件下,恒容密闭容器中发生如下反应:2SO2(g)+O2(g) 2SO3(g)下列叙述能够说明反应已达到平衡状态的是( )A、容器中SO2、O2、SO3共存 B、单位时间内生成2molSO2的同时消耗2molSO3 C、容器中SO2、O2、SO3的物质的量之比为1:1:1 D、反应容器中压强不随时间变化14. 已知: 2CO(g)+O2(g)=2CO2(g) △H=-566 kJ/mol
A、A物质的量浓度的减少值 B、B物质的量浓度的减少值 C、C物质的量增加值 D、B物质的量减少值13. 在温度不变的条件下,恒容密闭容器中发生如下反应:2SO2(g)+O2(g) 2SO3(g)下列叙述能够说明反应已达到平衡状态的是( )A、容器中SO2、O2、SO3共存 B、单位时间内生成2molSO2的同时消耗2molSO3 C、容器中SO2、O2、SO3的物质的量之比为1:1:1 D、反应容器中压强不随时间变化14. 已知: 2CO(g)+O2(g)=2CO2(g) △H=-566 kJ/molNa2O2(s)+CO2(g)=Na2CO3(s)+ O2(g) △H=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
A、CO的燃烧热为283kJ B、下图可表示由CO生成CO2的反应过程和能量关系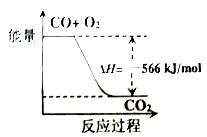 C、2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)放出的热量小于452kJ
D、Na2O2(s)+CO(g)=Na2CO3(s) △H=-1018 kJ/mol
15. 把6molA气体和5molB气体混合放入4L密闭容器中,在一定条件下发生反应:
C、2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)放出的热量小于452kJ
D、Na2O2(s)+CO(g)=Na2CO3(s) △H=-1018 kJ/mol
15. 把6molA气体和5molB气体混合放入4L密闭容器中,在一定条件下发生反应:3A(气)+B(气) 2C(气)+。X D(气)经5min达到平衡,此时生成C为2mol,测定D的平均反应速率为0.1mol/L•min,下列说法中错误的是 ( )
A、x = 2 B、B的转化率为20% C、平衡时A的浓度为0.75mol/L D、恒温达平衡时容器内压强为开始时的85%16. 密闭容器中发生如下反应mA(g)+nB(g) pC(g)+qD(s),达平衡后,温度一定时,将气体体积缩小到原来的 ,当达新平衡时,C的浓度为原来的1.9倍,则下列推断正确的是( )A、平衡向正向移动了 B、达新平衡时,容器内总压一定比原平衡的2倍小 C、达新平衡时,A的浓度小于原平衡A浓度的2倍 D、m+n>p+q17. 在密闭容器中进行下列反应:M(g)+N(g) R(g)+2L,此反应符合下列图像,下列叙述正确的是( )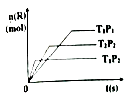 A、正反应放热,L是气体 B、逆反应放热,L是固体 C、正反应吸热,L是气体 D、正反应放热,L是固体或液体18. 在一定条件下有反应:2SO2(g)+O2(g) 2SO3(g) △H=-197kJ/mol.现有容积相同的甲、乙、丙三个定容容器。在上述条件下分别充入的气体和反应放出的热量(Q)如表所示:
A、正反应放热,L是气体 B、逆反应放热,L是固体 C、正反应吸热,L是气体 D、正反应放热,L是固体或液体18. 在一定条件下有反应:2SO2(g)+O2(g) 2SO3(g) △H=-197kJ/mol.现有容积相同的甲、乙、丙三个定容容器。在上述条件下分别充入的气体和反应放出的热量(Q)如表所示:容器
SO2(mol)
O2(mol)
N2(mol)
Q(kJ)
甲
2
1
0
Q1
乙
1
0.5
0
Q2
丙
1
0.5
1
Q3
根据以上数据,下列叙述错误的是:( )
A、Q1<197 B、在上述条件下,反应生成1molSO3气体放热98.5kJ C、Q2=Q3 D、Q3<Q1<2Q219. 根据下列有关图象,说法正确的是( )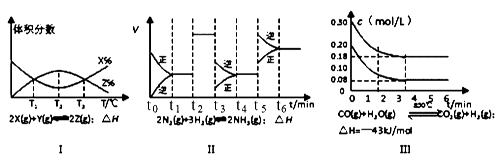 A、由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的△H<0 B、由图Ⅱ知,反应在t6时,NH3体积分数最大 C、由图Ⅱ知,t3时采取的措施是降低反应体系温度 D、Ⅲ在10L容器、850℃时反应,由图知,到4min时,反应放出51.6kJ的热量
A、由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的△H<0 B、由图Ⅱ知,反应在t6时,NH3体积分数最大 C、由图Ⅱ知,t3时采取的措施是降低反应体系温度 D、Ⅲ在10L容器、850℃时反应,由图知,到4min时,反应放出51.6kJ的热量二、综合题
-
20.(1)、I.已知:
①2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
②H2O(l)= H2O(g) △H=+44kJ/mol
③C(s)+ O2(g)=CO(g) △H=-110.5kJ/mol
④C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol
回答下列问题:
①上述变化中吸热的是。
②C的燃烧热△H=。
③燃烧2gH2生成液态水,放出的热量为。
④写出CO燃烧的热化学方程式。
(2)、Ⅱ.在一定条件下,xA+yB zC可逆反应达到平衡,试填出:①若A、B、C都是气体,在减压后平衡向逆反应方向移动,则x、y、z的关系是。
②若C是气体,并且x+y=z,在加压时化学平衡如发生移动必定向。(填正或逆)反应方向移动。
③当改变某种反应条件后,正反应速率增大,而气体A和气体B的浓度均未变,则改变的条件可能是。
21. 把少量的MnO2粉末加入50mL过氧化氢的溶液中,在标准状况下放出气体的体积和时间的关系如图所示。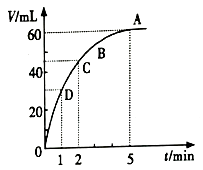
回答下列问题:
(1)、实验时放出气体的总体积为。(2)、放出一半气体所需要的时间为。(3)、反应放出 气体所需要的时间为。(4)、A,B,C,D各点反应速率的快慢顺序为。(5)、反应速率变化的原因。(6)、可以代替MnO2粉末的物质有(答出1种即可) 。22.(1)、I.下列物质中,不属于电解质但能导电的是(填相应序号,下同) , 属于弱电解质的是。①稀硫酸 ②石墨 ③碳酸钙固体 ④氨水 ⑤冰醋酸 ⑥CH3CH2OH ⑦NaHCO3晶体
(2)、Ⅱ.一定温度下有A盐酸、B硫酸、C醋酸三种酸溶液:(当其物质的量浓度相同时,它们的c(H+) 由大到小的顺序为(填A或B或C,下同)。
(3)、同体积、同物质的量浓度的三种酸中和氢氧化钠的能力由大到小的顺序是。(4)、若三种酸的c(H+)相同,物质的量浓度由大到小的顺序为。(5)、若三种酸的c(H+)相同,体积也相同,分别放入足量的Zn,相同状况下产生氢气的体积由大到小关系是。(6)、若三种酸的c(H+)相同,体积也相同,同时加入形状、密度、质量完全相同的锌,开始时反应速率由大到小的关系为 , 若产生相同质量的氢气则反应所需时间长短的关系为。(7)、将c(H+)都相同的三种酸,均加水稀释至原来的100倍后,c(H+)由大到小的顺序为。23. 在一容积为2L的密团容器内加入0.2molN2和0.6molH2 , 在一定条件下发生如下反应: N2(g)+ H2(g) NH3(g)①该反应的平衡常数的表达式是:。
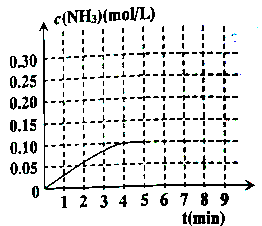
②反应中氨气的浓度的变化情况如图所示,计算从反应开始到平衡时,平均反应速率v(H2)=。
③判断该反应达到平衡状态的标志是。
a.N2和NH3浓度相等
b.NH3百分含量保持不变
c.容器中气体的压强保持不变
d.NH3的生成速率与H2的消耗速率相等
e.容器中混合气体的密度保持不变
④反应达平衡后,第5分钟末,保持其它条件不变,仅改变反应温度,则NH3的物质的量浓度不可能为。
a.0.2mol/L
b.0.12mol/L
c.0.10mol/L
d.0.08mol/L
⑤在第5分钟末,将容器体积缩小一半后,若在第8分钟末达到新平衡(此时NH3浓度约为0.25mol/L),请在上图中画出从第5分钟末开始,再达到新平衡时NH3浓度变化曲线。