天津市红桥区2017-2018学年高二上学期化学期中考试试卷
试卷更新日期:2018-09-13 类型:期中考试
一、单选题
-
1. 下列各项与反应热的大小无关的是( )A、反应物和生成物的状态 B、反应物量的多少 C、反应物的性质 D、反应的快慢2. 下列有关能量转换的说法正确的是( )A、煤燃烧是化学能全部转化为热能的过程 B、化石燃料和植物燃料燃烧时放出的能量均来源于太阳能 C、动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程 D、植物通过光合作用将CO2转化为葡萄糖是太阳能转变成热能的过程3. 在平衡2CrO42-(黄色)+2H+ Cr2O32-(橙红色)+H2O中,溶液介于黄色和橙红色之间,欲使溶液的橙红色加深,则要在溶液中加入( )A、H+ B、OH- C、K+ D、H2O4. 下列热化学方程式中,△H能正确表示物质的燃烧热的是( )A、CO(g)+1/2O2(g)=CO2(g);△H=-283.0kJ/mol B、C(s)+1/2O2(g)=CO(g);△H=-110.5kJ/mol C、H2(g)+1/2O2(g)=H2O(g);△H=-241.8kJ/mol D、2C8H18(l)+25O2(g)=16CO2(g)+18H2O(l);△H=-11036kJ/mol5. 某温度下,在一固定体积的密闭容器中,进行如下化学反应:H2(g)+I2(g) 2HI(g),下列情况能说明该反应一定达到平衡状态的是( )A、混合气体的颜色不再改变 B、混合气体的压强不再改变 C、单位时间内拆开1 mol H—H键,同时生成2 mol H—I键 D、混合气体的密度不再改变6. 下列说法错误的是( )A、增大压强,活化分子百分数不变,化学反应速率增大 B、升高温度,活化分子百分数增大,化学反应速率增大 C、加入反应物,活化分子百分数增大,化学反应速率增大 D、使用催化剂,活化分子百分数增大,化学反应速率增大7. 下列变化过程中,△S<0的是( )A、氯化钠溶于水中 B、NH3(g)与HCl(g)反应生成NH4Cl(s) C、干冰升华 D、CaCO3(s)分解为CaO(s)和CO2(g)8. 下列措施或事实不能用勒夏特列原理解释的是( )A、新制的氯水在光照下颜色变浅 B、H2、I2、HI平衡混合气加压后颜色变深 C、工业上生产硫酸的过程中,使用过量的空气以提高SO2的利用率 D、在合成氨的反应中,加压有利于氨的合成9. 已知反应 2NH3 N2 + 3H2 , 在某温度下的平衡常数为0.25,在此条件下,氨的合成反应1/2 N2 + 3/2 H2 NH3的平衡常数为( )A、4 B、2 C、1 D、0.510. 反应NH4HS(s) NH3(g)+H2S(g)在某一温度下达到平衡,下列各种情况中,能使化学平衡正向移动的是( )A、加入NH4HS固体 B、压强、温度不变,充入少量氩气 C、容积、温度一定,充入氦气 D、温度、容积一定,充入H2S气体11. 在已经处于化学平衡状态的体系中,如果下列量发生变化,其中一定能表明化学平衡移动的是( )A、反应混合物的浓度 B、反应体系的压强 C、正、逆反应的速率 D、反应物的转化率12. 在CH3COOH H++CH3COO-的电离平衡中,要使电离平衡右移且氢离子浓度增大,应采取的措施是( )A、加入NaOH B、加入纯醋酸 C、加水 D、降低温度13. 反应H2(g)+Cl2(g)═2HCl(g) 的发生过程能量变化如下所示:
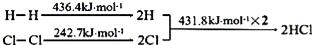
下列说法错误的是( )
A、H﹣H键比Cl﹣Cl键稳定 B、△H=﹣184.5 kJ•mol﹣1 C、正反应活化能比逆反应活化能高 D、在相同条件下,1mol H2(g)和1mol Cl2(g)分别在点燃和光照条件下反应生成2mol HCl(g),重新恢复到原来的状态时△H相同14. 已知热化学方程式:SO2(g)+1/2O2(g) SO3(g) △H=- 98.32kJ/ mol,现有4mol SO2参加反应,当放出314.3 kJ热量时,SO2的转化率最接近于( )A、40% B、50% C、80% D、90%15. 甲、乙、丙三个容器中最初存在的物质及数量如图所示,三个容器最初的容积相等,温度相同,反应中甲、丙的容积不变,乙中的压强不变,在一定温度下反应达到平衡。下列说法正确的是( )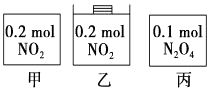 A、平衡时各容器内c(NO2)的大小顺序为乙>甲>丙 B、平衡时N2O4的百分含量:乙>甲=丙 C、平衡时甲中NO2与丙中N2O4的转化率相同 D、平衡时混合物的平均相对分子质量:甲>乙>丙16. 在一定的条件下,将 2mol SO2和1mol O2充入一定容密闭容器中,发生下列反应:2SO2(g)+O2(g) 2SO3(g) △H=-197 kJ/mol, 当达到平衡状态时,下列说法中正确的是( )
A、平衡时各容器内c(NO2)的大小顺序为乙>甲>丙 B、平衡时N2O4的百分含量:乙>甲=丙 C、平衡时甲中NO2与丙中N2O4的转化率相同 D、平衡时混合物的平均相对分子质量:甲>乙>丙16. 在一定的条件下,将 2mol SO2和1mol O2充入一定容密闭容器中,发生下列反应:2SO2(g)+O2(g) 2SO3(g) △H=-197 kJ/mol, 当达到平衡状态时,下列说法中正确的是( )
A、生成 2 mol SO3 B、放出热量197 kJ C、SO2和 SO3共有 2 mol D、含有氧原子共有3mol17. 将浓度为0.1 mol·L-1HF溶液加水不断稀释,下列各量始终保持增大的是( )A、c(H+) B、Ka(HF) C、 D、18. 25 ℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图22所示。下列判断正确的是( )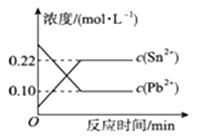 A、往平衡体系中加入金属铅后,c(Pb2+)增大 B、往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小 C、升高温度,平衡体系中c(Pb2+)增大,说明该反应ΔH>0 D、25 ℃时,该反应的平衡常数K=2.2
A、往平衡体系中加入金属铅后,c(Pb2+)增大 B、往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小 C、升高温度,平衡体系中c(Pb2+)增大,说明该反应ΔH>0 D、25 ℃时,该反应的平衡常数K=2.2二、综合题
-
19.(1)、I.联氨(N2H4 , 常温下是无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
①已知12.8 g的液态高能燃料联氨在氧气中燃烧,生成气态N2和液态水,放出248.8kJ的热量。写出表示液态联氨燃烧热的热化学方程式。
②已知①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)=N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2 N2H4(l) + N2O4(l)= 3N2(g)+ 4H2O(g) ΔH4=-1048.9kJ/mol
上述反应热效应之间的关系式为ΔH4= , 联氨和N2O4可作为火箭推进剂的主要原因为。
(2)、Ⅱ.现有反应:mA(g)+nB(g) pC(g).达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:①该反应的逆反应为热反应,且m+np(填“>”“=”“<”)。
②若加入B(体积不变),则A的转化率 , B的转化率(填“增大”“减小”或“不变”)。
③若升高温度,则平衡时B、C的浓度之比 将。
④若加入催化剂,平衡时气体混合物的总物质的量。
三、实验题
-
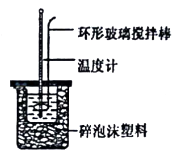
20. I.实验室用50 mL 0.50mol/L盐酸、50mL 0.55 mol/LNaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:
实验次数
起始温度t1/℃
终止温度t2/℃
盐酸
NaOH溶液
1
20.2
20.3
23.7
2
20.3
20.5
23.8
3
21.5
21.6
24.9
完成下列问题:
(1)、不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是。(2)、在操作正确的前提下,提高中和热制定准确性的关键是 .(3)、根据上表中所测数据进行计算,则该实验测得的中和热△H=[盐酸和NaOH溶液的密度按1g/cm3计算,反应后混合溶液的比热容(c)按4.18J/(g.℃)计算].(4)、如用0.5 mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将(填“偏大”、“偏小”、“不变”).如改用60 mL0.5moI/L的盐酸与50 mL 0.55mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等”或“不相等”),所求中和热(填“相等”或“不相等”)。(5)、若某同学利用上述装置做实验,有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是______________。A、测量盐酸的温度后,温度计没有用水冲洗干净 B、把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓 C、做本实验的当天室温较高 D、将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水 E、在量取盐酸时仰视计数 F、大烧杯的盖扳中间小孔太大。(6)、Ⅱ.某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过褪色所需时间来判断反应的快慢。该小组设计了如下方案: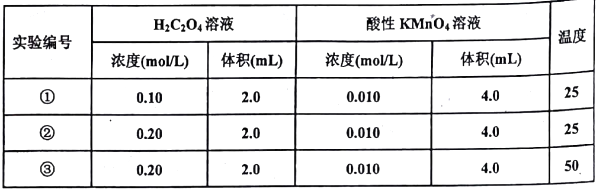
已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4 , 为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4):n(KMnO4) ≥。
(7)、试验编号②和③探究的内容是。(8)、实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时同内平均反应速率v(KMnO4)=mol·L-1·min-1。四、填空题
-
21. 工业合成氨,N2(g)+3H2(g) 2NH3(g)反应过程中的能量变化如图所示,据图回答问题:
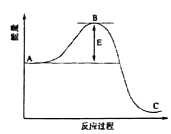 (1)、该反应通常用活性铁作催化剂,加活性铁会使图中B点升高还是降低(填“升高”或“降低”或“不变”)理由是。(2)、该反应在恒温恒容条件下进行,下列选项一定能判断反应达到平衡状态的是________。A、3v (N2)=v(H2) B、单位时间内每消耗a mol N2的同时消耗3a molH2 C、单位时间内每断裂amol氮氮三键的同时生成3a mol氢氢单键 D、c(N2):c(H2):c(NH3)=1:3:2 E、气体总密度不变 F、气体平均摩尔质量不变(3)、该反应平衡常数表达式为:K= , 当浓度商QK(填“<”、 “>”或“=”)时,反应向右进行。(4)、450℃时该反应的平衡常数500℃时的平衡常数(填“<”、 “>”或“=”)。(5)、一定条件下的密闭容器中,该反应达到平衡,要提高H2的转化率,可以采取的合理措施有(填字母代号)。
(1)、该反应通常用活性铁作催化剂,加活性铁会使图中B点升高还是降低(填“升高”或“降低”或“不变”)理由是。(2)、该反应在恒温恒容条件下进行,下列选项一定能判断反应达到平衡状态的是________。A、3v (N2)=v(H2) B、单位时间内每消耗a mol N2的同时消耗3a molH2 C、单位时间内每断裂amol氮氮三键的同时生成3a mol氢氢单键 D、c(N2):c(H2):c(NH3)=1:3:2 E、气体总密度不变 F、气体平均摩尔质量不变(3)、该反应平衡常数表达式为:K= , 当浓度商QK(填“<”、 “>”或“=”)时,反应向右进行。(4)、450℃时该反应的平衡常数500℃时的平衡常数(填“<”、 “>”或“=”)。(5)、一定条件下的密闭容器中,该反应达到平衡,要提高H2的转化率,可以采取的合理措施有(填字母代号)。a.高温高压 b.加入催化剂 c.增加N2的浓度 d.增加H2的浓度 e.分离出NH3
22. 在一容积为2L的密闭容器内加入0.2mol的N2和0.6 mol的H2 . 在一定条件下发生如下反应:N2(g)+3H2(g) 2NH3(g) △H<0反应中NH3的物质的量浓度的变化情况如图所示:
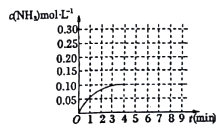 (1)、根据右图,计算从反应开始到平衡时,平均反应速率v(NH3)=mol/(L·min)(2)、反应达到平衡后,第5分钟末,保持其他条件不变,若改变反应温度,则NH3的物质的量浓度不可能为_________(填字母序号)。A、0 20 mol/L B、0.1 mol/L C、0.10 mol/L D、0.08 mol/L(3)、反应达到平衡后,第5分钟末,保持其他条件不变,若只把容器的体积缩小一半,平衡移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数(填“增大”、“减小”或“不变”).(4)、在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(设此时NH3的浓度为0.25mol/L)。请在图中画出第5分钟末到此平衡时NH3浓度的变化曲线。
(1)、根据右图,计算从反应开始到平衡时,平均反应速率v(NH3)=mol/(L·min)(2)、反应达到平衡后,第5分钟末,保持其他条件不变,若改变反应温度,则NH3的物质的量浓度不可能为_________(填字母序号)。A、0 20 mol/L B、0.1 mol/L C、0.10 mol/L D、0.08 mol/L(3)、反应达到平衡后,第5分钟末,保持其他条件不变,若只把容器的体积缩小一半,平衡移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数(填“增大”、“减小”或“不变”).(4)、在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(设此时NH3的浓度为0.25mol/L)。请在图中画出第5分钟末到此平衡时NH3浓度的变化曲线。
-
-