北京四中2017-2018学年高三上学期化学期中考试试卷
试卷更新日期:2018-09-13 类型:期中考试
一、单选题
-
1. 下列材料中不属于有机高分子化合物的是( )
A
B
C
D

宇宙飞船外壳

光导纤维

宇航服

尿不湿
酚醛树脂
二氧化硅
聚酯纤维
聚丙烯酸钠
A、A B、B C、C D、D2. 下列说法中,错误的是( )A、麦芽糖水解的产物只有葡萄糖 B、苯酚可用于合成高分子化合物 C、油脂水解可以制取高级脂肪酸 D、鸡蛋清遇醋酸铅后产生的沉淀能重新溶于水3. 下列物质的用途利用了其还原性的是( )A、用葡萄糖制镜或保温瓶胆 B、用 除去废水中的 C、用 治疗胃酸过多 D、用 制备纳米4. 白屈菜有止痛、止咳等功效,从其中提取的白屈菜酸的结构简式如图。下列有关白屈菜酸的说法中,错误的是( ) A、分子式是 B、能发生加成反应 C、能发生水解反应 D、能发生缩聚反应5. 下列事实、离子方程式及其对应关系均正确的是( )A、铁溶于稀硝酸,溶液变为浅绿色:Fe+4H++NO3-=Fe3++NO↑+2H2O B、向淀粉碘化钾溶液中滴加稀硫酸,在空气中放置一段时间后溶液变蓝:4H++4I-+O2=2I2+2H2O C、向 溶液中滴加少量浓 ,溶液变为黄色:Cr2O72-(橙色)+H2O 2CrO42-(黄色)+2H+ D、向水杨酸(
A、分子式是 B、能发生加成反应 C、能发生水解反应 D、能发生缩聚反应5. 下列事实、离子方程式及其对应关系均正确的是( )A、铁溶于稀硝酸,溶液变为浅绿色:Fe+4H++NO3-=Fe3++NO↑+2H2O B、向淀粉碘化钾溶液中滴加稀硫酸,在空气中放置一段时间后溶液变蓝:4H++4I-+O2=2I2+2H2O C、向 溶液中滴加少量浓 ,溶液变为黄色:Cr2O72-(橙色)+H2O 2CrO42-(黄色)+2H+ D、向水杨酸(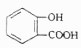 )中滴加 溶液,放出无色气体:
)中滴加 溶液,放出无色气体: 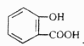 +2HCO3-→
+2HCO3-→  +2CO2↑+2H2O
6. 类比(比较)是研究物质性质的常用方法之一,可预测许多物质的性质,但类比是相对的,不能违背客观实际。下列说法中,错误的是( )A、CO2通入水中生成H2CO3 , SO2通入水中生成H2SO3 B、CO2通入CaCl2溶液中无明显现象,SO2通入CaCl2溶液中也无明显现象 C、足量的CO2通入到澄清石灰水中,先生成沉淀后溶解,足量的SO2通入到澄清石灰水中现象相同 D、CO2通入 溶液中生成 和 ,SO2通入 溶液中生成 和7. 已知下列实验事实:
+2CO2↑+2H2O
6. 类比(比较)是研究物质性质的常用方法之一,可预测许多物质的性质,但类比是相对的,不能违背客观实际。下列说法中,错误的是( )A、CO2通入水中生成H2CO3 , SO2通入水中生成H2SO3 B、CO2通入CaCl2溶液中无明显现象,SO2通入CaCl2溶液中也无明显现象 C、足量的CO2通入到澄清石灰水中,先生成沉淀后溶解,足量的SO2通入到澄清石灰水中现象相同 D、CO2通入 溶液中生成 和 ,SO2通入 溶液中生成 和7. 已知下列实验事实:① 固体既能溶于 溶液得到 溶液,又能溶于硫酸得到 溶液;
②向 溶液中滴加 溶液,再酸化,可得 溶液;
③将 溶液滴加到淀粉和KI的混合溶液中,溶液变蓝。
下列判断错误的是( )
A、化合物 中 元素为+3价 B、实验①证明 是两性氧化物 C、实验②证明 既有氧化性又有还原性 D、实验③证明氧化性:8. 25℃时,浓度均为0.1mol/L的溶液,其pH如下表所示。有关说法正确的是( )序号
①
②
③
④
溶液
pH
7.0
7.0
8.1
8.9
A、酸性强弱: B、离子的总浓度:①>③ C、②中: D、②和④中 相等9. 海洋中的珊瑚虫经如下反应形成石灰石外壳,进而形成珊瑚: 。与珊瑚虫共生的藻类会消耗海洋中的 。气候变暖、温室效应的加剧干扰了珊瑚虫的生长,甚至致其死亡。下列说法不合理的是( ) A、共生藻类消耗 ,有利于珊瑚的形成 B、海洋中 浓度升高,抑制了珊瑚的形成 C、温度升高会增大 在海水中的溶解度,抑制了珊瑚的形成 D、将 转化为甲醇等化工原料,有助于缓解温室效应10. 工业上消除氮氧化物的污染,可用如下反应: , 在温度 和 时,分别将0.50mol 和 充入体积为1L的密闭容器中,测得 随时间变化数据如下表:
A、共生藻类消耗 ,有利于珊瑚的形成 B、海洋中 浓度升高,抑制了珊瑚的形成 C、温度升高会增大 在海水中的溶解度,抑制了珊瑚的形成 D、将 转化为甲醇等化工原料,有助于缓解温室效应10. 工业上消除氮氧化物的污染,可用如下反应: , 在温度 和 时,分别将0.50mol 和 充入体积为1L的密闭容器中,测得 随时间变化数据如下表:温度
时间/min
0
10
20
40
50
0.50
0.35
0.25
0.10
0.10
0.50
0.30
0.18
……
0.15
下列说法错误的是( )
A、10min内, 时 比 时小 B、温度: C、 D、平衡常数:11. 工业上常用氯氧化法处理含氰(CN-)废水,一定条件下,氯气和CN-反应生成无毒气体。下列说法错误的是( )A、CN-中碳元素的化合价为+2 B、该反应的产物之一是无毒的N2 C、当1mol CN-参与反应时,转移3mole- D、处理含0.1mol CN-的废水,理论上需要消耗标准状况下Cl2的体积为5.6L12. 用下列装置(尾气处理已略去)进行相关实验,能实现实验目的的是( )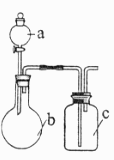
实验目的
a中试剂
b中试剂
c中试剂
A
比较 、 的酸性
醋酸溶液
碳酸钠
硅酸钠溶液
B
比较 、 的氧化性
浓盐酸
高锰酸钾
碘化钾溶液
C
证明苯和液溴发生取代反应
苯和液溴
铁粉
硝酸银溶液
D
证明 有还原性
饱和食盐水
电石
酸性高锰酸钾溶液
A、A B、B C、C D、D13. 利用下图所示装置可以将温室气体 转化为燃料气体CO。下列说法正确的是( ) A、该过程是将太阳能转化为化学能的过程 B、电极a表面发生还原反应 C、该装置工作时, 从b极区向a极区移动 D、该装置中每生成 ,同时生成14. 为监测空气中汞蒸气是否超标,通过悬挂涂有 (白色)的滤纸,根据滤纸是否变色(亮黄色至暗红色)及变色所需时间来判断空气中的汞含量。发生的化学反应为: ,下列说法错误的是( )
A、该过程是将太阳能转化为化学能的过程 B、电极a表面发生还原反应 C、该装置工作时, 从b极区向a极区移动 D、该装置中每生成 ,同时生成14. 为监测空气中汞蒸气是否超标,通过悬挂涂有 (白色)的滤纸,根据滤纸是否变色(亮黄色至暗红色)及变色所需时间来判断空气中的汞含量。发生的化学反应为: ,下列说法错误的是( )
A、上述反应属于置换反应 B、该反应中的氧化剂与还原剂的物质的量之比为2:1 C、 既是氧化产物又是还原产物 D、当有1mol CuI参与反应时,转移电子的物质的量为0.5mol15. 向 浊液中滴加氨水后可得到澄清溶液,继续滴加浓硝酸后又有沉淀生成。经查资料得知: 。下列分析错误的是( )
A、浊液中存在沉淀溶解平衡: B、实验可以证明 结合 能力比 强 C、实验表明实验室可用氨水洗涤银镜反应后的试管 D、由资料信息可推知:加浓硝酸后生成的沉淀为16. 已知反应: 。将一定量的 充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是( )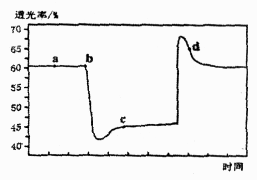 A、b点的操作是压缩注射器 B、c点与a点相比, 增大, 减小 C、平均摩尔质量: D、d点:17. 人体血液里存在重要的酸碱平衡: ,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随 变化关系如下表:
A、b点的操作是压缩注射器 B、c点与a点相比, 增大, 减小 C、平均摩尔质量: D、d点:17. 人体血液里存在重要的酸碱平衡: ,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随 变化关系如下表:1.0
17.8
20.0
22.4
pH
6.10
7.35
7.40
7.45
下列说法错误的是( )
A、正常人体血液中, 的水解程度大于电离程度 B、人体血液酸中毒时,可注射 溶液缓解 C、 的血液中, D、pH=7.40的血液中, 的水解程度一定大于 的电离程度18. 在两份相同的 溶液中,分别滴入物质的量浓度相等的 、 溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析错误的是( )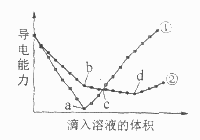 A、①代表滴加 溶液的变化曲线 B、b点,溶液中大量存在的离子是 、 C、a、d两点对应的溶液均显中性 D、c点,两溶液中含有相同量的19. 实验:① 溶液和 溶液各1mL混合得到红色溶液a,均分溶液a置于b、c两支试管中;
A、①代表滴加 溶液的变化曲线 B、b点,溶液中大量存在的离子是 、 C、a、d两点对应的溶液均显中性 D、c点,两溶液中含有相同量的19. 实验:① 溶液和 溶液各1mL混合得到红色溶液a,均分溶液a置于b、c两支试管中;②向b中滴加3滴饱和 溶液,溶液颜色加深;
③再向上述b溶液中滴加3滴 溶液,溶液颜色变浅且出现浑浊;
④向c中逐渐滴加 溶液 ,溶液颜色先变深后变浅。
下列分析错误的是( )
A、实验②中增大 浓度使平衡 正向移动 B、实验③中发生反应: C、实验③和④中溶液颜色变浅的原因相同 D、实验②、③、④均可说明浓度改变对平衡移动的影响20. 欲检验 气体中是否含有 、 ,进行如下实验:①将气体通入酸化的 溶液中,产生白色沉淀a:
②滤去沉淀a,向滤液中加入 溶液,产生白色沉淀b。
下列说法正确的是( )
A、沉淀a为 B、气体中含有 C、沉淀b为 D、气体中没有HCl二、推断题
-
21. 功能高分子P可用作光电材料,其合成路线如下:
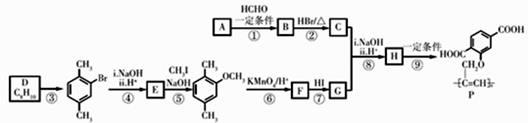
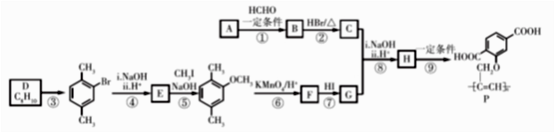
已知:
i: (R,R’表示氢或烃基)
ii.
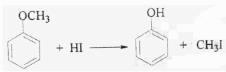
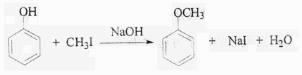
iii.
 (1)、烃A的相对分子质量是26,其结构简式是。(2)、反应①的反应类型是。(3)、C中含有的官能团名称是。(4)、D为苯的同系物,反应③的化学方程式是。(5)、G的结构简式是。(6)、反应⑨的化学方程式是。(7)、反应⑤和⑦的目的是。(8)、以乙炔和甲醛为起始原料,选用必要的无机试剂合成1,3-丁二烯,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
(1)、烃A的相对分子质量是26,其结构简式是。(2)、反应①的反应类型是。(3)、C中含有的官能团名称是。(4)、D为苯的同系物,反应③的化学方程式是。(5)、G的结构简式是。(6)、反应⑨的化学方程式是。(7)、反应⑤和⑦的目的是。(8)、以乙炔和甲醛为起始原料,选用必要的无机试剂合成1,3-丁二烯,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。三、实验题
-
22. 某化学小组在实验室模拟用软锰矿(主要成分 ,杂质为铁及铜的化合物等)制备高纯碳酸锰,过程如下(部分操作和条件略):
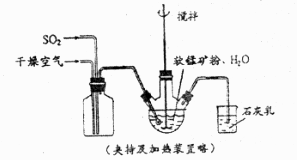
①缓慢向烧瓶中(见上图)通入过量混合气进行“浸锰”操作,主要反应原理为: (铁浸出后,过量的 会将 还原为 )
②向“浸锰”结束后的烧瓶中加入一定量纯 粉末。
③再用 溶液调节pH为3.5左右,过滤。
④调节滤液pH为6.5-7.2,加入 ,有浅红色沉淀生成,过滤、洗涤、干燥,得到高纯碳酸锰。
(1)、“浸锰”反应中往往有副产物 的生成,温度对“浸锰”反应的影响如下图,为减少 的生成,“浸锰”的适宜温度是。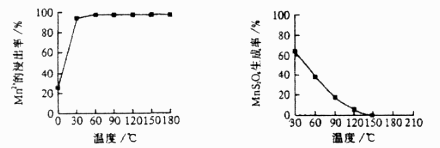
图1 温度对锰浸出率的影响 图2 浸锰温度与 生成率的关系
(2)、查阅表1,③中调pH为3.5时沉淀的主要成分是。②中加入一定量纯 粉末的主要作用是 , 相应反应的离子方程式为。表1:生成相应氢氧化物的pH
物质
开始沉淀pH
2.7
7.6
8.3
4.7
完全沉淀pH
3.7
9.6
9.8
6.7
(3)、③中所得的滤液中含有 ,可添加过量的难溶电解质MnS除去 ,经过滤,得到纯净的 。用平衡移动原理解释加入MnS的作用。(4)、④中加入 后发生反应的离子方程式是。23. 某小组同学利用下图所示装置进行铁的电化学腐蚀原理的探究实验:装置
分别进行的操作
现象

i. 连好装置一段时间后,向烧杯中滴加酚酞
______________
ii. 连好装置一段时间后,向烧杯中滴加 溶液
铁片表面产生蓝色沉淀
(1)、小组同学认为以上两种检验方法,均能证明铁发生了吸氧腐蚀。①实验i中的现象是。
②用化学用语解释实验i中的现象:。
(2)、查阅资料: 具有氧化性。①据此有同学认为仅通过ii中现象不能证明铁发生了电化学腐蚀,理由是。
②进行下列实验,在实验几分钟后的记录如下:
实验
滴管
试管
现象
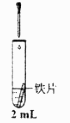
溶液
iii. 蒸馏水
无明显变化
iv. 1.0 溶液
铁片表面产生大量蓝色沉淀
v. 溶液
无明显变化
a. 以上实验表明:在条件下, 溶液可以与铁片发生反应。
b. 为探究 的存在对反应的影响,小组同学将铁片酸洗(用稀硫酸浸泡后洗净)后
再进行实验iii,发现铁片表面产生蓝色沉淀。此补充实验表明 的作用是。
(3)、有同学认为上述实验仍不严谨。为进一步探究 的氧化性对实验ii结果的影响,又利用(2)中装置继续实验。其中能证实以上影响确实存在的是(填字母序号)。实验
试剂
现象
A
酸洗后的铁片、 溶液(已除 )
产生蓝色沉淀
B
酸洗后的铁片、 和 混合溶液(未除 )
产生蓝色沉淀
C
铁片、 和 混合溶液(已除 )
产生蓝色沉淀
D
铁片、 和盐酸混合溶液(已除 )
产生蓝色沉淀
(4)、综合以上实验分析,利用实验ii中试剂,设计能证实铁发生了电化学腐蚀的实验方案。四、填空题
-
24. SCR和NSR技术可有效降低柴油发动机在空气过量条件下的 排放。(1)、SCR(选择性催化还原)工作原理:
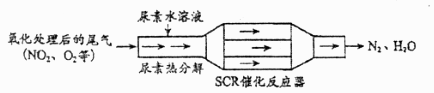
①尿素 水溶液热分解为 和 ,该反应的化学方程式为。
②反应器中 还原 的化学方程式为。
③当燃油中含硫量较高时,尾气中 在 作用下会形成 ,使催化剂中毒。用化学方程式表示 的形成:。
④尿素溶液浓度影响 的转化,测定溶液中尿素( )含量的方法如下:取ag尿素溶液,将所含氮完全转化为 ,所得 用过量的 mL 溶液吸收完全,剩余 用 溶液恰好中和,则尿素溶液中溶质的质量分数是。
(2)、(NSR 储存还原)工作原理:的储存和还原在不同时段交替进行,如图a所示。
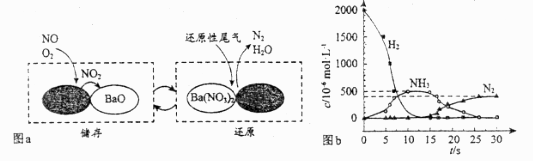
①通过BaO和 的相互转化实现 的储存和还原。储存 的物质是。
②用 模拟尾气中还原性气体研究了 的催化还原过程,该过程分两步进行,图b表示该过程相关物质浓度随时间的变化关系。第一步反应消耗的 与 的物质的量之比是。
③还原过程中,有时会产生笑气( )。用同位素示踪法研究发现笑气的产生与NO有关。在有氧条件下 与 以一定比例反应时,得到的笑气几乎都是 。写出该反应的化学方程式。
25. 亚氯酸钠( )是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产 的主要流程如下: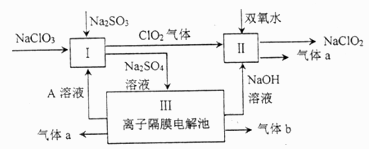 (1)、I中发生反应的还原剂是(填化学式)。(2)、II中反应的离子方程式是。(3)、III中离子隔膜电解池的装置如下:
(1)、I中发生反应的还原剂是(填化学式)。(2)、II中反应的离子方程式是。(3)、III中离子隔膜电解池的装置如下: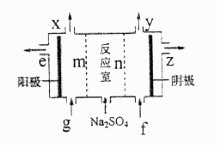
①A的化学式是 , A在口产生。
②m为(填“阴”、“阳”)离子交换膜。
③结合化学用语和文字说明解释 产生的原因:。
(4)、 是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:①该反应中氧化剂和还原剂的物质的量之比是。
②研究表明:若反应开始时盐酸浓度越大,则气体产物中 的含量越大,运用氧化还原反应规律分析其原因是。
(5)、 变质可分解为 和 。取等质量变质前后的 试样均配成溶液,分别与足量 溶液反应时,消耗 的物质的量前者(填>、<、=)后者。
-