第3讲:氧化还原反应
试卷更新日期:2018-09-12 类型:一轮复习
一、单选题
-
1. 下列变化过程中,加入氧化剂才能实现的是( )A、Cl2→Clˉ B、Iˉ→I2 C、SO2→SO32- D、CuO→Cu2. 利用铝热反应原理可以制取锰,化学方程式:3MnO2 +4Al 3Mn +2Al2O3。下列对该反应的叙述错误的是( )A、Al是还原剂 B、MnO2被还原 C、Mn是氧化产物 D、属于氧化还原反应3. 下列实验中的颜色变化,与氧化还原反应无关的是( )
A
B
C
D
实验
NaOH溶液滴入FeSO4溶液中
石蕊溶液滴入氯水中
Na2S溶液滴入AgCl浊液中
热铜丝插入稀硝酸中
现象
产生白色沉淀,随后变为红褐色
溶液变红,随后迅速褪色
沉淀由白色逐渐变为黑色
产生无色气体,随后变为红棕色
A、A B、B C、C D、D4. 洁厕灵和84消毒液混合使用会发生反应: NaClO+2HCl=NaCl+Cl2↑+H2O,生成有毒的氯气。下列说法正确的是( )A、每生成1mol氯气,转移的电子数为2NA B、1 mol NaCl含有的电子数为28NA C、1L0.2mol/ L NaClO溶液中含有的次氯酸根离子数为0.2NA D、标准状况下,将22.4L HCl溶解在0.5L水中,形成2mol/L的盐酸5. 下列变化中,未涉及到电子转移的是( )A、H2C2O4使酸性KMnO4溶液褪色 B、C2H5OH使酸性K2Cr2O7溶液变绿 C、CO2使苯酚钠溶液变浑浊 D、H2O2使酸化的KI溶液变黄6. 一定量的H2和Cl2充分燃烧后,将反应生成的气体通入100mL1.0mol/L的NaOH溶液中,两者恰好完全反应,生成NaClO为0.01mol。则燃烧前H2和Cl2的物质的量之比为( )A、5:4 B、4:5 C、4:3 D、3:47. 三效催化剂是最为常见的汽车尾气催化剂,其催化剂表面物质转化的关系如图所示,下列说法正确的是( ) A、在转化过程中,氮元素均被还原 B、依据图示判断催化剂不参与储存和还原过程 C、还原过程中生成0.1mol N2 , 转移电子数为0.5 mol D、三效催化剂能有效实现汽车尾气中CO、CxHy、NOx三种成分的净化8. 将过量H2O2溶液加入含(NH4)2CrO4 的氨水中,加热后冷却,生成暗棕红色晶体M[化学式为Cr(NH3)3O4],其离子方程式为:CrO42-+3NH3+3H2O2=M+2H2O+2OH-+O2↑,测得M中有2个过氧键。下列叙述正确的是( )A、M中Cr的化合价为+3 B、参与反应的H2O2全部被氧化 C、向FeSO4溶液中滴加几滴M的溶液,没有明显现象 D、转移0.2mol电子时,生成M的质量为16.7g9. ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2: ,下列说法中正确的是( )A、在反应中H2C2O4既不是氧化剂也不是还原剂 B、1 mol KClO3参加反应,在标准状况下能得到22.4 L气体 C、1 mol KClO3参加反应有2 mol电子转移 D、KClO3在反应中是氧化剂10. 在反应3Cl2+6KOH(浓) KClO3+5KCl+3H2O中,氧化剂与还原剂物质的量之比为( )A、5:1 B、4:1 C、1:5 D、1:411. 下列各组物质中,物质之间通过一步反应就能实现图示变化的是 ( )
A、在转化过程中,氮元素均被还原 B、依据图示判断催化剂不参与储存和还原过程 C、还原过程中生成0.1mol N2 , 转移电子数为0.5 mol D、三效催化剂能有效实现汽车尾气中CO、CxHy、NOx三种成分的净化8. 将过量H2O2溶液加入含(NH4)2CrO4 的氨水中,加热后冷却,生成暗棕红色晶体M[化学式为Cr(NH3)3O4],其离子方程式为:CrO42-+3NH3+3H2O2=M+2H2O+2OH-+O2↑,测得M中有2个过氧键。下列叙述正确的是( )A、M中Cr的化合价为+3 B、参与反应的H2O2全部被氧化 C、向FeSO4溶液中滴加几滴M的溶液,没有明显现象 D、转移0.2mol电子时,生成M的质量为16.7g9. ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2: ,下列说法中正确的是( )A、在反应中H2C2O4既不是氧化剂也不是还原剂 B、1 mol KClO3参加反应,在标准状况下能得到22.4 L气体 C、1 mol KClO3参加反应有2 mol电子转移 D、KClO3在反应中是氧化剂10. 在反应3Cl2+6KOH(浓) KClO3+5KCl+3H2O中,氧化剂与还原剂物质的量之比为( )A、5:1 B、4:1 C、1:5 D、1:411. 下列各组物质中,物质之间通过一步反应就能实现图示变化的是 ( )物质编号
物质转化关系
a
b
c
d
①

NO
NO2
N2
HNO3
②
Na2O
Na2O2
Na
NaOH
③
FeCl2
FeCl3
Fe
CuCl2
④
Al2O3
NaAlO2
Al
Al(OH)3
A、①②③ B、③④ C、①③④ D、②④12. 几种物质在酸性溶液中的还原性强弱顺序如下:SO2>I->Fe2+>H2O2。据此判断下列反应不能发生的是( )A、2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ B、H2O2+H2SO4=SO2↑+O2↑+2H2O C、SO2+I2+2H2O=H2SO4+2HI D、2Fe3++2I-=2Fe2++I213. 氧化还原反应与四种基本反应类型的关系如下图所示,则下列化学反应属于Ⅲ区域的是( ) A、Cl2+2KBr=Br2+2KCl B、2NaHCO3 Na2CO3+H2O+CO2↑ C、2Na2O2+2CO2=2Na2CO3+O2 D、4Fe(OH)2+O2+2H2O=4Fe(OH)314. 已知有如下反应:
A、Cl2+2KBr=Br2+2KCl B、2NaHCO3 Na2CO3+H2O+CO2↑ C、2Na2O2+2CO2=2Na2CO3+O2 D、4Fe(OH)2+O2+2H2O=4Fe(OH)314. 已知有如下反应:①ClO3-+5Cl-+6H+=3Cl2↑+3H2O,②2FeCl3+2KI=2FeCl2+2KCl+I2 ,
③2FeCl2+Cl2=2FeCl3 , 判断下列各微粒氧化能力由强到弱的顺序正确的是( )
A、Cl2>ClO3->Fe3+>I2 B、Cl2>ClO3-> I2> Fe3+ C、ClO3-> Cl2>Fe3+>I2 D、ClO3->Fe3+Cl2>I215. 常温下在溶液中可发生以下反应: ①2Fe2++ Br2=2Fe3+ + 2Br− ②2Br−+ Cl2=Br2 + 2Cl− ③2Fe3+ + 2I−= 2Fe2++ I2。下列说法正确的是( )A、铁元素在反应①中被还原,在③中被氧化 B、反应②中当有1 mol Cl2被氧化时,有2 mol 电子转移 C、氧化性强弱顺序为:Cl2 > I2 > Br2 > Fe3+ D、还原性强弱顺序为:I− > Fe2+ > Br− > Cl−二、填空题
-
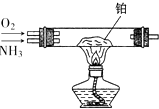
16. 用图所示装置,加热铂丝一段时间后,通入NH3和O2 , 写出该装置硬质玻璃管中发生氨的催化氧化反应的化学方程式 , 并且要求用双线桥标明电子转移的方向与数目:
.
 17. 在Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O反应中
17. 在Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O反应中① 元素被氧化, 是氧化剂.
②用双线桥标出该反应电子转移的方向和数目 .
Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
③若有2.4mol的H2SO4参与反应,则被还原的H2SO4为 g,生成标况下的二氧化硫气体 L.
18. 高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂作剂,它的氧化性比高锰酸钾更强,本身在反应中被还原为Fe2+离子.配平制取铁酸钠的化学方程式:Fe(NO3)3+NaOH+Cl2═Na2FeO4+NaCl+6NaNO3+8H2O.反应中,元素被氧化,每生成8mol H2O转移电子总数为 .
19. 现有浓度各为1mol•L﹣1的FeCl3、FeCl2、CuCl2混合溶液100mL,加入一定量的铁粉,对下列各情况填空(已知:氧化性Fe3+>Cu2+>Fe2+).(1)反应完毕,铁粉有剩余.反应后的溶液中一定含 阳离子.
(2)反应完毕,有铜生成,铁粉无剩余.反应后的溶液中一定含 阳离子,该阳离子在溶液中物质的量的范围是 ;反应后的溶液中可能含 阳离子.
(3)反应完毕后,无固体沉积物存在,反应后的溶液中一定含 和 阳离子.
三、综合题
-
20. 铜是人类发现最早并广泛使用的一种金属。回答下列问题:(1)、实验室使用稀硫酸和H2O2溶解铜片,该反应的化学方程式为。(2)、电子工业使用FeCl3溶液刻蚀印刷电路板铜箔,写出该过程的离子方程式。配制的FeCl3溶液应保持 (填“酸性”“碱性”或“中性”),原因是。
(3)、溶液中Cu2+的浓度可采用碘量法测得:①2Cu2++5I-=2CuI↓+I3―; ②I3― + 2S2O32-=S4O62-+ 3I-
反应①中的氧化剂为。现取20.00 mL含Cu2+的溶液,加入足量的KI充分反应后,用0.1000mol·L-1的Na2S2O3标准溶液滴定至终点,消耗Na2S2O3溶液25.00 mL,此溶液中Cu2+的浓度为mol·L-1。