2018-2019学年人教版(五·四学制)化学九年级全一册第一单元课题2 金属的化学性质 同步训练
试卷更新日期:2018-08-31 类型:同步测试
一、单选题
-
1. 2017年春季,在张献忠沉银现场,考古安家发现了金币、银币、铜币和银锭,还有铁刀、铁矛等兵器,金币银币光亮如初,铁刀铁矛锈迹斑斑。下列说法错误的是( )A、 金银铜铁都是重要的金属资源 B、金银的化学性质比铜铁更稳定 C、自然界中,金、银、铜、铁主要以単质的形式存在 D、可以用银、铁、硫酸铜溶液验证银、铁、铜三种金属的活动性顺序2. 化学趣味小组在学习了金属的化学性质后,对金属R的活动性进行探究发现:将金属R放入稀盐酸中,观察到有气泡产生(该反应的化学方程式可表示为:R+2HCl2=RCl2+H2↑),将R放入ZnSO4溶液中无任何变化。下列化学方程式书写错误的是( )A、R+MgSO4=RSO4+Mg B、R+CuSO4=RSO4+Cu C、R+H2SO4=RSO4+H2↑ D、2Al+3RSO4=Al2(SO4)3+3R3. 分析推理是学习化学的重要方法之一,下列推理错误的是( )A、水通电生成氢气和氧气,则水由氢、氧两种元素组成 B、铝的金属活动性比铁强,则铝制品比铁制品更易腐蚀 C、金刚石和石墨的原子排列方式不同,则它们的物理性质不同 D、化合物是由不同种元素组成的纯净物,则由不同种元素组成的纯净物一定是化合物4. 下列叙述正确的是( )A、酸跟活泼金属反应一定生成盐和氢气 B、金属活动顺序中,排在前面的金属一定能置换后面的金属 C、单质和化合物的反应一定是置换反应 D、置换反应不一定要在溶液中进行5. 向一定量的硝酸铜、硝酸银的混合溶液中加入5.6 g铁粉,充分反应后过滤、洗涤、干燥,称得固体14 g。向固体中加入稀盐酸,无气泡产生,则下列分析正确的是( )A、滤液中一定不含有硝酸银 B、滤液中一定含有硝酸铜 C、滤出的固体中含有银7.6g D、滤出的固体中含有铜6.4g6. 利用盐酸和硝酸银探究铁、铜、银的金属活动顺序,下列实验可以不需要进行的是( )A、铁+稀盐酸 B、铜+稀盐酸 C、银+稀盐酸 D、铜+硝酸银溶液7. 有X,Y,Z三种金属片,分别放入稀硫酸中,X,Z表面有气泡产生,Y没有明显现象X放入ZCln溶液,没有明显现象。判断这三种金属的活动性由强到弱的顺序是( )
A、X>Y>Z B、Z>X>Y C、X>Z>Y D、Y>X>Z8. 某兴趣小组进行实验探究,向盛有硝酸亚铁和硝酸银混合液的烧杯中加入一定量的锌粉,反应停止后过滤,向滤渣中加入稀盐酸,有气泡产生下列说法正确的是( )A、滤液中一定含有Zn2+和Fe2+ , 一定没有Ag+ B、滤液中一定含有Zn2+ , 一定没有Fe2+和Ag+ C、滤渣中一定含有银,可能含有锌和铁 D、滤渣中一定含有银和铁,可能含有锌9. 把等质量的X、Y、Z、M四种金属分别加入到等质量、等质量分数的足量稀盐酸中(反应关系如图甲),把金属M加入到足量的Y(NO3)2溶液中(反应关系如图乙)。据此判断四种金属的活动性顺序为( ) A、X>Z>M>Y B、Y>M>Z>X C、X>Z>Y >M D、Z>X>M>Y10. 下图所示的四个图像,分别对应四种过程,其中正确的是( )
A、X>Z>M>Y B、Y>M>Z>X C、X>Z>Y >M D、Z>X>M>Y10. 下图所示的四个图像,分别对应四种过程,其中正确的是( ) A、①分别向等质量Mg和Cu中加入足量等质量、等浓度的稀硫酸 B、②分别向等质量且足量的Zn中加入等质量、不同浓度的稀硫酸 C、③分别向等质量且足量的Mg和Zn中加入等质量、等浓度的稀硫酸 D、④分别向等质量的Mg和Zn中加入等质量、等浓度且足量的稀硫酸11. 探究锌、铜、镁的金属活动性时,下列现象、分析或结论正确的是( )
A、①分别向等质量Mg和Cu中加入足量等质量、等浓度的稀硫酸 B、②分别向等质量且足量的Zn中加入等质量、不同浓度的稀硫酸 C、③分别向等质量且足量的Mg和Zn中加入等质量、等浓度的稀硫酸 D、④分别向等质量的Mg和Zn中加入等质量、等浓度且足量的稀硫酸11. 探究锌、铜、镁的金属活动性时,下列现象、分析或结论正确的是( )
 A、盐酸的浓度可以不同 B、铜片表面有气泡 C、镁片的试管表面发烫 D、活动性Cu>Zn>Mg12. 下列图像能正确反映对应变化关系的是( )A、
A、盐酸的浓度可以不同 B、铜片表面有气泡 C、镁片的试管表面发烫 D、活动性Cu>Zn>Mg12. 下列图像能正确反映对应变化关系的是( )A、 在一定量的硝酸银和硝酸铜的混合溶液中加入铁粉至过量
B、
在一定量的硝酸银和硝酸铜的混合溶液中加入铁粉至过量
B、 用胃舒平[主要成分Al(OH)3]治疗胃酸过多时胃液pH的情况
C、
用胃舒平[主要成分Al(OH)3]治疗胃酸过多时胃液pH的情况
C、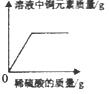 向盛有一定量氧化铜粉末的烧杯中不断加入稀硫酸至过量
D、
向盛有一定量氧化铜粉末的烧杯中不断加入稀硫酸至过量
D、 加热一定量氯酸钾和二氧化锰固体混合物
加热一定量氯酸钾和二氧化锰固体混合物
二、综合题
-
13. 联系已学的化学知识,回答下列问题。(1)、空气中能供给呼吸的气体是;(2)、熄灭酒精灯用灯帽盖灭,其灭火原理是。(3)、标出水中氢元素的化合价。(4)、铁制容器不能盛放硫酸铜溶液的原因(用化学方程式表示)。14. 铝是地壳中含量最多的金属元素,铝的化合物种类繁多,氧化铝的熔点(2050℃)高于铝的熔点(660℃)。硬铝(含铝、铜、镁、硅)是用途广发的铝合金。结合课本知识回答下列问题。
(1)、硬铝比铝的硬度(填“大”或“小”),硬铝含有的非金属元素是。(2)、氧化铝可用于制造耐火砖等高温材料,这是因为。
(3)、从活泼金属的化合物中提炼单质比较困难。人类3000做年前就使用铜,1500多年前就使用铁。推测人类使用铝比铁的年代(填“早”或“晚”)。(4)、药物“胃舒平”(主要成分是氢氧化铝)可治疗胃酸过多,反应的化学方程式是。15. 置换反应是化学反应的基本类型之一.(1)、金属与盐溶液之间的置换反应,一般是活动性较强的金属可把活动性较弱的金属从其盐溶液中置换出来,如铜和硝酸银溶液反应,其化学方程式为 .(2)、非金属单质也具有类似金属与盐溶液之间的置换反应规律,即活动性较强的非金属可把活动性较弱的非金属从其盐溶液中置换出来,如在溶液中可发生下列反应:Cl2+2NaBr═2NaCl+Br2;I2+Na2S═2NaI+S↓+Br2;Br2+2KI═2KBr+I2 由此可判断:
①S、Cl2、I2、Br2活动性由强到弱顺序是 .
②下列化学方程式书写错误的是
(A)Cl2+2NaI═2NaCl+I2 (B)I2+2KBr═2KI+Br2
(C)Br2+Na2S═2NaBr+S↓ (D)Cl2+K2S═2KCl+S↓
16. 金属材料广泛应用于生产生活中。(1)、常温下大多数金属都是固体,但体温计中的金属却是液体,该金属是。(2)、铝在空气中与氧气反应,其表面生成一层致密的氧化物薄膜,从而阻止铝进一步氧化。这种氧化物的化学式为。(3)、向含有氯化铜、氯化锌、稀盐酸的混合溶液中加入过量铁粉,充分反应后过滤,滤液中含有的溶质是(写化学式)。(4)、铁矿石有多种,如赤铁矿(主要成分Fe2O3)和磁铁矿(主要成分Fe3O4)等。①写出赤铁矿石中的主要成分与一氧化碳反应的化学方程式。
②冶炼2900t含四氧化三铁80%的磁铁矿石,理论上能得到含杂质2%的生铁的质量是 t(结果精确到0.1)。
(5)、含有锌粉6.5g、铁粉5.6g、铜粉3.2g、铝粉1.8g的混合物与一定质量的稀硫酸充分反应,反应停止后,有6g固体剩余。则生成氢气的质量为g。
三、推断题
-
17. 已知 A 是黑色固体,B 为汽车铅蓄电池中含有的酸。C 为农药波尔多液的主要 成分之一,D、E、F 均为单质。下图为这些物质的转化关系,其中部分反应物、生成物、反应物、反应条件已省略。
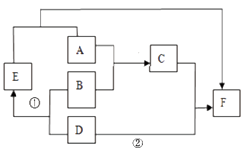 (1)、写出下列物质的化学式:B。(2)、反应①的基本反应类型为。(3)、写出反应②的化学方程式。18. 某工厂在生产过程中会产生大量氧化铜废料(杂质与稀硫酸不发生反应且不溶于水),工厂技术科设计如下的生产流程来回收金属,其流程图如下:
(1)、写出下列物质的化学式:B。(2)、反应①的基本反应类型为。(3)、写出反应②的化学方程式。18. 某工厂在生产过程中会产生大量氧化铜废料(杂质与稀硫酸不发生反应且不溶于水),工厂技术科设计如下的生产流程来回收金属,其流程图如下: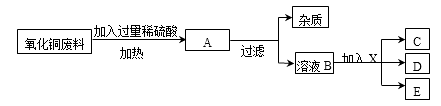
试回答下列有关问题:
(1)、在加热条件下,氧化铜能与稀硫酸迅速反应生成硫酸铜和一种氧化物,该氧化物是相对分子质量最小的氧化物。则氧化铜与稀硫酸反应的化学方程式为;(2)、过滤时用到的玻璃仪器有玻璃棒、烧杯和;(3)、溶液B中的溶质为:;(4)、若D是一种浅绿色溶液,C是一种最轻的气体,则X的化学式为 , 在溶液B中加入X时发生的化学反应方程式为