2017_2018学年高中化学人教版选修四 第四章电化学基础4.4金属的电化学腐蚀与防护
试卷更新日期:2018-08-22 类型:同步测试
一、2017_2018学年高中化学新人教版选修4第四章电化学基础4.4金属的电化学腐蚀与防护b测试
-
1. 下列关于金属腐蚀的说法中正确的是( )A、金属腐蚀指不纯金属与接触到的电解质溶液进行化学反应而损耗的过程 B、电化学腐蚀指在外加电流的作用下不纯金属发生化学反应而损耗的过程 C、钢铁腐蚀最普遍的是吸氧腐蚀,负极吸收氧气,产物最终转化为铁锈 D、金属的电化学腐蚀和化学腐蚀本质相同,但电化学腐蚀伴有电流产生2. 如图所示,各烧杯中盛有海水,铁在其中被腐蚀由快到慢的顺序为( )
 A、②①③④⑤⑥ B、⑤④③①②⑥ C、⑤④②①③⑥ D、⑤③②④①⑥3. 如图所示的钢铁腐蚀中,下列说法正确的是( )
A、②①③④⑤⑥ B、⑤④③①②⑥ C、⑤④②①③⑥ D、⑤③②④①⑥3. 如图所示的钢铁腐蚀中,下列说法正确的是( )
①

②
A、碳表面发生氧化反应 B、钢铁被腐蚀的最终产物为FeO C、生活中钢铁制品的腐蚀以图①所示为主 D、图②中,正极反应式为O2+4e-+2H2O=4OH-4. 图Ⅰ的目的是精炼铜,图Ⅱ的目的是保护钢闸门,下列说法不正确的是( )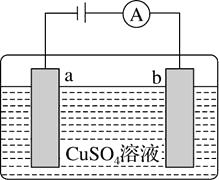
图Ⅰ

图Ⅱ
A、图Ⅰ中a为纯铜 B、图Ⅰ中SO42-向b极移动 C、图Ⅱ中如果a、b间连接电源,则a连接负极 D、图Ⅱ中如果a、b间用导线连接,则X可以是铜5. 铝表面在空气中天然形成的氧化膜耐磨性和抗蚀性不够强。控制一定的条件,用如图所示的电化学氧化法,可在铝表面生成坚硬的氧化膜。下列有关叙述正确的是( )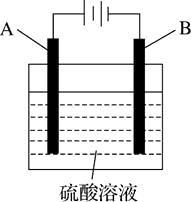 A、阴极上有金属铝生成 B、电极A为石墨,电极B为金属铝 C、OH-在电极A上放电,有氧气生成 D、阳极的电极反应式为2Al-6e-+3H2O=Al2O3+6H+6. 如图所示装置,均盛有等体积等浓度的稀硫酸,工作相同的时间后测得均通过n mol e-。下列叙述错误的是(不考虑溶液体积的变化)( )
A、阴极上有金属铝生成 B、电极A为石墨,电极B为金属铝 C、OH-在电极A上放电,有氧气生成 D、阳极的电极反应式为2Al-6e-+3H2O=Al2O3+6H+6. 如图所示装置,均盛有等体积等浓度的稀硫酸,工作相同的时间后测得均通过n mol e-。下列叙述错误的是(不考虑溶液体积的变化)( )
甲
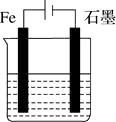
乙
A、铁棒的腐蚀程度:甲<乙 B、碳电极上发生反应的电极反应式相同 C、溶液的pH:甲减小,乙增大 D、甲、乙产生气体的体积(相同条件)比为3∶27. 将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致该现象的主要原因是液滴之下氧气含量比边缘处少。下列说法正确的是( )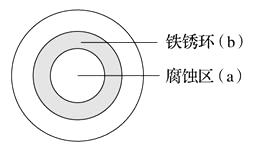 A、液滴中的Cl-由a区向b区迁移 B、液滴边缘是正极区,发生的电极反应式为O2+2H2O+4e-=4OH- C、液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH-形成Fe(OH)2 , 进一步氧化、脱水形成铁锈 D、若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为Cu-2e-=Cu2+8. 模拟铁的电化学防护的实验装置如图所示,下列说法错误的是( )
A、液滴中的Cl-由a区向b区迁移 B、液滴边缘是正极区,发生的电极反应式为O2+2H2O+4e-=4OH- C、液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH-形成Fe(OH)2 , 进一步氧化、脱水形成铁锈 D、若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为Cu-2e-=Cu2+8. 模拟铁的电化学防护的实验装置如图所示,下列说法错误的是( )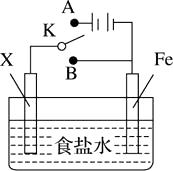 A、若X为碳棒,开关K置于A处可减缓铁的腐蚀 B、若X为锌棒,开关K置于B处时,铁电极上发生的反应为2H++2e-=H2↑ C、若X为锌棒,开关K置于A处或B处均可减缓铁的腐蚀 D、若X为碳棒,开关K置于A处时,铁电极上发生的反应为2H++2e-=H2↑9. 分析下图,写出有关反应式:
A、若X为碳棒,开关K置于A处可减缓铁的腐蚀 B、若X为锌棒,开关K置于B处时,铁电极上发生的反应为2H++2e-=H2↑ C、若X为锌棒,开关K置于A处或B处均可减缓铁的腐蚀 D、若X为碳棒,开关K置于A处时,铁电极上发生的反应为2H++2e-=H2↑9. 分析下图,写出有关反应式: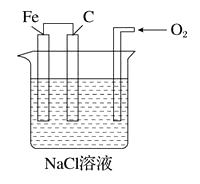 (1)、铁棒上 ,(2)、碳棒上 ,(3)、溶液里。10. 镁、铝、铁是重要的金属,在工业生产中用途广泛。(1)、镁与稀硫酸反应的离子方程式为。(2)、铝与氧化铁发生铝热反应的化学方程式为。(3)、在潮湿的空气里,钢铁表面有一层水膜,很容易发生电化学腐蚀。其中正极的电极反应式为。(4)、在海洋工程上,通常用铝合金(Al-Zn-Cd)保护海底钢铁设施,其原理如图所示:
(1)、铁棒上 ,(2)、碳棒上 ,(3)、溶液里。10. 镁、铝、铁是重要的金属,在工业生产中用途广泛。(1)、镁与稀硫酸反应的离子方程式为。(2)、铝与氧化铁发生铝热反应的化学方程式为。(3)、在潮湿的空气里,钢铁表面有一层水膜,很容易发生电化学腐蚀。其中正极的电极反应式为。(4)、在海洋工程上,通常用铝合金(Al-Zn-Cd)保护海底钢铁设施,其原理如图所示: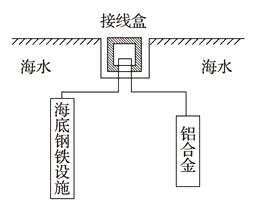
其中负极发生的电极反应为;
在实际应用中,用铝合金而不选用纯铝,纯铝不能很好地起到保护作用,其原因是。
11. 钢铁工业是国家工业的基础,请回答钢铁腐蚀与防护过程中的有关问题。(1)、生产中可用盐酸来除铁锈。现将一生锈的铁片放入盐酸中,当铁锈被除尽后,溶液中发生的化合反应的化学方程式是。(2)、下列哪个装置可防止铁棒被腐蚀________。A、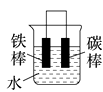 B、
B、 C、
C、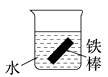 D、
D、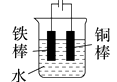 (3)、在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如下:
(3)、在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如下: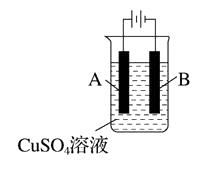
①A电极对应的金属是(写元素名称),B电极的电极反应式是。
②若电镀前铁、铜两片金属质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12 g,则电镀时电路中通过的电子为 mol。
③镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因。
12. 对金属制品进行抗腐蚀处理,可延长其使用寿命。(1)、以下为铝材表面处理的一种方法: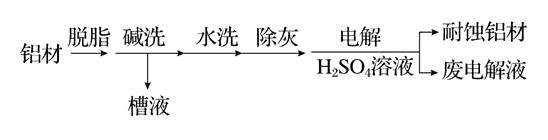
①碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,原因是(用离子方程式表示),为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的。
a.NH3 b.CO2
c.NaOH d.HNO3
②以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应式为 , 取少量废电解液加入NaHCO3溶液后产生气泡和白色沉淀;产生沉淀的原因是。
(2)、镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨做阳极的原因是。(3)、利用下图装置,可以模拟铁的电化学防护。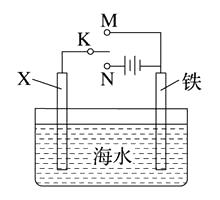
若X为碳棒,为减缓铁的腐蚀,开关K应置于处。
若X为锌,开关K置于M处,该电化学防护法称为。