2017_2018学年高中化学人教版选修三 课时训练16离子晶体
试卷更新日期:2018-08-22 类型:同步测试
一、离子晶体的特征
-
1. 离子晶体一般不具有的特征是( )A、熔点较高,硬度较大 B、易溶于水而难溶于有机溶剂 C、固体时不能导电 D、离子核间距较大,其密度较小2. 下列有关离子晶体的数据大小比较不正确的是( )A、熔点:NaF>MgF2>AlF3 B、晶格能:NaF>NaCl>NaBr C、阴离子的配位数:CsCl>NaCl>CaF2 D、硬度:MgO>CaO>BaO3. 下列物质中属于含有非极性键的离子晶体是 ( )
①醋酸钠 ②氢氧化钾 ③过氧化钠 ④金刚石
⑤乙醇 ⑥碳化钙
A、①②③⑥ B、①③⑥ C、①③④⑤ D、①②⑥二、离子晶体的性质
-
4. 下列各组物质,前者的熔点高于后者的是( )
①干冰与固态二硫化碳 ②NaCl晶体与KCl晶体 ③金刚石与晶体硅 ④干冰与二氧化硅
A、①② B、③④ C、②④ D、②③5. MgO、Rb2O、CaO、BaO四种离子晶体熔点的高低顺序可能是( )A、MgO>Rb2O>BaO>CaO B、MgO>CaO>BaO>Rb2O C、CaO>BaO>MgO>Rb2O D、CaO>BaO>Rb2O>MgO6. 根据表中给出物质的熔点数据(AlCl3沸点为260 ℃),判断下列说法错误的是( )晶体
NaCl
MgO
SiCl4
AlCl3
晶体硼
熔点/℃
801
2 800
-70
180
2 500
A、MgO中的离子键比NaCl中的离子键强 B、SiCl4晶体是分子晶体 C、AlCl3晶体是离子晶体 D、晶体硼是原子晶体7. 离子晶体不可能具有的性质是( )A、较高的熔、沸点 B、良好的导电性 C、溶于极性溶剂 D、坚硬而易粉碎三、晶体结构
-
8. 下图是CaF2晶胞的结构。下列说法正确的是 ( )
 A、一个CaF2晶胞中含有8个Ca2+ B、一个CaF2晶胞中含有8个F- C、在CaF2晶胞中Ca2+的配位数为4 D、在CaF2晶胞中F-的配位数为89. 某氧化铝陶瓷晶体中含有X、Y、Z三种元素,其晶胞如图所示,则三种原子的原子个数比为( )
A、一个CaF2晶胞中含有8个Ca2+ B、一个CaF2晶胞中含有8个F- C、在CaF2晶胞中Ca2+的配位数为4 D、在CaF2晶胞中F-的配位数为89. 某氧化铝陶瓷晶体中含有X、Y、Z三种元素,其晶胞如图所示,则三种原子的原子个数比为( )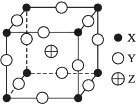 A、1∶3∶1 B、2∶1∶6 C、4∶8∶1 D、8∶12∶110. 已知CsCl晶体的密度为ρ g·cm-3 , NA为阿伏加德罗常数,相邻的两个Cs+的核间距为a cm,如图所示,则CsCl的相对分子质量可以表示为( )A、NA·a3·ρ B、 C、 D、11. 下面有关离子晶体的叙述中,不正确的是( )A、1 mol氯化钠中有NA个NaCl分子 B、氯化钠晶体中,每个Na+周围距离相等的Na+共有12个 C、氯化铯晶体中,每个Cs+周围紧邻8个Cl- D、平均每个NaCl晶胞中有4个Na+、4个Cl-12. 现有几组物质的熔点(℃)的数据:
A、1∶3∶1 B、2∶1∶6 C、4∶8∶1 D、8∶12∶110. 已知CsCl晶体的密度为ρ g·cm-3 , NA为阿伏加德罗常数,相邻的两个Cs+的核间距为a cm,如图所示,则CsCl的相对分子质量可以表示为( )A、NA·a3·ρ B、 C、 D、11. 下面有关离子晶体的叙述中,不正确的是( )A、1 mol氯化钠中有NA个NaCl分子 B、氯化钠晶体中,每个Na+周围距离相等的Na+共有12个 C、氯化铯晶体中,每个Cs+周围紧邻8个Cl- D、平均每个NaCl晶胞中有4个Na+、4个Cl-12. 现有几组物质的熔点(℃)的数据:A组
B组
C组
D组
金刚石:3 550
Li:181
HF:-83
NaCl:801
硅晶体:1 410
Na:98
HCl:-115
KCl:776
硼晶体:2 300
K:64
HBr:-89
RbCl:718
二氧化硅:1 723
Rb:39
HI:-51
CsCl:645
据此回答下列问题:
(1)、A组属于晶体,其熔化时克服的微粒间的作用力是。(2)、B组晶体共同的物理性质是 (填序号)。①有金属光泽 ②导电性 ③导热性 ④延展性
(3)、C组中HF熔点反常是由于 。(4)、D组晶体可能具有的性质是(填序号)。①硬度小 ②水溶液能导电 ③固体能导电
④熔融状态能导电
(5)、D组晶体的熔点由高到低的顺序为NaCl>KCl>RbCl>CsCl,其原因解释为 。四、达标训练
-
13. 下列关于离子晶体的晶格能的说法中正确的是 ( )A、离子晶体的晶格能指形成1 mol离子键所放出的能量 B、离子晶体的晶格能指破坏1 mol离子键所吸收的能量 C、离子晶体的晶格能指1 mol离子化合物中的阴、阳离子由相互远离的气态离子结合成离子晶体时所放出的能量 D、离子晶体的晶格能的大小与晶体的熔点、硬度都无关14. 仅由下列各组元素所组成的化合物,不可能形成离子晶体的是( )A、H O S B、Na H O C、K Cl O D、H N Cl15. 自然界中的CaF2又称萤石,是一种难溶于水的固体,属于典型的离子晶体。下列实验一定能说明CaF2是离子晶体的是( )A、CaF2难溶于水,其水溶液的导电性极弱 B、CaF2的熔沸点较高,硬度较大 C、CaF2固体不导电,但在熔融状态下可以导电 D、CaF2在有机溶剂(如苯)中的溶解度极小16. 下面有关晶体的叙述中,不正确的是( )A、金刚石空间网状结构中,由共价键形成的碳原子环中,最小环上有6个碳原子 B、氯化钠晶体中,每个Na+周围距离相等的Cl-共有6个 C、氯化铯晶体中,每个Cs+周围紧邻8个Cl- D、干冰晶体中,每个CO2分子周围紧邻10个CO2分子17. NaF、NaI、MgO均为离子化合物,由下列表中数据可确定这三种化合物熔点高低的顺序,则正确的是( )
物质
①NaF
②NaI
③MgO
离子电荷数
1
1
2
键长/10-10m
2.31
3.18
2.10
A、①>②>③ B、③>①>② C、③>②>① D、②>①>③18. 为了确定SbCl3、SbCl5、SnCl4是否为离子化合物,可以进行下列实验,其中合理、可靠的是( )A、观察常温下的状态,SbCl5是苍黄色液体,SnCl4为无色液体。结论:SbCl5和SnCl4都是离子化合物 B、测定SbCl3、SbCl5、SnCl4的熔点依次为73.5℃、2.8℃、-33℃。结论:SbCl3、SbCl5、SnCl4都不是离子化合物 C、将SbCl3、SbCl5、SnCl4溶解于水中,滴入HNO3酸化的AgNO3溶液,产生白色沉淀。结论:SbCl3、SbCl5、SnCl4都是离子化合物 D、测定SbCl3、SbCl5、SnCl4的水溶液的导电性,发现它们都可以导电。结论:SbCl3、SbCl5、SnCl4都是离子化合物19. 下列说法中一定正确的是( )A、固态时能导电的物质一定是金属晶体 B、熔融状态能导电的晶体一定是离子晶体 C、水溶液能导电的晶体一定是离子晶体 D、固态不导电而熔融状态导电的晶体一定是离子晶体20. 对于氯化钠晶体,下列描述正确的是( )A、它是六方紧密堆积的一个例子 B、58.5g氯化钠晶体中约含6.02×1023个NaCl分子 C、与氯化铯晶体结构相同 D、每个Na+与6个Cl-作为近邻21. 某离子晶体中晶体结构最小的重复单元如图:A为阴离子,在立方体内,B为阳离子,分别在顶点和面心。则该晶体的化学式为( )A、B2A B、BA2 C、B7A4 D、B4A722. 已知A、B、C、D、E都是周期表中前四周期的元素,且原子序数依次增大,其中A原子核外有三个未成对电子;A与B可形成离子化合物B3A2;C元素是地壳中含量最高的金属元素;D原子核外的M层中有两对成对电子;E原子核外最外层只有1个电子,其余各层电子均充满。请根据以上信息,回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):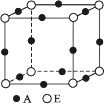 (1)、比E核外电子数少5的元素的原子核外电子排布式是 , A、B、C、D的第一电离能由小到大的顺序为。(2)、B的氯化物的熔点远高于C的氯化物的熔点,理由是。(3)、A的氢化物属于(填“极性”或“非极性”)分子,D的低价氧化物分子的立体构型是。(4)、A、E形成的某种化合物的晶胞结构如图所示,则其化学式为(每个球均表示1个原子)。
(1)、比E核外电子数少5的元素的原子核外电子排布式是 , A、B、C、D的第一电离能由小到大的顺序为。(2)、B的氯化物的熔点远高于C的氯化物的熔点,理由是。(3)、A的氢化物属于(填“极性”或“非极性”)分子,D的低价氧化物分子的立体构型是。(4)、A、E形成的某种化合物的晶胞结构如图所示,则其化学式为(每个球均表示1个原子)。