2017_2018学年高中化学人教版选修三 课时训练12晶体的常识
试卷更新日期:2018-08-22 类型:同步测试
一、晶体与非晶体
-
1. 下列叙述中正确的是( )A、具有规则几何外形的固体一定是晶体 B、晶体与非晶体的根本区别在于是否具有规则的几何外形 C、具有各向异性的固体一定是晶体 D、晶体、非晶体都具有固定的熔点2. 从我们熟悉的食盐、金属、冰到贵重的钻石等都是晶体,而同样透明的玻璃却是非晶体。下列关于晶体和非晶体的本质区别的叙述中,正确的是( )A、是否具有规则的几何外形 B、是否具有固定组成 C、是否具有美观对称的外形 D、内部基本构成微粒是否按一定规律做周期性重复排列3. 关于晶体的自范性,下列叙述正确的是( )A、破损的晶体能够在固态时自动变成规则的多面体 B、缺角的氯化钠晶体在饱和的NaCl溶液中慢慢变为完美的立方块 C、圆形容器中结出的冰是圆形的 D、由玻璃制成的圆形玻璃球4. 下列过程中不能得到晶体的是( )A、降低NaCl饱和溶液的温度所得到的固体 B、气态水直接冷却成固态水 C、熔融的KNO3冷却后所得到的固体 D、将液态的塑料冷却后所得到的固体
二、晶胞
-
5. 下列有关晶胞的叙述中不正确的是( )A、晶胞是晶体最小的结构重复单元 B、不同的晶体中晶胞的大小和形状都相同 C、晶胞中的粒子可能不完全属于该晶胞 D、已知晶胞的组成就可推知晶体的组成6. 硼和镁形成的化合物刷新了金属化合物超导的最高纪录。右图是该化合物的晶胞结构:镁原子间形成正六棱柱,且棱柱的上下底面还各有一个镁原子;6个硼原子位于棱柱内。该化合物的化学式为 ( )
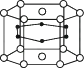
硼镁化合物的结构
A、MgB B、MgB2 C、Mg2B D、Mg2B37. 根据所学知识填空:(1)、在下列物质中,属于晶体的是 , 属于非晶体的是;A.玻璃 B.雪花 C.橡胶 D.铁块 E.单晶硅 F.沥青
(2)、晶体中的微粒与晶胞的关系为:①凡处于立方体顶点的微粒,同时为个晶胞共有;
②凡处于立方体棱上的微粒,同时为个晶胞共有;
③凡处于立方体面上的微粒,同时为个晶胞共有;
④凡处于立方体体心的微粒,同时为个晶胞共有。
8. 某晶胞结构如图所示,X位于立方体的顶点,Y位于立方体的中心。试分析: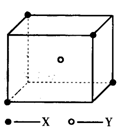
(1)、在一个晶胞中有个X,个Y,晶体的化学式为。
(2)、晶体中距离最近的两个X与一个Y所形成的夹角∠XYX为(填角的度数)。9. 石墨的片层结构如图所示,试完成下列各题: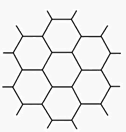
(1)、每个正六边形实际上占有的碳原子数个。(2)、石墨晶体每一层内的碳原子数与C—C键的个数之比是。(3)、n g碳原子可构成个正六边形。三、达标训练
-
10. 下列关于晶体与非晶体的说法不正确的是( )A、区别晶体与非晶体最可靠的科学方法是对固体进行X-射线衍射实验 B、非晶体中粒子的排列无序,所以非晶体具有各向异性 C、晶体有自范性 D、非晶体无固定熔点11. 晶体是一类非常重要的材料,在很多领域都有广泛的应用。我国现已能够拉制出直径为300毫米的大直径硅单晶,晶体硅大量用于电子产业。下列对晶体硅的叙述中正确的是( )A、形成晶体硅的速率越大越好 B、晶体硅没有固定的熔、沸点 C、可用X-射线衍射实验来鉴别晶体硅和玻璃 D、晶体硅的形成与晶体的自范性有关,而与各向异性无关12. 下列关于晶体的说法中,正确的是( )A、将饱和硫酸铜溶液降温,析出的固体不是晶体 B、假宝石往往是玻璃仿造的,可以用划痕的方法鉴别宝石和玻璃制品 C、石蜡和玻璃都是非晶体,但它们都有固定的熔点 D、蓝宝石在不同方向上的硬度一定相同13. 下图是天然水晶球里的玛瑙和水晶,两者的根本区别在于( )
 A、外形不一样,构成两者的原子不同 B、构成玛瑙的基本粒子无规则排列,构成水晶的基本粒子按一定的规律周期性重复排列 C、水晶有固定的熔沸点,而玛瑙无固定熔沸点 D、水晶可用于能量转换,玛瑙可用于装饰品14. 某晶体的一部分如右图所示,这种晶体中A、B、C三种粒子的个数之比是( )
A、外形不一样,构成两者的原子不同 B、构成玛瑙的基本粒子无规则排列,构成水晶的基本粒子按一定的规律周期性重复排列 C、水晶有固定的熔沸点,而玛瑙无固定熔沸点 D、水晶可用于能量转换,玛瑙可用于装饰品14. 某晶体的一部分如右图所示,这种晶体中A、B、C三种粒子的个数之比是( )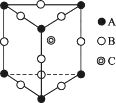 A、3∶9∶4 B、1∶4∶2 C、2∶9∶4 D、3∶8∶415. 话筒是我们熟悉的物质,在话筒中有一种材料的结构如图所示,它的主要成分是钛酸钡,根据晶体的结构示意图可知它的化学式是( )
A、3∶9∶4 B、1∶4∶2 C、2∶9∶4 D、3∶8∶415. 话筒是我们熟悉的物质,在话筒中有一种材料的结构如图所示,它的主要成分是钛酸钡,根据晶体的结构示意图可知它的化学式是( )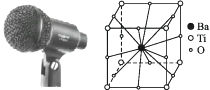 A、BaTi8O12 B、BaTi4O6 C、BaTi2O4 D、BaTiO316. 氢是重要而洁净的能源。要利用氢气作为能源,必须解决好安全有效地储存氢气的问题。化学家研究出利用合金储存氢气的方法,其中镧(La)镍(Ni)合金是一种储氢材料,这种合金的晶体结构已经测定,其基本结构单元如图所示,则该合金的化学式可表示为( )
A、BaTi8O12 B、BaTi4O6 C、BaTi2O4 D、BaTiO316. 氢是重要而洁净的能源。要利用氢气作为能源,必须解决好安全有效地储存氢气的问题。化学家研究出利用合金储存氢气的方法,其中镧(La)镍(Ni)合金是一种储氢材料,这种合金的晶体结构已经测定,其基本结构单元如图所示,则该合金的化学式可表示为( )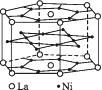 A、LaNi5 B、LaNi C、La14Ni24 D、La7Ni1217. 纳米材料的表面粒子数占总粒子数的比例极大,这是它有许多特殊性质的原因。假设某氯化钠纳米颗粒的大小和形状恰好与氯化钠晶胞的大小和形状相同(如图所示),则这种纳米颗粒的表面粒子数与总粒子数的比值为( )
A、LaNi5 B、LaNi C、La14Ni24 D、La7Ni1217. 纳米材料的表面粒子数占总粒子数的比例极大,这是它有许多特殊性质的原因。假设某氯化钠纳米颗粒的大小和形状恰好与氯化钠晶胞的大小和形状相同(如图所示),则这种纳米颗粒的表面粒子数与总粒子数的比值为( )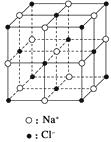 A、7∶8 B、13∶14 C、25∶25 D、26∶2718. 元素X的某价态离子Xn+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如图所示。
A、7∶8 B、13∶14 C、25∶25 D、26∶2718. 元素X的某价态离子Xn+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如图所示。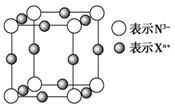
(1)、该晶体中阳离子与阴离子个数比为。(2)、该晶体中Xn+中n=。(3)、X元素的原子序数是。19. 随着科学技术的发展,阿伏加德罗常数的测定手段越来越多,测定的精确度也越来越高。现有一种简单可行的测定方法,具体步骤为:①将NaCl固体细粒干燥后准确称取m g NaCl固体细粒并转移到定容仪器A中。
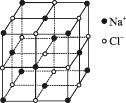
②用滴定管向A仪器中加苯,不断振荡,继续加苯至A仪器的刻度 ,计算出NaCl固体的体积为V cm3(氯化钠的晶胞如图所示)。请回答下列问题:
(1)、步骤①中A仪器最好使用 (填序号)。A、量筒 B、烧杯 C、容量瓶 D、试管(2)、步骤②能否用水代替苯?(填“能”或“不能”),理由是。(3)、已知NaCl晶体中,靠得最近的Na+和Cl-间的距离为a cm,则用上述方法测得阿伏加德罗常数(NA)的表达式为 。