2015-2016学年内蒙古包头市包钢四中高二下学期期中化学试卷
试卷更新日期:2017-02-22 类型:期中考试
一、选择题
-
1. 下列物质在一定条件下,可与CH4发生化学反应的是( )A、氯气 B、溴水 C、NaOH溶液 D、酸性KMnO4溶液2. 下列烷烃的沸点:甲烷:﹣162℃;乙烷:﹣89℃;丁烷:﹣1℃;戊烷:36℃.根据以上数据推断丙烷的沸点可能是( )A、约﹣40℃ B、低于﹣162℃ C、低于﹣89℃ D、高于36℃3. 下列叙述不正确的是( )A、铁表面镀锌,铁作阳极 B、船底镶嵌锌块,锌作负极,以防船体被腐蚀 C、钢铁吸氧腐蚀的正极反应:O2+2H2O+4e﹣=4OH﹣ D、工业上电解饱和食盐水的阳极反应:2Cl﹣﹣2e﹣=Cl24. 下列关于原电池的叙述正确的是( )A、构成原电池的正极和负极必须是两种不同的金属 B、原电池是将化学能转变为电能的装置 C、原电池中电子流出的一极是负极,该极被还原 D、原电池放电时,电流的方向是从负极到正极5. 等质量的下列各烃完全燃烧时,消耗氧气最多的是( )A、CH4 B、C2H6 C、C3H6 D、C6H66. 下列化学式只表示一种纯净物的是( )A、C2H6 B、C4H10 C、C2H4Cl2 D、C7. 铜锌原电池(如图)工作时,下列叙述正确的是( )
 A、在外电路中,电流从Zn极流向Cu极 B、盐桥中的Cl﹣移向CuSO4溶液 C、当负极减小65g时,正极增加65g D、电池的总反应为 Zn+Cu2+=Zn2++Cu8. 根据如图所示的装置,判断下列说法正确的是( )
A、在外电路中,电流从Zn极流向Cu极 B、盐桥中的Cl﹣移向CuSO4溶液 C、当负极减小65g时,正极增加65g D、电池的总反应为 Zn+Cu2+=Zn2++Cu8. 根据如图所示的装置,判断下列说法正确的是( ) A、该装置中a极为负极 B、当装置中某一块铜片的质量变化了12.8 g时,a极上消耗的O2在标准状况下的体积为4.48 L C、该装置中b极的电极反应式是:H2﹣2e﹣=2H+ D、一段时间后,左边装置中溶液pH减小9. 下列叙述正确是( )A、原电池中阳离子向负极移动 B、用铝质铆钉接铁板,铁易被腐蚀 C、马口铁(镀锡)表面一旦破损,铁腐蚀加快 D、白铁(镀锌)表面一旦破损,铁腐蚀加快10. 钢铁生锈过程发生如下反应:
A、该装置中a极为负极 B、当装置中某一块铜片的质量变化了12.8 g时,a极上消耗的O2在标准状况下的体积为4.48 L C、该装置中b极的电极反应式是:H2﹣2e﹣=2H+ D、一段时间后,左边装置中溶液pH减小9. 下列叙述正确是( )A、原电池中阳离子向负极移动 B、用铝质铆钉接铁板,铁易被腐蚀 C、马口铁(镀锡)表面一旦破损,铁腐蚀加快 D、白铁(镀锌)表面一旦破损,铁腐蚀加快10. 钢铁生锈过程发生如下反应:①2Fe+O2+2H2O=2Fe(OH)2;②4Fe(OH)2+O2+2H2O=4Fe(OH)3;③2Fe(OH)3=Fe2O3+3H2O.
下列说法正确的是( )
A、反应①、②中电子转移数目相等 B、反应①中氧化剂是氧气和水 C、与铜质水龙头连接处的钢质水管不易发生腐蚀 D、钢铁在潮湿的空气中不能发生电化学腐蚀11. 镍镉(Ni﹣Cd)可充电电池在现代生活中有广泛应用.电解质溶液为KOH溶液,电池反应为:Cd+2NiO(OH)+2H2O Cd(OH)2+2Ni(OH)2 , 下列有关镍镉电池的说法正确的是( )A、充电过程是化学能转化为电能的过程 B、充电时阳极反应为Cd(OH)2+2e﹣═Cd+2OH﹣ C、放电时电池内部OH﹣向正极移动 D、充电时与直流电源正极相连的电极上发生Ni(OH)2转化为NiO(OH)的反应12. 下列物质:①Cl2 ②HBr ③H2O ④H2 , 其中在一定条件下能与乙烯发生加成反应的是( )A、①② B、③④ C、①③④ D、全部13. 下列关于苯的叙述不正确的是( )A、苯是无色、带有特殊气味的液体 B、苯分子中键与键的夹角是120° C、苯在一定条件下能与溴发生取代反应 D、苯中不含碳碳双键,所以不可能发生加成反应14. 关苯与乙烯的比较中,正确的是( )A、分子中所有原子都在同一平面上 B、等质量燃烧时,苯耗氧多 C、都能与溴水反应 D、都能被酸性高锰酸钾溶液氧化15. 利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( ) A、氯碱工业中,X、Y均为石墨,X附近能得到氢氧化钠 B、铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4 C、电镀工业中,X是待镀金属,Y是镀层金属 D、外加电流的阴极保护法中,Y是待保护金属16. 某原电池总反应的离子方程式为2Fe3++Fe=3Fe2+ , 不能实现该反应的原电池组成是( )A、正极为铜,负极为铁,电解质溶液为FeCl3溶液 B、正极为碳,负极为铁,电解质溶液为Fe(NO3)3溶液 C、正极为铂,负极为铁,电解质溶液为Fe2(SO4)3溶液 D、正极为银,负极为铁,电解质溶液为CuSO4溶液17. 以石墨棒作电极,电解氯化铜溶液,若电解时转移的电子数是3.01×1023 , 则此时在阴极上析出铜的质量是( )A、8g B、16g C、32g D、64g18. 用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一物质中(括号内),溶液能与原来溶液完全一样的是( )A、AgNO3 (Ag2O) B、NaOH(NaOH) C、NaCl (盐酸) D、CuSO4(Cu(OH)2)19. 如图是电解CuCl2溶液的装置,其中c、d为石墨电极.则下列有关的判断正确的是( )
A、氯碱工业中,X、Y均为石墨,X附近能得到氢氧化钠 B、铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4 C、电镀工业中,X是待镀金属,Y是镀层金属 D、外加电流的阴极保护法中,Y是待保护金属16. 某原电池总反应的离子方程式为2Fe3++Fe=3Fe2+ , 不能实现该反应的原电池组成是( )A、正极为铜,负极为铁,电解质溶液为FeCl3溶液 B、正极为碳,负极为铁,电解质溶液为Fe(NO3)3溶液 C、正极为铂,负极为铁,电解质溶液为Fe2(SO4)3溶液 D、正极为银,负极为铁,电解质溶液为CuSO4溶液17. 以石墨棒作电极,电解氯化铜溶液,若电解时转移的电子数是3.01×1023 , 则此时在阴极上析出铜的质量是( )A、8g B、16g C、32g D、64g18. 用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一物质中(括号内),溶液能与原来溶液完全一样的是( )A、AgNO3 (Ag2O) B、NaOH(NaOH) C、NaCl (盐酸) D、CuSO4(Cu(OH)2)19. 如图是电解CuCl2溶液的装置,其中c、d为石墨电极.则下列有关的判断正确的是( ) A、a为负极、b为正极 B、a为阳极、b为阴极 C、电解过程中,d电极质量增加 D、电解过程中,氯离子浓度不变20. 下列关于铜电极的叙述中,正确的是( )A、铜锌原电池中铜是负极 B、用电解法精炼粗铜时,纯铜作阳极 C、在镀件上电镀铜时可用金属铜作阳极 D、电解稀硫酸制H2、O2时,铜作阳极21. 用石墨电极电解1molL﹣1的下列溶液,溶液的pH不变的是( )A、HCl B、NaOH C、Na2SO4 D、NaCl22. 依据下图判断,下列叙述正确的是( )
A、a为负极、b为正极 B、a为阳极、b为阴极 C、电解过程中,d电极质量增加 D、电解过程中,氯离子浓度不变20. 下列关于铜电极的叙述中,正确的是( )A、铜锌原电池中铜是负极 B、用电解法精炼粗铜时,纯铜作阳极 C、在镀件上电镀铜时可用金属铜作阳极 D、电解稀硫酸制H2、O2时,铜作阳极21. 用石墨电极电解1molL﹣1的下列溶液,溶液的pH不变的是( )A、HCl B、NaOH C、Na2SO4 D、NaCl22. 依据下图判断,下列叙述正确的是( )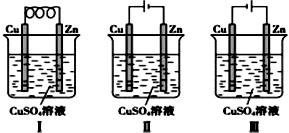 A、Ⅰ是原电池,Ⅱ是电镀装置 B、Ⅰ、Ⅱ装置中锌极上均发生氧化反应 C、Ⅱ、Ⅲ装置中,铜极均发生氧化反应而溶解 D、Ⅱ、Ⅲ装置中Cu2+浓度基本不变23. 在冶金工业中,常用电解法得到钠、镁、铝等金属,其原因是( )A、都是轻金属 B、都是活泼金属 C、成本低廉 D、这些金属的化合物熔点较低24. 某同学为了使反应2HCl+2Ag═2AgCl+H2↑能进行,设计了如图所示的四个实验,你认为可行的方案是( )A、
A、Ⅰ是原电池,Ⅱ是电镀装置 B、Ⅰ、Ⅱ装置中锌极上均发生氧化反应 C、Ⅱ、Ⅲ装置中,铜极均发生氧化反应而溶解 D、Ⅱ、Ⅲ装置中Cu2+浓度基本不变23. 在冶金工业中,常用电解法得到钠、镁、铝等金属,其原因是( )A、都是轻金属 B、都是活泼金属 C、成本低廉 D、这些金属的化合物熔点较低24. 某同学为了使反应2HCl+2Ag═2AgCl+H2↑能进行,设计了如图所示的四个实验,你认为可行的方案是( )A、 B、
B、 C、
C、 D、
D、 25. 能用于除去甲烷中混有的乙烯的试剂是( )A、溴水 B、酸性高锰酸钾溶液 C、苛性钠溶液 D、四氯化碳溶液
25. 能用于除去甲烷中混有的乙烯的试剂是( )A、溴水 B、酸性高锰酸钾溶液 C、苛性钠溶液 D、四氯化碳溶液二、填空题:
-
26. 依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.

请回答下列问题:
(1)、电极X的材料是;电解质溶液Y是;(2)、银电极为电池的极,发生的电极反应为;X电极上发生的电极反应为;(3)、外电路中的电子是从电极流向电极.27. 摩托罗拉公司开发了一种以甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可以连续使用一个月.已知该电池的总反应式为:2CH3OH+3O2+4KOH 2K2CO3+6H2O 请填空:(1)、放电时:负极的电极反应式为 .(2)、通入甲醇一端的电极是极,电池在放电过程中溶液的pH将(填“上升”、“下降”或“不变”).(3)、若在常温、常压下,1g CH3OH燃烧生成CO2和液态水时放出22.68kJ的热量,表示该反应的热化学方程式为 .28. 苯是最重要的基本有机化工原料之一,现利用苯,同时使用其他部分试剂,可实现如下转化:请回答下列问题: (1)、C的结构简式为;(2)、写出下列反应的化学方程式:反应①:;反应②:;(3)、上述反应①~③中,属于加成反应的是(填序号).29. 如图为相互串联的甲乙两电解池.
(1)、C的结构简式为;(2)、写出下列反应的化学方程式:反应①:;反应②:;(3)、上述反应①~③中,属于加成反应的是(填序号).29. 如图为相互串联的甲乙两电解池. (1)、甲池若为用电解原理精炼铜的装置,①A是极,材料是 , 电极反应为 , ②B是极,材料是 , 主要电极反应为 , 电解质溶液为 .(2)、写出乙池中发生的总反应的离子方程式 .(3)、若甲池中阴极增重12.8g,则乙池中阳极放出的气体在标准状况下的体积为 L.(4)、若此时乙池剩余液体为400mL,则电解后得到碱液的物质的量浓度为 mol/L.
(1)、甲池若为用电解原理精炼铜的装置,①A是极,材料是 , 电极反应为 , ②B是极,材料是 , 主要电极反应为 , 电解质溶液为 .(2)、写出乙池中发生的总反应的离子方程式 .(3)、若甲池中阴极增重12.8g,则乙池中阳极放出的气体在标准状况下的体积为 L.(4)、若此时乙池剩余液体为400mL,则电解后得到碱液的物质的量浓度为 mol/L.