云南省昆明市2017-2018学年高考理综-化学1月模拟考试试卷
试卷更新日期:2018-08-16 类型:高考模拟
一、单选题
-
1. 化学与生活密切相关,下列有关说法错误的是( )A、硅胶可用作袋装食品的干燥剂 B、液化石油气与天然气主要成分相同 C、煤属于一次能源,电力属于二次能源 D、甲醛是室内空气污染的主要污染物之一2. 下列说法错误的是( )
 A、X→Y反应类型为酯化反应 B、X、Y、Z均能使溴的四氯化碳溶液褪色 C、Y和Z互为同分异构体 D、等物质的量的X、Z分别与足量Na反应,消耗Na的物质的量之比为2:13. 下列实验操作规范且能达到目的的是( )
A、X→Y反应类型为酯化反应 B、X、Y、Z均能使溴的四氯化碳溶液褪色 C、Y和Z互为同分异构体 D、等物质的量的X、Z分别与足量Na反应,消耗Na的物质的量之比为2:13. 下列实验操作规范且能达到目的的是( )实验目的
实验操作
A
用18.4mol·L-1的浓硫酸配制100mL1.84mol·L-1的稀硫酸
用量筒量取10.0mL浓硫酸后,需用水洗涤量筒,并将洗涤液液转入容量瓶
B
用酸性高锰酸钾溶液测定溶液中Fe2+的浓度
将酸性高锰酸钾溶液装入碱性滴定管中进行滴定
C
分离苯萃取溴水中的水层和有机层
将分液漏斗下面的话塞拧开,放出水层,再换一个烧杯放出有机层
D
除去乙醇中的水
加入生石灰,进行蒸馏
A、A B、B C、C D、D4. NA为阿伏加德罗常数的值。下列说法正确的是( )A、2.0gH218O与D2O的混合物中所含中子数为NA B、标准状况下,22.4LSO3中含有的原子数为4NA C、78g苯含有的碳碳双键数为3NA D、1molNA与3molH2反生成的NH3分子数为2NA5. 某研究小组设计如下装置处理pH为5-6的污水。下列说法正确的是( )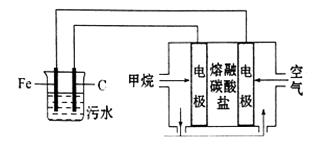 A、阳极的电极反应式为:Fe-3e-=Fe3+ B、正极的电极反应式为:O2+2H2O+4e-=4OH- C、若阴极转移2mol电子,则负极消耗5.6LCH4 D、污水中最终会产生Fe(OH)3 , 吸附污物而形成沉淀6. 短周期元素W、X、Y、Z在元素周期表中的相对位置如下图所示,其中Z元素的最外层电子数是其电子层数的两倍。下列说法正确的是( )
A、阳极的电极反应式为:Fe-3e-=Fe3+ B、正极的电极反应式为:O2+2H2O+4e-=4OH- C、若阴极转移2mol电子,则负极消耗5.6LCH4 D、污水中最终会产生Fe(OH)3 , 吸附污物而形成沉淀6. 短周期元素W、X、Y、Z在元素周期表中的相对位置如下图所示,其中Z元素的最外层电子数是其电子层数的两倍。下列说法正确的是( )W
X
Y
Z
A、原子半径:Y>W>X B、气态氢化物的稳定性:W>Y>X C、氧化物对应水化物的酸性:Z>Y>X D、自然界中X、Z两种元素均以游离态形式存在7. 已知:T℃时,Ksp(CaSO4)=4.90×10-5、Ksp (CaCO3)=2.8×10-9 Ksp(PbCO3)=8.4×10-14 , 三种盐的沉淀溶解平衡曲线如图所示,pM=-lgc(阴离子)、pN=-lgc(阳离子)。下列说法错误的是( ) A、a线是CaSO4沉定溶解平衡曲线 B、T℃时,向10mL水中加入CaCO3和PbCO3至二者均饱和,溶液中c(Ca2+)∶c(Pb2+)= C、d点表示CaCO3的饱和溶液。且c(Ca2+)<c(CO32-) D、T℃时,向CaSO4沉淀中加入1mol·L-1的Na2CO3溶液,CaSO4沉淀会转化为CaCO3沉淀
A、a线是CaSO4沉定溶解平衡曲线 B、T℃时,向10mL水中加入CaCO3和PbCO3至二者均饱和,溶液中c(Ca2+)∶c(Pb2+)= C、d点表示CaCO3的饱和溶液。且c(Ca2+)<c(CO32-) D、T℃时,向CaSO4沉淀中加入1mol·L-1的Na2CO3溶液,CaSO4沉淀会转化为CaCO3沉淀二、综合题
-
8. 某校化学研究性学习小组设计实验验证NH3能还原CuO,并对还原产物进行探究。请回答下列问题:(1)、Ⅰ.验证NH3能还原CuO
 试剂X为。(2)、请将提供的装置按合理顺序连接。g→。(3)、装置B的作用是。(4)、证明NH3能还原CuO的实验现象是。(5)、II.探充还原产物的成分
试剂X为。(2)、请将提供的装置按合理顺序连接。g→。(3)、装置B的作用是。(4)、证明NH3能还原CuO的实验现象是。(5)、II.探充还原产物的成分【查阅资料】Cu2O粉末呈红色,在酸性溶液中不稳定:Cu2O+H2SO4(稀)=Cu+CuSO4+H2O。
【实验探究】
实验操作
实验现象
实验结论
取10.4g红色固体于烧杯中,加入足量稀硫酸,充分搅拌,静置
若无现象
①证明红色固体为。
若溶液变蓝
②证明红色固体肯定含有 , 可能含有。
取上述反应后的混合物过滤、洗涤、干燥、称重,得固体6.4g
③经计算,红色固体的成分及其物质的量
9. 金属钛被用于航空航天工业、化工、医疗等领域。用钛铁矿(主要成分为FeTiO3) 制取钛并获得副产品绿矾的工艺流程如下: (1)、TiOSO4中钛的化合价为 , 操作I的名称是为。(2)、TiOSO4经水解得H2TiO3的化学方程式为。(3)、TIO2与焦炭和Cl2在高温下反应得TiCl4井产生还原性气体,相应的化学方程式为。(4)、加热Mg与TiCl4得到钛时,Ar的作用是。(5)、某厂用3.8吨纯度为40%的钛铁矿制取钛,理论上至少需要氯气L(标准状况下)。(6)、已知K3[Fe(CN)6](铁氰化钾》和K4[Fe(CN)6]( 亚铁氰化钾)能发生如下反应:3Fe2++ 2[Fe(CN)6]3-= Fe3[Fe(CN)6]2↓(蓝色沉淀),4Fe3++ 3(Fe(CN)6]4-= Fe4[Fe(CN)6]3↓(蓝色沉淀)
(1)、TiOSO4中钛的化合价为 , 操作I的名称是为。(2)、TiOSO4经水解得H2TiO3的化学方程式为。(3)、TIO2与焦炭和Cl2在高温下反应得TiCl4井产生还原性气体,相应的化学方程式为。(4)、加热Mg与TiCl4得到钛时,Ar的作用是。(5)、某厂用3.8吨纯度为40%的钛铁矿制取钛,理论上至少需要氯气L(标准状况下)。(6)、已知K3[Fe(CN)6](铁氰化钾》和K4[Fe(CN)6]( 亚铁氰化钾)能发生如下反应:3Fe2++ 2[Fe(CN)6]3-= Fe3[Fe(CN)6]2↓(蓝色沉淀),4Fe3++ 3(Fe(CN)6]4-= Fe4[Fe(CN)6]3↓(蓝色沉淀)①确定绿矾部分被氧化的方法是。(可供选择的试剂:铁氰化钾溶液、亚铁氧化钾溶液。铁粉、KSCN溶液)
②室温下,将绿矾配成0.1mol·L-1FeSO4溶液,测得溶液的pH=3,请用离子方程式解释原因 , 该溶液中c(SO42- )-c(Fe2+)≈ mol·L-1。
10. 钼(Mo) 是一种难熔稀有金属,我国的钼储量居世界第二。钼及其合金在冶金,农业、电器、化工、环保等方面有着广泛的应用。(1)、Mo可被发烟硝酸氧化,产物MoOF4和MoO2F2物质的量比为1∶1,完成下列方程式:Mo+HF +HNO3= MoO2F2+ MoOF4+NO2↑+(2)、已知:①2Mo(s)+3O2(g)=2MoO3(s) ΔH1②MoS2(s) +2O2(g)=Mo(s)+2SO2(g) ΔH2
③2MoS2(s)+7O2(g)=2MoO3(s)+4SO2(g) ΔH3
则ΔH3 =(用含ΔH1、ΔH2的代数式表示),在反应③中若有0.2mol MoS2参加反应,则转移电子mol。
(3)、密闭容器中用Na2CO3(S)作固硫剂,同时用一定量的氢气还原辉钼矿(MoS2)的原理是:MoS2(s)+4H2(g)+2Na2CO3(s) Mo(s) +2CO(g)+4H2O(g)+2Na2S(s) ΔH,实验测得平衡时的有关变化曲线如图所示:
①由图可知,该反应的ΔH 0(填“>”或“<”) ;P20.1MPa(填“>”或“<”)。
②如果上述反应在体积不变的密闭容器中达平衡,下列说法错误的是(选填编号)。
A.v正(H2)=v逆(H2O)
B.再加入MoS2 , 则H2转化率增大
C.容器内气体的密度不变时,一定达平衡状态
D.容器内压强不变时,一定达平衡状态
③由图可知M点时氢气的平衡转化率为 (计算结果保留0.1%)。
④平衡常数可用平衡分压代替平衡浓度计算,气体分压=气体总压×物质的量分数。求图中M点的平衡常数Kp=(MPa)2
11. 氨、磷属于同一主族元素,是组成生命体的重要元素,其单质及化合物用途广泛。回答下列问题:(1)、基态P原子的核外电子排布式为 , 磷及其同周期相邻元素第一电离能由大到小的顺序是。(2)、NH3比PH3易液化的原因是。(3)、自然固氨现象发生的一系列化学变化:N2→NO→NO2→HNO3→NO3- 解释了民谚“雷雨发庄稼”的原理。①N2分子结构中。σ键和π键之比为 , 已知N N的键能为946kJ·mol-1 , 远大于N—N的键能(193 kJ·mol-1) 的三倍,原因是。
②NO3-中N原子采取杂化方式,其空间构型为 , 写出它的一种等电子体的化学式。
③已知酸性: HNO3>HNO2 , 下列相关见解合理的是。
A.含氧酸中氧原子总数越多,酸性越强
B.同种元素化合价越高,对应含氧酸的酸性越强
C.HNO3中氮元素的正电性更高,在水溶液中更易电离出H+ , 酸性强于HNO2
(4)、磷化硬(BP) 是一种超硬耐磨涂层材料,其晶胞结构如图所示,图中a点和b点的原子坐标参数依次为(0,0,0)、( , , ),则c 点的原子坐标参数为。已知该晶体密度为ρg·cm-3 , 则B-P键的键长为pm (阿伏加德罗常数用NA表示,列出计算式即可)。 12. 化合物G[
12. 化合物G[ ]是一种医药中间体,它的一种合成路线如下:
]是一种医药中间体,它的一种合成路线如下:
已知:
请回答下列问题:
(1)、A的名称是。(2)、B→C的反应条件为。A→B和D→E的反应类型分别是、。
(3)、D在浓硫酸加热的条件下会生成一种含六元环的化合物,该化合物的结构简式为。(4)、H是一种高聚酯,D→H的化学方程式为。(5)、下列关于化合物G的说法错误的是_____________。A、G的分子式为C12H14O5 B、1molG与NaOH溶液加热最多消耗2molNaOH C、一定条件下G发生消去反应生成的有机物存在顺反异构体 D、在一定条件下G能与HBr发生取代反应(6)、M是D的同分异构体,与D具有相同的官能团。则M可能的结构有种。(7)、已知酚羟基不易与羧酸发生酯化反应,写出由苯酚,甲苯为原料制备苯甲酸苯酚酯( )的合成路线(其它试剂任选)。
)的合成路线(其它试剂任选)。