陕西省榆林市2017-2018学年高考理综-化学三模考试试卷
试卷更新日期:2018-08-16 类型:高考模拟
一、单选题
-
1. 化学与人们的生活关系密切,下列说法正确的是( )A、医用酒精消毒的原理是酒精将病毒氧化了,使其丧失致病能力 B、“煤改气”和“煤改电”等清洁能源改造工程有利于减少雾霾天气 C、PM2.5是指大气中直径等于或小于2.5pm(皮米)的细小颗粒物 D、为防止富脂月饼被氧化变质,常在包装袋中放入生石灰或硅胶2. A、B是两种重要的有机合成原料,下列说法正确的是( )
 A、A与B是同系物 B、A与B中相同的官能团是苯环 C、在一定条件下,A 与B 均能发生取代反应 D、A与B都能使溴的四氧化碳溶液褪色3. X、Y、Z、M是原子序数依次增大的短周期主族元素,Y的最外层电子数是内层电子数的3倍,Y与Z 形成的化合物Z2Y3中,元素质量比m(Y):m(Z)=8:9;X原子的最外层电子数为M原子和Z原子最外层电子数的和的一半。下列说法正确的是( )A、X的最高价氧化物的水化物一定为强酸 B、气态氢化物的沸点:Y<M C、原子半径Z>M>X>Y D、Z是地壳中含量最多的元素4. 利用电导率传感器可绘制电导率曲线图,下图为用0.1mol/LNaOH溶液滴定10mL0.1mol/L盐酸过程中的电导率曲线。下列说法错误的是( )
A、A与B是同系物 B、A与B中相同的官能团是苯环 C、在一定条件下,A 与B 均能发生取代反应 D、A与B都能使溴的四氧化碳溶液褪色3. X、Y、Z、M是原子序数依次增大的短周期主族元素,Y的最外层电子数是内层电子数的3倍,Y与Z 形成的化合物Z2Y3中,元素质量比m(Y):m(Z)=8:9;X原子的最外层电子数为M原子和Z原子最外层电子数的和的一半。下列说法正确的是( )A、X的最高价氧化物的水化物一定为强酸 B、气态氢化物的沸点:Y<M C、原子半径Z>M>X>Y D、Z是地壳中含量最多的元素4. 利用电导率传感器可绘制电导率曲线图,下图为用0.1mol/LNaOH溶液滴定10mL0.1mol/L盐酸过程中的电导率曲线。下列说法错误的是( ) A、电导率传感器能用于判断酸碱中和滴定的终点 B、a、b、c 点的溶液中,离子浓度由大到小顺序为a>b>c C、d点所示溶液中存在:c(Cl-) +c(OH-) =c(H+) +c(Na+) D、C点电导率最小是因为此时溶液中导电微粒数目最少5. 下列关于甲、乙、丙、丁四种仪器装置的用法,不合理的是( )
A、电导率传感器能用于判断酸碱中和滴定的终点 B、a、b、c 点的溶液中,离子浓度由大到小顺序为a>b>c C、d点所示溶液中存在:c(Cl-) +c(OH-) =c(H+) +c(Na+) D、C点电导率最小是因为此时溶液中导电微粒数目最少5. 下列关于甲、乙、丙、丁四种仪器装置的用法,不合理的是( ) A、甲装置:可用来证明硫的非金属性比硅强 B、乙装置:橡皮管的作用是能使水顺利流下 C、丙装置:用图示的方法能检查此装置的气密性 D、丁装置:可在瓶中先装入某种液体收集NO气体6. CO常用于工业冶炼金属,如图是在不同温度下CO还原四种金属氧化物达平衡后气体中lg[c(CO)/c(CO2)]与温度(t)的关系曲线图。下列说法正确的是( )
A、甲装置:可用来证明硫的非金属性比硅强 B、乙装置:橡皮管的作用是能使水顺利流下 C、丙装置:用图示的方法能检查此装置的气密性 D、丁装置:可在瓶中先装入某种液体收集NO气体6. CO常用于工业冶炼金属,如图是在不同温度下CO还原四种金属氧化物达平衡后气体中lg[c(CO)/c(CO2)]与温度(t)的关系曲线图。下列说法正确的是( ) A、工业上可以通过增高反应装置来延长矿石和CO接触的时间,减少尾气中CO的含量 B、CO不适宜用于工业冶炼金属铬(Cr) C、工业冶炼金属铜(Cu)时较高的温度有利于提高CO的利用率 D、CO还原PbO2的反应△H >07. 如图所示是几种常见的化学电源示意图,有关说法正确的是( )
A、工业上可以通过增高反应装置来延长矿石和CO接触的时间,减少尾气中CO的含量 B、CO不适宜用于工业冶炼金属铬(Cr) C、工业冶炼金属铜(Cu)时较高的温度有利于提高CO的利用率 D、CO还原PbO2的反应△H >07. 如图所示是几种常见的化学电源示意图,有关说法正确的是( )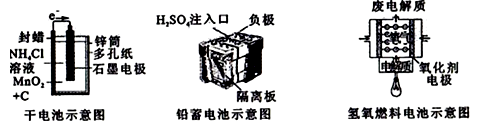 A、上述电池分别属于一次电池、二次电池和燃料电池 B、干电池工作时,H+向锌筒移动 C、铅蓄电池工作过程中,每通过2 mol电子,负极质量减轻207g D、氢氧燃料电池的正极反应一定是O2+4e-+2H2O=4OH-
A、上述电池分别属于一次电池、二次电池和燃料电池 B、干电池工作时,H+向锌筒移动 C、铅蓄电池工作过程中,每通过2 mol电子,负极质量减轻207g D、氢氧燃料电池的正极反应一定是O2+4e-+2H2O=4OH-二、综合题
-
8. 氰化钠化学式为NaCN(C元素+2价,N元素-3价),氰化钠是一种白色结晶颗粒,剧毒,易溶于水,水溶液呈碱性,易水解生成氰化氢。(1)、NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润红色石蕊试纸变蓝的气体,该反应的离子方程式是。(2)、氰化钠与硫代硫酸钠的反应为:NaCN+Na2S2O3═NaSCN+Na2SO3;已知:NaSCN中S为-2价,写出SCN-的电子式。(3)、CN-中C元素显+2价,N元素显-3价,说明非金属性N>C,请设计实验证明:。(4)、同时HCN又能与水互溶,造成水污染。已知部分弱酸的电离平衡常数如表:
弱酸
HCOOH
HCN
H2CO3
电离平衡常数(25℃)
Ka=1.77×10-4
Ka=5.0×10-10
Ka1=4.3×10-7 Ka2=5.6×10-11
①向NaCN溶液中通入少量CO2 , 发生的离子反应为。
②等体积、等物质的量浓度的HCOONa和NaCN溶液中所含离子总数的关系是:HCOONaNaCN。(填“>”、“<”或“=”)
(5)、常温下,用0.10mol·L-1NaOH溶液分别滴定20.00 mL浓度均为0.10 mol·L-1CH3COOH溶液和HCN溶液所得滴定曲线如下图。
①常温时醋酸的电离常数为1.96×10-5 , 0.10 mol·L-1CH3COOH溶液中c(H+)=mol·L-1。
②在①所示的溶液中溶质为
③在①和②所示溶液中c(CH3COO-)-c(CN-)(填“>”、“<”或“=”)c(HCN)-c(CH3COOH)。
9. 三氯化碘(ICl3)在药物合成中用途非常广泛,其熔点为33℃,沸点为73℃。实验室可用如图装置制取ICl3。 (1)、仪器a的名称是。(2)、制备氯气选用的药品为漂白粉固体(主要成分为CaClO2)和浓盐酸,相关反应的化学方程式为。(3)、装置B可用于除杂,也是安全瓶,能监测实验进行时装置C中是否发生堵塞,请写出发生堵塞时B中的现象:。(4)、试剂X为。(5)、氯气与单质碘需在温度稍低于70℃下反应,则装置D适宜的加热方式为。(6)、欲测定上述实验制备ICl3样品中ICl3的纯度,准确称取ICl3样品10.0g于烧杯中,加入适量水和过量KI 晶体,充分反应生成I2(样品中杂质不反应)。写出反应的方程式;将所得溶液配置成100mL待测液,取25.00mL待测液,用2.0mol/L的Na2S2O3标准液滴定(I2+2S2O32- =2I-+ S4O62-),以淀粉溶液作指示剂,达到终点时的现象为;重复滴定,实验数据记录如下:
(1)、仪器a的名称是。(2)、制备氯气选用的药品为漂白粉固体(主要成分为CaClO2)和浓盐酸,相关反应的化学方程式为。(3)、装置B可用于除杂,也是安全瓶,能监测实验进行时装置C中是否发生堵塞,请写出发生堵塞时B中的现象:。(4)、试剂X为。(5)、氯气与单质碘需在温度稍低于70℃下反应,则装置D适宜的加热方式为。(6)、欲测定上述实验制备ICl3样品中ICl3的纯度,准确称取ICl3样品10.0g于烧杯中,加入适量水和过量KI 晶体,充分反应生成I2(样品中杂质不反应)。写出反应的方程式;将所得溶液配置成100mL待测液,取25.00mL待测液,用2.0mol/L的Na2S2O3标准液滴定(I2+2S2O32- =2I-+ S4O62-),以淀粉溶液作指示剂,达到终点时的现象为;重复滴定,实验数据记录如下:滴定次数
待测液体积(mL)
Na2S2O3标准液体积/mL
滴定前读数(mL)
滴定后读数(mL)
1
25.00
0.50
20.40
2
25.00
4.00
24.10
3
25.00
4.20
26.70
该样品中ICl3的质量分数为。(ICl3相对分子质量为233.5)
10. 随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金维生素”。已知钒的原子序数为23,回答下列问题:(1)、钒被认为是一种稀土元素,广泛分散于各种矿物中,钾钒铀矿中的钒原子最外层已达到8 电子稳定结构,其化学式为K2H6U2V2O15(其中钒元素的化合价为+5价)。若用氧化物的形式表示,该化合物的化学式为:。(2)、五氧化二钒是工业制造中的常用催化剂,如工业制硫酸中就利用五氧化二钒作催化剂。从含钒废催化剂中回收钒,传统的技术是“氧化焙烧法”,其具体流程为:
其中焙烧是将食盐和钒铅矿在空气中焙烧,这时矿石中所含的V2O5就转化为NaVO3 , 然后用水从烧结块中浸出NaVO3 , 再用稀硫酸酸化就得到V2O5的水合物,经过煅烧就可得到V2O5。
①配料在焙烧前磨碎的目的是。
②写出焙烧过程中V2O5发生反应的化学方程式:。
(3)、测定钒含量的方法是先把钒转化成V2O5 , V2O5在酸性溶液里转变成VO,再用盐酸、硫酸亚铁、草酸等测定钒。反应的化学方程式为:VO2++H2C2O4=VO++2CO2+H2O。若反应消耗0.9 g 草酸,参加反应的钒元素质量是g。(4)、以V2O5为催化剂,使SO2转化为SO3的反应如下:2SO2(g)+O2(g) 2SO3(g)。某温度下,SO2的平衡转化率(a)与体系总压强(P)的关系如图所示。
根据图示回答下列问题:
①将2.0mol SO2和1.0mol O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa.该反应的平衡常数表达式为 , 等于。
②平衡状态由A变到B时,平衡常数K(A)K(B)(填“>”、“<”或“=”)。
11. X、Y、Z、P、Q为前四周期元素,且原子序数依次增大。X基态原子的L层有3个单电子,Z是周期表中电负性最大的元素;Y与P为同主族元素,且P基态原子的M层电子数为K层的3倍;Q2+离子的3d轨道上有9个电子。回答下列问题。(1)、基态Y原子的价电子排布图是;P所在周期中第一电离能最大的主族元素是 (元素名称)。(2)、XY3-中,中心原子的杂化方式为;XY2-离子的立体构型是。(3)、X 的氢化物比Y的氢化物沸点低的原因是。(4)、X的氢化物易形成配位键,而XZ3不易形成配位键,原因是。(5)、Y 与Q所形成的化合物晶体晶胞如图所示,该晶体的化学式:;晶胞参数如图所示,则该晶胞密度是g·cm-3。(列式并计算结果,保留小数点后一位)。 12. 煤不仅是重要的能源,也是化学工业的重要原料。下图为以煤为原料合成TNT和高聚物F的路线。
12. 煤不仅是重要的能源,也是化学工业的重要原料。下图为以煤为原料合成TNT和高聚物F的路线。
请回答下列问题:
(1)、下列说法正确的是_______。A、操作1是煤的干馏 B、煤的气化是化学变化,煤的液化是物理变化 C、煤中含有苯和二甲苯,所以煤干馏可得到苯和二甲苯(2)、由 生成烃A的反应类型是 , TNT的核磁共振氢谱有组峰。 (3)、C的结构简式是。(4)、含有苯环的有机物分子式为C8H9Cl,苯环上有3个取代基的同分异构体的数目为种。(5)、E是1,3-丁二烯,F是高分子化合物,D与E反应的方程式是。(6)、请写出以乙酸和
生成烃A的反应类型是 , TNT的核磁共振氢谱有组峰。 (3)、C的结构简式是。(4)、含有苯环的有机物分子式为C8H9Cl,苯环上有3个取代基的同分异构体的数目为种。(5)、E是1,3-丁二烯,F是高分子化合物,D与E反应的方程式是。(6)、请写出以乙酸和 为原料制备化工产品
为原料制备化工产品  的合成路线。
的合成路线。