2017年浙江省绍兴市高考化学模拟试卷
试卷更新日期:2017-02-21 类型:高考模拟
一、选择题
-
1. 2015年10月,浙江籍科学家屠呦呦因发现青蒿素(C15H22O5)而获得诺贝尔生理学或医学奖.根据物质的分类,青蒿素属于( )A、碱性氧化物 B、有机物 C、含氧酸盐 D、酸性氧化物2. 仪器名称为“蒸馏烧瓶”的是( )A、
 B、
B、 C、
C、 D、
D、 3. 下列属于弱电解质的是( )A、铜 B、硝酸钾 C、氢氧化钠 D、纯醋酸4. 下列属于氧化还原反应的是( )A、2KI+Br2═2KBr+I2 B、CaCO3 CaO+CO2↑ C、SO3+H2O H2SO4 D、MgCl2+2NaOH Mg(OH)2↓+NaCl5. 下列物质的水溶液因水解而呈酸性的是( )A、HCl B、NH4Cl C、Na2CO3 D、NaCl6. 下列说法不正确的是( )A、氯气可用于自来水的消毒 B、二氧化硅是半导体材料 C、氢氧化铁胶体能用于净水 D、二氧化硫可用于漂白纸浆7. 下列表示正确的是( )A、CO2的电子式:
3. 下列属于弱电解质的是( )A、铜 B、硝酸钾 C、氢氧化钠 D、纯醋酸4. 下列属于氧化还原反应的是( )A、2KI+Br2═2KBr+I2 B、CaCO3 CaO+CO2↑ C、SO3+H2O H2SO4 D、MgCl2+2NaOH Mg(OH)2↓+NaCl5. 下列物质的水溶液因水解而呈酸性的是( )A、HCl B、NH4Cl C、Na2CO3 D、NaCl6. 下列说法不正确的是( )A、氯气可用于自来水的消毒 B、二氧化硅是半导体材料 C、氢氧化铁胶体能用于净水 D、二氧化硫可用于漂白纸浆7. 下列表示正确的是( )A、CO2的电子式: B、乙烯的结构式:CH2═CH2
C、CH4的比例模型:
B、乙烯的结构式:CH2═CH2
C、CH4的比例模型:  D、Cl﹣离子的结构示意图:
D、Cl﹣离子的结构示意图:  8. 将下列物质分别加入到溴水中,溴水中溴单质的物质的量减少的是( )A、KCl B、KBr C、CCl4 D、I29. 下列说法正确的是( )A、某试样焰色反应呈黄色,则试样中可能含有K+ B、广泛pH试纸测得某新制氯水的pH为4 C、配制240mL某溶液,应选240mL容量瓶 D、可用排饱和食盐水来收集纯净的氯气10. 下列说法不正确的是( )A、126C和146C互为同位素 B、金刚石和石墨互为同素异形体 C、CH3COOCH2CH3和CH3CH2CH2COOH互为同分异构体 D、CH4和CH3Cl互为同系物11. 下列说法正确的是( )A、煤的干馏是化学变化,而煤的气化、液化是物理变化 B、石油裂解是为了获得更多汽油,以满足迅速增长的汽车需要 C、氢能、电能、风能都是无毒、无污染的绿色新能源,可以安全使用 D、玻璃是将石灰石、纯碱、石英在玻璃熔炉中高温熔融制得的12. 可逆反应在一定条件下达到化学平衡时,下列说法正确的是( )A、正反应速率等于逆反应速率,且都为零 B、反应物和生成物浓度相等 C、反应体系中混合物的组成保持不变 D、断开化学键吸收的能量等于形成化学键所放出的能量.13. 下列离子方程式正确的是( )A、二氧化锰和浓盐酸反应:MnO2+4HCl(浓) Mn2++2Cl2↑+2H2O B、稀盐酸和硅酸钠溶液反应:SiO32﹣+2H+═H2SiO3↓ C、碳酸钙和稀盐酸反应:CO32﹣+2H+═CO2↑+H2O D、铜和氯化铁溶液反应:Fe3++Cu═Fe2++Cu2+14. 如图所示是部分短周期元素主要化合价与原子序数的关系图,下列说法不正确的是( )
8. 将下列物质分别加入到溴水中,溴水中溴单质的物质的量减少的是( )A、KCl B、KBr C、CCl4 D、I29. 下列说法正确的是( )A、某试样焰色反应呈黄色,则试样中可能含有K+ B、广泛pH试纸测得某新制氯水的pH为4 C、配制240mL某溶液,应选240mL容量瓶 D、可用排饱和食盐水来收集纯净的氯气10. 下列说法不正确的是( )A、126C和146C互为同位素 B、金刚石和石墨互为同素异形体 C、CH3COOCH2CH3和CH3CH2CH2COOH互为同分异构体 D、CH4和CH3Cl互为同系物11. 下列说法正确的是( )A、煤的干馏是化学变化,而煤的气化、液化是物理变化 B、石油裂解是为了获得更多汽油,以满足迅速增长的汽车需要 C、氢能、电能、风能都是无毒、无污染的绿色新能源,可以安全使用 D、玻璃是将石灰石、纯碱、石英在玻璃熔炉中高温熔融制得的12. 可逆反应在一定条件下达到化学平衡时,下列说法正确的是( )A、正反应速率等于逆反应速率,且都为零 B、反应物和生成物浓度相等 C、反应体系中混合物的组成保持不变 D、断开化学键吸收的能量等于形成化学键所放出的能量.13. 下列离子方程式正确的是( )A、二氧化锰和浓盐酸反应:MnO2+4HCl(浓) Mn2++2Cl2↑+2H2O B、稀盐酸和硅酸钠溶液反应:SiO32﹣+2H+═H2SiO3↓ C、碳酸钙和稀盐酸反应:CO32﹣+2H+═CO2↑+H2O D、铜和氯化铁溶液反应:Fe3++Cu═Fe2++Cu2+14. 如图所示是部分短周期元素主要化合价与原子序数的关系图,下列说法不正确的是( ) A、X和W位于同一主族 B、原子半径:Y>Z>X C、盐YRX与化合物WX2的漂白原理相同 D、Y和R两者的最高价氧化物对应的水化物能相互反应15. 有关苯的结构和性质,下列说法正确的是( )A、
A、X和W位于同一主族 B、原子半径:Y>Z>X C、盐YRX与化合物WX2的漂白原理相同 D、Y和R两者的最高价氧化物对应的水化物能相互反应15. 有关苯的结构和性质,下列说法正确的是( )A、 与
与  是同一种物质,说明苯分子中碳碳双键、碳碳单键交替排列
B、苯在空气中不易燃烧完全,燃烧时冒浓烟,说明苯组成中含碳量较高
C、煤干馏得到的煤焦油可以分离出苯,苯是无色无味的液态烃
D、向2mL苯中加入1mL溴的四氯化碳溶液,振荡后静置,可观察到液体分层,上层呈橙红色
16. 下列说法不正确的是( )A、硬脂酸甘油酯在NaOH溶液中水解完全后,加入饱和食盐水,下层析出硬脂酸钠 B、天然高分子化合物淀粉或纤维素最终的水解产物都是葡萄糖 C、鸡蛋清的溶液中加入福尔马林溶液,鸡蛋清凝聚,蛋白质变性 D、不同种类的氨基酸能以不同的数目和顺序彼此结合,形成更复杂的多肽化合物17. 某研究性学习小组设计了用化学电源使LED灯发光的装置,示意图如图.下列说法不正确的是( )
是同一种物质,说明苯分子中碳碳双键、碳碳单键交替排列
B、苯在空气中不易燃烧完全,燃烧时冒浓烟,说明苯组成中含碳量较高
C、煤干馏得到的煤焦油可以分离出苯,苯是无色无味的液态烃
D、向2mL苯中加入1mL溴的四氯化碳溶液,振荡后静置,可观察到液体分层,上层呈橙红色
16. 下列说法不正确的是( )A、硬脂酸甘油酯在NaOH溶液中水解完全后,加入饱和食盐水,下层析出硬脂酸钠 B、天然高分子化合物淀粉或纤维素最终的水解产物都是葡萄糖 C、鸡蛋清的溶液中加入福尔马林溶液,鸡蛋清凝聚,蛋白质变性 D、不同种类的氨基酸能以不同的数目和顺序彼此结合,形成更复杂的多肽化合物17. 某研究性学习小组设计了用化学电源使LED灯发光的装置,示意图如图.下列说法不正确的是( ) A、锌是负极,电子从锌片经导线流向铜片 B、氢离子在铜片表面被还原 C、锌质量减少65g时,铜电极表面析出氢气是22.4L D、装置中存在“化学能→电能→光能”的转换18. 在一定条件下,发生反应:2X(g)+Y(g)⇌Z(g)△H=﹣197kJ•mol﹣1 , 若将2mol X和1mol Y充入2L的恒容密闭容器中,反应10min,测得X的物质的量为1.4mol,下列说法正确的是( )A、10min内,反应放出的热量为197kJ热量 B、10min内,X的平均反应速率为0.06mol•L﹣1•min﹣1 C、第10min时,Y的反应速率小于0.015mol•L﹣1•min﹣1(假如体系温度不变) D、第10min时,Z浓度为0.6mol•L﹣119. 根据热化学方程式:S(g)+O2(g)═SO2(g)△H=﹣Q kJ•mol﹣1 , 下列分析正确的是( )A、1mol S(g)与1mol O2(g)的总能量比1mol SO2(g)的总能量低Q kJ B、1mol S(g)与1mol O2(g)反应生成1mol SO2(g)放出Q kJ的热量 C、S(s)+O2(g)=SO2(g)△H<﹣Q kJ•mol﹣1 D、1个S(g)与1个O2(g)完全反应可以放出Q kJ的热量20. 下列说法正确的是( )A、Mg3N2晶体中的化学键是共价键 B、某物质含有离子键,则该物质在任何条件下均能导电 C、干冰是分子晶体,其气化过程中只需克服分子间作用力 D、常温常压下,气态单质分子中,每个原子的最外层都具有8电子稳定结构21. 某温度下,关于①0.01mol/L 醋酸溶液,②pH=2的醋酸溶液,下列说法正确的是( )A、c(CH3COOH):①>② B、c(CH3COO﹣):①>② C、c(CH3COOH)+c(CH3COO﹣):①=② D、c(CH3COO﹣)+c(OH﹣):①<②22. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、pH=1的H2SO4溶液,含H+的数目为2NA B、1mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 C、273K,101kPa下,14g乙烯与丙烯混合物中含有碳原子数目为3NA D、0.2mol C2H6O分子中一定存在0.2NA个碳碳单键23. 将乙醇滴入热的浓硫酸中,发生反应:C2H5OH+6H2SO4=6SO2↑+2CO2↑+9H2O,浓硫酸没有体现的性质是( )A、氧化性 B、脱水性 C、酸性 D、吸水性24. 向含b mol Na2CO3的溶液中缓慢滴加含a mol HCl溶液,并不断振荡,下列说法不正确的是( )
A、锌是负极,电子从锌片经导线流向铜片 B、氢离子在铜片表面被还原 C、锌质量减少65g时,铜电极表面析出氢气是22.4L D、装置中存在“化学能→电能→光能”的转换18. 在一定条件下,发生反应:2X(g)+Y(g)⇌Z(g)△H=﹣197kJ•mol﹣1 , 若将2mol X和1mol Y充入2L的恒容密闭容器中,反应10min,测得X的物质的量为1.4mol,下列说法正确的是( )A、10min内,反应放出的热量为197kJ热量 B、10min内,X的平均反应速率为0.06mol•L﹣1•min﹣1 C、第10min时,Y的反应速率小于0.015mol•L﹣1•min﹣1(假如体系温度不变) D、第10min时,Z浓度为0.6mol•L﹣119. 根据热化学方程式:S(g)+O2(g)═SO2(g)△H=﹣Q kJ•mol﹣1 , 下列分析正确的是( )A、1mol S(g)与1mol O2(g)的总能量比1mol SO2(g)的总能量低Q kJ B、1mol S(g)与1mol O2(g)反应生成1mol SO2(g)放出Q kJ的热量 C、S(s)+O2(g)=SO2(g)△H<﹣Q kJ•mol﹣1 D、1个S(g)与1个O2(g)完全反应可以放出Q kJ的热量20. 下列说法正确的是( )A、Mg3N2晶体中的化学键是共价键 B、某物质含有离子键,则该物质在任何条件下均能导电 C、干冰是分子晶体,其气化过程中只需克服分子间作用力 D、常温常压下,气态单质分子中,每个原子的最外层都具有8电子稳定结构21. 某温度下,关于①0.01mol/L 醋酸溶液,②pH=2的醋酸溶液,下列说法正确的是( )A、c(CH3COOH):①>② B、c(CH3COO﹣):①>② C、c(CH3COOH)+c(CH3COO﹣):①=② D、c(CH3COO﹣)+c(OH﹣):①<②22. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、pH=1的H2SO4溶液,含H+的数目为2NA B、1mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 C、273K,101kPa下,14g乙烯与丙烯混合物中含有碳原子数目为3NA D、0.2mol C2H6O分子中一定存在0.2NA个碳碳单键23. 将乙醇滴入热的浓硫酸中,发生反应:C2H5OH+6H2SO4=6SO2↑+2CO2↑+9H2O,浓硫酸没有体现的性质是( )A、氧化性 B、脱水性 C、酸性 D、吸水性24. 向含b mol Na2CO3的溶液中缓慢滴加含a mol HCl溶液,并不断振荡,下列说法不正确的是( )
A、当 a b >2时,发生的离子反应为:CO32﹣+H+═HCO3﹣ , HCO3﹣+H+═CO2↑+H2O B、当0< a b <1时,发生的离子反应为:CO32﹣+H+═HCO3﹣ C、当2a=3b时,发生的离子反应为:2CO32﹣+3H+═HCO3﹣+CO2↑+H2O D、当1< a b <2时,溶液中n(HCO3﹣)为(2a﹣b)mol25. 某混合物X由Na2O,Fe2O3、Cu、SiO2中的一种或几种物质组成.某兴趣小组以两条途径分别对X进行如下实验探究.下列有关说法不正确的是( ) A、无法判断混合物中是否含有Na2O B、由Ⅱ可知X中一定存在SiO2 C、1.92g固体成分为Cu D、15.6g混合物X中m(Fe2O3):m(Cu)=1:1
A、无法判断混合物中是否含有Na2O B、由Ⅱ可知X中一定存在SiO2 C、1.92g固体成分为Cu D、15.6g混合物X中m(Fe2O3):m(Cu)=1:1二、非选择题
-
26. CO和苯都是重要的化工原料.下图是某有机物B合成的过程.

请回答:
(1)、写出反应①的反应类型 , 反应②所加试剂 .(2)、关于物质A(CH2=CHCOOH)化学性质的说法正确的是 .A、物质A含有一种官能团 B、物质A与Na2CO3溶液反应能产生气泡 C、物质A不能使酸性KMnO4溶液褪色 D、常温常压下,物质A呈气态(3)、反应④的反应机理与制取乙酸乙酯相似,写出其化学方程式 .27. 已知A与D均为非金属单质,其中A有多种同素异形体,其转化关系如图.
请回答:
(1)、反应②为工业制粗硅原理,写出E的化学式: .(2)、反应①的化学方程式为 .28. 如图装置进行SO2气体性质实验.请回答: (1)、仪器D的名称是 .(2)、实验过程中,仪器A中的实验现象是 .(3)、写出仪器C中发生氧化还原反应的离子方程式:29. 烧杯中盛有NaHSO4和Na2SO4混合溶液体积为100mL,向烧杯中逐滴加入0.15mol•L﹣1Ba(OH)2溶液,当沉淀量达到最大值时,溶液的总体积为200mL.溶液中产生沉淀的物质的量n与溶液的pH的变化如图所示.请回答:
(1)、仪器D的名称是 .(2)、实验过程中,仪器A中的实验现象是 .(3)、写出仪器C中发生氧化还原反应的离子方程式:29. 烧杯中盛有NaHSO4和Na2SO4混合溶液体积为100mL,向烧杯中逐滴加入0.15mol•L﹣1Ba(OH)2溶液,当沉淀量达到最大值时,溶液的总体积为200mL.溶液中产生沉淀的物质的量n与溶液的pH的变化如图所示.请回答: (1)、原溶液中c(Na2SO4)=mol•L﹣1 .(2)、图中a值为 mol.30. 碳、硫和氮元素及其化合物的处理,是资源利用和环境保护的重要研究课题.(1)、CO可转化成二甲醚,原理为:2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)已知一定条件下,该反应中CO的平衡转化率随温度、投料比[n(H2)/n(CO)]的变化曲线如图1
(1)、原溶液中c(Na2SO4)=mol•L﹣1 .(2)、图中a值为 mol.30. 碳、硫和氮元素及其化合物的处理,是资源利用和环境保护的重要研究课题.(1)、CO可转化成二甲醚,原理为:2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)已知一定条件下,该反应中CO的平衡转化率随温度、投料比[n(H2)/n(CO)]的变化曲线如图1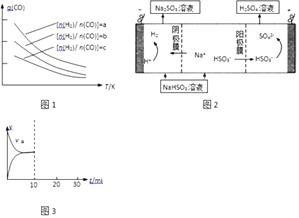
若温度升高,则反应的平衡常数K将(填“增大”、“减小”或“不变”);
(2)、SO2的水溶液呈酸性,某温度下,0.02mol•L﹣1亚硫酸水溶液的pH等于2,若忽略亚硫酸的二级电离和H2O的电离,则该温度下亚硫酸的一级电离常数Ka1= .(3)、已知:反应1:2SO2(g)+O2(g)⇌2SO3(g)△H1;反应2:2NO(g)+O2(g)⇌2NO2(g)△H2;若△H1<△H2<0,则反应3:SO2(g)+NO2(g)⇌SO3(g)+NO(g)属于(填“放热”或“吸热”)反应.
(4)、若用少量NaOH溶液吸收SO2气体,对产物NaHSO3进一步电解可制得硫酸,电解原理示意图(如图2).电解时阳极的电极反应式为 .(5)、在恒温密闭容器中通入SO2和NO2各1mol发生反应3:SO2(g)+NO2(g)⇌SO3(g)+NO(g),当反应达到平衡后,维持温度和容积不变,10min时再通入各1mol的SO2和NO2的混合气体,20min时再次平衡.两次平衡时NO2的转化率α1α2(填“>”、“<”、“=”);请在如图3画出正反应速率v正在10至30min间随时间变化的曲线图 .31. 某兴趣小组模拟企业对含铬废水(Cr2O72﹣和Cr3+)处理流程如图1
已知:2CrO42﹣+2H+═Cr2O72﹣+H2O
请回答:
(1)、用离子方程式表示调节池里发生的反应: .(2)、操作Ⅰ得到的残渣的化学式为 .(3)、操作Ⅲ调节pH时最适合作为调节剂的是 .A、4mol•L﹣1盐酸 B、6mol•L﹣1硫酸 C、石灰乳 D、碳酸钠(4)、为检测处理后废水中铬的含量,取100mL处理后的样品于锥形瓶中,用浓醋酸调节pH=5,并加入适量固体抗坏血酸,使Cr2O72﹣完全转化为Cr3+ , 再用amol•L﹣1的EDTA(用H4Y表示)标准溶液进行滴定,其反应原理为:Cr2O72﹣→2Cr3+ , Cr3++Y4﹣=CrY﹣①滴定时采用如图2所示的侧边自动定零位滴定管,具有的优点是 .
②实验消耗EDTA标准溶液b mL,则处理后废液中含铬浓度为 mg•L﹣1(用含a、b的式子表示).
32. 某研究小组以乙二酸二乙酯和氯苄为主要原料,按下列路线合成药物苯巴本妥
已知:

请回答:
(1)、写出化合物的结构简式:C;G .(2)、下列说法不正确的是 .A、化合物A能发生取代反应 B、D→E反应类型是消去反应 C、化合物F能发生酯化反应 D、苯巴比妥的分子式为C12H12N2O3(3)、写出同时符合下列条件的B的所有同分异构体: .①红光光谱标明分子中含有﹣C﹣O﹣结构;
②1H﹣NMR谱显示分子中含有苯环,且苯环上有四种不同化学环境的氢原子.
(4)、写出C→D的化学方程式: .(5)、设计以“二个碳原子的醇”为原料制备乙二酸二乙酯的合成路线(用流程图表示;无机试剂任选):