2017年浙江省名校协作体高考化学模拟试卷
试卷更新日期:2017-02-21 类型:高考模拟
一、选择题
-
1. 下列属于酸性氧化物的是( )A、水 B、一氧化碳 C、氧化钠 D、二氧化硫2. 下图是常用的化学仪器,其中常用于物质的分离与提纯的是( )A、
 B、
B、 C、
C、 D、
D、 3. 下列属于弱电解质的是( )A、硅 B、氨气 C、醋酸 D、氢氧化钡4. 一定条件下,碳单质和二氧化碳气体可以反应生成一氧化碳气体,该反应的类型为( )A、吸热反应 B、离子反应 C、复分解反应 D、非氧化还原反应5. 下列物质的水溶液因水解而呈酸性的是( )A、HCl B、NH4Cl C、CH3COONa D、NaHCO36. 下列说法不正确的是( )A、硅酸钠的水溶液俗称泡花碱,可用作粘合剂和防火材料 B、碘单质在苯中的溶解度较大,可用苯萃取碘水中的碘单质 C、小苏打可用于配制发酵粉,医疗上也可以用作治疗胃酸过多 D、浓硫酸具有强氧化性,不能干燥二氧化硫气体7. 下列表示正确的是( )A、HClO的结构式:H﹣O﹣Cl B、X=11,图表示钠原子的结构示意图
3. 下列属于弱电解质的是( )A、硅 B、氨气 C、醋酸 D、氢氧化钡4. 一定条件下,碳单质和二氧化碳气体可以反应生成一氧化碳气体,该反应的类型为( )A、吸热反应 B、离子反应 C、复分解反应 D、非氧化还原反应5. 下列物质的水溶液因水解而呈酸性的是( )A、HCl B、NH4Cl C、CH3COONa D、NaHCO36. 下列说法不正确的是( )A、硅酸钠的水溶液俗称泡花碱,可用作粘合剂和防火材料 B、碘单质在苯中的溶解度较大,可用苯萃取碘水中的碘单质 C、小苏打可用于配制发酵粉,医疗上也可以用作治疗胃酸过多 D、浓硫酸具有强氧化性,不能干燥二氧化硫气体7. 下列表示正确的是( )A、HClO的结构式:H﹣O﹣Cl B、X=11,图表示钠原子的结构示意图 C、CCl4的电子式:
C、CCl4的电子式:  D、乙炔的最简式:C2H2
8. 下列关于著名科学家及其成就的描叙不正确的是( )A、德国化学家维勒第一次人工合成了尿素,从而揭开了人工合成有机物的序幕 B、中国化学家侯德榜成功发明了侯氏制碱法,打破了外国当时对中国的相关技术封锁 C、英国科学家卢瑟福根据α粒子散射实验提出了“葡萄干面包式”原子结构模型 D、俄国化学家门捷列夫在前人基础上研究提出了元素周期律并列出了第一张元素周期表9. 下列说法正确的是( )A、用广泛pH试纸测得某溶液的pH为0 B、检验某溶液含有NH4+:取试样少许于试管中,加入足量NaOH溶液加热,用湿润红色石蕊试纸检验变蓝 C、液溴保存时液面覆盖一层水,装在带橡胶塞的细口试剂瓶中 D、配制一定物质的量浓度的NaOH溶液时,NaOH固体溶解后未恢复到室温就定容,所配制的溶液浓度偏小10. 下列说法中不正确的是( )A、O2与O3互为同素异形体 B、16O与18O核外电子排布不同 C、麦芽糖与蔗糖互为同分异构体 D、CH3CH3与
D、乙炔的最简式:C2H2
8. 下列关于著名科学家及其成就的描叙不正确的是( )A、德国化学家维勒第一次人工合成了尿素,从而揭开了人工合成有机物的序幕 B、中国化学家侯德榜成功发明了侯氏制碱法,打破了外国当时对中国的相关技术封锁 C、英国科学家卢瑟福根据α粒子散射实验提出了“葡萄干面包式”原子结构模型 D、俄国化学家门捷列夫在前人基础上研究提出了元素周期律并列出了第一张元素周期表9. 下列说法正确的是( )A、用广泛pH试纸测得某溶液的pH为0 B、检验某溶液含有NH4+:取试样少许于试管中,加入足量NaOH溶液加热,用湿润红色石蕊试纸检验变蓝 C、液溴保存时液面覆盖一层水,装在带橡胶塞的细口试剂瓶中 D、配制一定物质的量浓度的NaOH溶液时,NaOH固体溶解后未恢复到室温就定容,所配制的溶液浓度偏小10. 下列说法中不正确的是( )A、O2与O3互为同素异形体 B、16O与18O核外电子排布不同 C、麦芽糖与蔗糖互为同分异构体 D、CH3CH3与 互为同系物
11. (多选)下列说法正确的是( )A、我国“西气东输”中的“气”指的是石油气 B、废弃物在一定条件下发生化学反应,产生热值较高的可燃性气体,该过程属于生物化学转化 C、煤干馏的主要产物为焦炭、煤焦油、粗氨水和焦炉气 D、石油分馏是化学变化,可得到汽油、煤油等产品12. 反应物X转化为Y和Z的能量变化如图所示,下列说法正确的是( )
互为同系物
11. (多选)下列说法正确的是( )A、我国“西气东输”中的“气”指的是石油气 B、废弃物在一定条件下发生化学反应,产生热值较高的可燃性气体,该过程属于生物化学转化 C、煤干馏的主要产物为焦炭、煤焦油、粗氨水和焦炉气 D、石油分馏是化学变化,可得到汽油、煤油等产品12. 反应物X转化为Y和Z的能量变化如图所示,下列说法正确的是( ) A、由X→Y反应的△H=E5﹣E2 B、由X→Z反应的△H>0 C、由图可知等物质的量的Y的能量一定比X的能量高 D、升高温度可提高X→Z的反应速率13. 下列离子方程式不正确的是( )A、NaHCO3与NaOH溶液反应:HCO3﹣+OH﹣═CO32﹣+H2O B、氯气和水反应:Cl2+H2O⇌2H++Clˉ+ClOˉ C、氯化铁溶液中加入足量的氨水:Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+ D、盛放碱性试剂的溶液不能用玻璃塞的原因:SiO2+2OH﹣═SiO32﹣+H2O14. (多选)X,Y,Z,W四种短周期元素在元素周期表中的相对位置如图所示,这四种元素原子的最外层电子数为20.下列判断正确的是( )
A、由X→Y反应的△H=E5﹣E2 B、由X→Z反应的△H>0 C、由图可知等物质的量的Y的能量一定比X的能量高 D、升高温度可提高X→Z的反应速率13. 下列离子方程式不正确的是( )A、NaHCO3与NaOH溶液反应:HCO3﹣+OH﹣═CO32﹣+H2O B、氯气和水反应:Cl2+H2O⇌2H++Clˉ+ClOˉ C、氯化铁溶液中加入足量的氨水:Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+ D、盛放碱性试剂的溶液不能用玻璃塞的原因:SiO2+2OH﹣═SiO32﹣+H2O14. (多选)X,Y,Z,W四种短周期元素在元素周期表中的相对位置如图所示,这四种元素原子的最外层电子数为20.下列判断正确的是( )W
X
Y
Z
A、Z,X,Y形成的气态氢化物稳定性依次增强 B、四种元素形成的单质最多有6种 C、四种元素的原子半径:rZ>rY>rX>rW D、四种元素中,X的氧化物对应的水化物酸性最强15. 下列说法正确的是( )A、裂化可以提高汽油等轻质油的产量和质量 B、硬脂酸甘油酯皂化反应后得到的主要产品是硬脂酸和甘油 C、乙醇、乙酸、乙酸乙酯分子中均存在﹣OH D、向2 mL苯中加入1 mL碘的CCl4溶液,振荡后静置,上层呈紫红色16. 下列说法正确的是( )A、糖类在一定条件下可以水解生成乙醇和二氧化碳 B、检验淀粉在稀硫酸催化条件下水解产物的方法:取适量水解液于试管中,加入少量新制Cu(OH)2溶液,加热,观察是否出现砖红色沉淀 C、煤制煤气是物理变化,是高效、清洁地利用煤的重要途径 D、蛋白质在紫外线、CuSO4溶液、福尔马林作用下均会发生变性17. 某电池以K2FeO4和Zn为电极材料,KOH溶液为电解溶质溶液.下列说法正确的是( )A、电子由Zn电极流出,经KOH溶液流向正极 B、正极反应式为2FeO42﹣+10H++6e﹣=Fe2O3+5H2O C、该电池放电过程中电解质溶液浓度不变 D、电池工作时OH﹣向负极迁移18. 在2L的恒容容器中,充入1mol A和3mol B,并在一定条件下发生如下反应:A(s)+3B(g)⇌2C(g)
若经3s后测得C的浓度为0.6mol•L﹣1 , 下列选项说法正确的组合是( )
①用A表示的反应速率为0.1mol•L﹣1•s﹣1;
②用B表示的反应速率为0.4mol•L﹣1•s﹣1;
③3s时生成C的物质的量为1.2mol;
④3s时B的浓度为0.6mol•L﹣1 .
A、①②④ B、①③④ C、③④ D、②③④19. 在一定温度下,在体积为2L的恒容密闭容器中,某一反应中X,Y,Z三种气体的物质的量随时间变化的曲线如图所示,下列表述中正确的是( ) A、反应的化学方程式为2X=3Y+Z B、t时,正、逆反应都不再继续进行,反应达到化学平衡 C、若t=4,则0~t的X的化学反应速率为0.1 mol•L﹣1•min﹣1 D、温度、体积不变,t时刻充入1 mol He使压强增大,正、逆反应速率都增大20. 下列关于化学键及晶体的说法中,不正确的是( )A、Cl2、Br2、I2的沸点逐渐升高,是因为分子间作用力越来越大 B、NaOH和NH4Cl化学键类型相同 C、N2和CCl4两种分子中,每个原子的最外层都具有8电子稳定结构 D、石英晶体是原子晶体,其分子式为SiO221. 常温下,关于浓度相等的氢氧化钠和氨水,下列说法正确的是( )A、NH3•H2O溶液的c(OH﹣)>NaOH溶液的c(OH﹣) B、c(Na+)=c(NH4+) C、等体积的氢氧化钠和氨水溶液分别与足量盐酸完全反应,NaOH消耗的盐酸体积多 D、将pH值相等的氢氧化钠和氨水溶液加水稀释相同倍数,氨水溶液的pH大22. 设NA表示阿伏加德罗常数的值,下列说法正确的是( )A、100 g质量分数为98%的浓硫酸中所含有的氧原子数为4 NA B、足量的Fe与6.72 L Cl2反应转移的电子数为0.6 NA C、密闭容器中1 molN2与4 molH2反应生成的NH3分子数小于2NA D、3 g乙烷含有共用电子对为0.6 NA23. 向10.0mL 0.10mol•L﹣1氨水中滴入0.10mol•L﹣1的盐酸,溶液的pH与所加盐酸的体积关系如图所示(假设无气体逸出),下列有关叙述正确的是( )
A、反应的化学方程式为2X=3Y+Z B、t时,正、逆反应都不再继续进行,反应达到化学平衡 C、若t=4,则0~t的X的化学反应速率为0.1 mol•L﹣1•min﹣1 D、温度、体积不变,t时刻充入1 mol He使压强增大,正、逆反应速率都增大20. 下列关于化学键及晶体的说法中,不正确的是( )A、Cl2、Br2、I2的沸点逐渐升高,是因为分子间作用力越来越大 B、NaOH和NH4Cl化学键类型相同 C、N2和CCl4两种分子中,每个原子的最外层都具有8电子稳定结构 D、石英晶体是原子晶体,其分子式为SiO221. 常温下,关于浓度相等的氢氧化钠和氨水,下列说法正确的是( )A、NH3•H2O溶液的c(OH﹣)>NaOH溶液的c(OH﹣) B、c(Na+)=c(NH4+) C、等体积的氢氧化钠和氨水溶液分别与足量盐酸完全反应,NaOH消耗的盐酸体积多 D、将pH值相等的氢氧化钠和氨水溶液加水稀释相同倍数,氨水溶液的pH大22. 设NA表示阿伏加德罗常数的值,下列说法正确的是( )A、100 g质量分数为98%的浓硫酸中所含有的氧原子数为4 NA B、足量的Fe与6.72 L Cl2反应转移的电子数为0.6 NA C、密闭容器中1 molN2与4 molH2反应生成的NH3分子数小于2NA D、3 g乙烷含有共用电子对为0.6 NA23. 向10.0mL 0.10mol•L﹣1氨水中滴入0.10mol•L﹣1的盐酸,溶液的pH与所加盐酸的体积关系如图所示(假设无气体逸出),下列有关叙述正确的是( ) A、M﹣N间一定存在c(Cl﹣)>c(NH4+)>c(OH﹣)>c(H+) B、M点对应的盐酸体积为10.0mL C、pH=7溶液中有c(NH4+)=c(Cl﹣)=c(H+)=c(OH﹣) D、P点处的溶液中存在:2c(NH4+)+2c(NH3•H2O)=c(Cl﹣)24. 将0.01mol NaOH和0.01mol Na2CO3混合并配成溶液,滴加amL、0.1mol•L﹣1稀盐酸,下列说法不正确的是( )A、当a≤100时,发生的离子反应为:OH﹣+H+=H2O B、当a≥300时,发生的离子反应为:OH﹣+3H++CO32﹣=2H2O+CO2↑ C、当100<a<200时,反应后的溶液中CO32﹣与HCO3﹣的物质的量之比为(a×10﹣4﹣0.01):(0.02﹣a×10﹣4) D、当a=200时,发生的离子反应为:OH﹣+2H++CO32﹣=H2O+HCO3﹣25. 已知:SO32﹣+I2+H2O═SO42﹣+2I﹣+2H+ , 某无色溶液中可能含有Na+、NH4+、Cu2+、K+、I﹣、SO32﹣、SO42﹣ , 且所有离子物质的量浓度相等.向溶液中滴加少量氯水,溶液呈无色(不考虑盐类的水解及水的电离).下列关于该溶液的判断正确的是( )A、肯定不含I﹣ B、不能确定是否含有SO42﹣ C、至少含有Na+、NH4+、K+中的两种 D、可能含有Cu2+
A、M﹣N间一定存在c(Cl﹣)>c(NH4+)>c(OH﹣)>c(H+) B、M点对应的盐酸体积为10.0mL C、pH=7溶液中有c(NH4+)=c(Cl﹣)=c(H+)=c(OH﹣) D、P点处的溶液中存在:2c(NH4+)+2c(NH3•H2O)=c(Cl﹣)24. 将0.01mol NaOH和0.01mol Na2CO3混合并配成溶液,滴加amL、0.1mol•L﹣1稀盐酸,下列说法不正确的是( )A、当a≤100时,发生的离子反应为:OH﹣+H+=H2O B、当a≥300时,发生的离子反应为:OH﹣+3H++CO32﹣=2H2O+CO2↑ C、当100<a<200时,反应后的溶液中CO32﹣与HCO3﹣的物质的量之比为(a×10﹣4﹣0.01):(0.02﹣a×10﹣4) D、当a=200时,发生的离子反应为:OH﹣+2H++CO32﹣=H2O+HCO3﹣25. 已知:SO32﹣+I2+H2O═SO42﹣+2I﹣+2H+ , 某无色溶液中可能含有Na+、NH4+、Cu2+、K+、I﹣、SO32﹣、SO42﹣ , 且所有离子物质的量浓度相等.向溶液中滴加少量氯水,溶液呈无色(不考虑盐类的水解及水的电离).下列关于该溶液的判断正确的是( )A、肯定不含I﹣ B、不能确定是否含有SO42﹣ C、至少含有Na+、NH4+、K+中的两种 D、可能含有Cu2+二、非选择题
-
26. 已知有机物化合物A﹣F存在下列关系:
 (1)、写出C的结构简式 .(2)、反应①类型是 , 已知F的结构中无双键,则F的结构简式为 .(3)、写出B和乙酸发生酯化的化学方程式(4)、糖类、油脂、蛋白质均为人类重要的营养物质,下列说法正确的是:A、化合物A与银氨溶液混合后,水浴加热生成银镜,说明A中存在醛基 B、油脂是高级脂肪酸和甘油形成的酯类高分子化合物,氨基酸分子中都存在氨基和羧基两种官能团 C、将绿豆大小的钠块投入B中,钠块浮于液面上,并有大量气泡产生 D、乙酸乙酯制备实验中用饱和碳酸钠溶液收集产物,乙酸乙酯在下层.27. 取钠﹣镁合金7.0克进行如下实验:
(1)、写出C的结构简式 .(2)、反应①类型是 , 已知F的结构中无双键,则F的结构简式为 .(3)、写出B和乙酸发生酯化的化学方程式(4)、糖类、油脂、蛋白质均为人类重要的营养物质,下列说法正确的是:A、化合物A与银氨溶液混合后,水浴加热生成银镜,说明A中存在醛基 B、油脂是高级脂肪酸和甘油形成的酯类高分子化合物,氨基酸分子中都存在氨基和羧基两种官能团 C、将绿豆大小的钠块投入B中,钠块浮于液面上,并有大量气泡产生 D、乙酸乙酯制备实验中用饱和碳酸钠溶液收集产物,乙酸乙酯在下层.27. 取钠﹣镁合金7.0克进行如下实验: (1)、写出Mg在CO2中燃烧的化学方程式(2)、向溶液1中加过量的NaOH溶液,发生反应的离子方程式为(3)、写出合金的化学组成 .28. 在烧瓶放20克蔗糖,依次加入少量水、20mL浓硫酸,蔗糖逐渐变黑,体积膨胀,形成疏松多孔的黑面包,烧瓶发烫,品红溶液颜色变淡.请回答:
(1)、写出Mg在CO2中燃烧的化学方程式(2)、向溶液1中加过量的NaOH溶液,发生反应的离子方程式为(3)、写出合金的化学组成 .28. 在烧瓶放20克蔗糖,依次加入少量水、20mL浓硫酸,蔗糖逐渐变黑,体积膨胀,形成疏松多孔的黑面包,烧瓶发烫,品红溶液颜色变淡.请回答: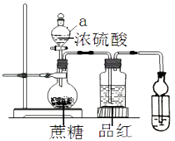 (1)、仪器a的名称(2)、小试管盛装试剂(3)、下列说法不正确的是A、蔗糖变黑说明发生过程 C12H22O11→C+H2O B、品红颜色变淡说明SO2有漂白性 C、上述实验体现浓硫酸的脱水性、吸水性和氧化性 D、将气体依次通过饱和碳酸氢钠溶液、澄清石灰水,石灰水变浑浊证明含有CO2 .29. 一定条件下,将一定体积的H2和Cl2的混合气体点燃,充分反应后,将混合气体通入含amol NaOH的热溶液中,气体恰好被完全吸收,NaOH无剩余,测得反应后溶液中含有Cl﹣、ClO﹣、ClO3﹣且三者物质的量之比为8:1:1,则:(1)、原混合气体中Cl2的物质的量为(用含a的数学式表示).(2)、氢气和氯气的物质的量之比为 .30.
(1)、仪器a的名称(2)、小试管盛装试剂(3)、下列说法不正确的是A、蔗糖变黑说明发生过程 C12H22O11→C+H2O B、品红颜色变淡说明SO2有漂白性 C、上述实验体现浓硫酸的脱水性、吸水性和氧化性 D、将气体依次通过饱和碳酸氢钠溶液、澄清石灰水,石灰水变浑浊证明含有CO2 .29. 一定条件下,将一定体积的H2和Cl2的混合气体点燃,充分反应后,将混合气体通入含amol NaOH的热溶液中,气体恰好被完全吸收,NaOH无剩余,测得反应后溶液中含有Cl﹣、ClO﹣、ClO3﹣且三者物质的量之比为8:1:1,则:(1)、原混合气体中Cl2的物质的量为(用含a的数学式表示).(2)、氢气和氯气的物质的量之比为 .30.二氧化碳的回收利用是环保领域研究热点.
 (1)、在太阳能的作用下,以CO2为原料制取炭黑的流程如图1所示.总反应的化学方程式为 .(2)、有一种用CO2生产甲醇燃料的方法:CO2+3H2⇌CH3OH+H2O.已知298K和101KPa条件下:
(1)、在太阳能的作用下,以CO2为原料制取炭黑的流程如图1所示.总反应的化学方程式为 .(2)、有一种用CO2生产甲醇燃料的方法:CO2+3H2⇌CH3OH+H2O.已知298K和101KPa条件下:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(l)△H=﹣a kJ•mol﹣1;
2H2(g)+O2(g)=2H2O(l)△H=﹣b kJ•mol﹣1;
CH3OH(g)=CH3OH(l)△H=﹣c kJ•mol﹣1 ,
则CH3OH(l)的标准燃烧热△H= .
(3)、CO2经过催化氢化合成低碳烯烃,合成乙烯反应为2CO2(g)+6H2(g)⇌CH2=CH2(g)+4H2O(g)△H<0在恒容密闭容器中充入2mol CO2和n mol H2 , 在一定条件下发生反应,CO2的转化率与温度、投料比X=[ ]的关系如图2所示.①平衡常数KAKB
②T K时,某密闭容器发生上述反应,反应进行到不同时间测得各物质的浓度如表:
时间(min)
浓度(mol•L﹣1)
0
10
20
30
40
50
H2(g)
6.00
5.40
5.10
9.00
8.40
8.40
CO2(g)
2.00
1.80
1.70
3.00
2.80
2.80
CH2=CH2(g)
0
0.10
0.15
3.20
3.30
3.30
20~30min间只改变了某一条件,根据上表中的数据判断改变的条件可能是
A.通入一定量H2 B.通入一定量CH2=CH2C.加入合适催化剂D.缩小容器体积
在图2中画出CH2=CH2的浓度随反应时间的变化
(4)、在催化剂M的作用下,CO2和H2同时发生下列两个反应A.2CO2(g)+6H2(g)⇌CH2=CH2(g)+4H2O(g)△H<0
B.2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g)△H<0
图3是乙烯在相同时间内,不同温度下的产率,则高于460℃时乙烯产率降低的原因不可能是
A、催化剂M的活性降低 B、A反应的平衡常数变大 C、生成甲醚的量增加 D、B反应的活化能增大(5)、Na2CO3溶液也通常用来捕获CO2 . 常温下,H2CO3的第一步、第二步电离常数分别约为Ka1=4×10﹣7 , Ka2=5×10﹣11 , 则0.5mol•L﹣1的Na2CO3溶液的pH等于(不考虑第二步水解和H2O的电离)31. 某废催化剂含58.2%的SiO2、21.0%的ZnO、4.50%的ZnS和12.8%的CuS及少量的Fe3O4 . 某同学用15.0g该废催化剂为原料,回收锌和铜.采用的实验方案如下,回答下列问题:
已知:ZnS与稀硫酸反应,且化合价不变; CuS既不溶解于稀硫酸,也不与稀硫酸反应
(1)、在下列装置中,第一次浸出反应装置最合理的(填标号). (2)、滤液1中含有Fe2+ , 选用提供的试剂进行检验,检验方法如下: .
(2)、滤液1中含有Fe2+ , 选用提供的试剂进行检验,检验方法如下: .(提供的试剂:稀盐酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水)
(3)、本实验要用到抽滤,设所用的洗涤剂为X,抽滤洗涤沉淀的操作 .(4)、写出第二次浸出的化学反应方程式 , 向盛有滤渣1的反应器中加H2SO4和H2O2溶液,应先加 .(5)、滤渣2的主要成分是 . 浓缩、结晶得到硫酸锌晶体的主要仪器名称是 .(6)、某同学在实验完成之后,得到1.50g CuSO4•5H2O,则铜的回收率为 .32. 已知:①R﹣OH R﹣O﹣R′② ③C的化学式为C15H13NO4 , ﹣Bn含苯环但不含甲基.
③C的化学式为C15H13NO4 , ﹣Bn含苯环但不含甲基. 盐酸卡布特罗是一种用于治疗支气管病的药物,其中间体的合成路线如图:
 (1)、写出结构简式:AW .(2)、指出反应类型:反应① , 反应⑤ .(3)、反应②的总化学方程式(﹣Bn用具体结构代入) .(4)、写出所有同时符合下列条件的同分异构体:
(1)、写出结构简式:AW .(2)、指出反应类型:反应① , 反应⑤ .(3)、反应②的总化学方程式(﹣Bn用具体结构代入) .(4)、写出所有同时符合下列条件的同分异构体:①与A属于同系物 ②1H的核磁共振谱图只有4个峰 ③分子中碳原子数目等于10
(5)、试利用上述合成路线的相关信息,由甲苯、(CH3)2NH等合成 (无机试剂任用)
(无机试剂任用)