2017年浙江省稽阳联考高考化学模拟试卷
试卷更新日期:2017-02-21 类型:高考模拟
一、选择题
-
1. 下列物质中属于盐的是( )A、MgO B、H2SO4 C、NaOH D、KNO32. 仪器名称为“蒸发皿”的是( )A、
 B、
B、 C、
C、 D、
D、 3. 下列物质属于电解质且能导电的是( )A、石墨 B、液态HCl C、葡萄糖 D、熔融的Na2CO34. Fe2O3+3CO 2Fe+3CO2的反应类型是( )A、化合反应 B、置换反应 C、氧化还原反应 D、复分解反应5. 下列物质的水溶液因水解而呈酸性的是( )A、HCl B、CH3COONa C、FeCl3 D、NaCl6. 化学知识在生产和生活中有着重要的应用.下列说法中不正确的是( )A、SiO2通常用于通讯行业 B、发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔;而碳酸钠可作医疗上治疗胃酸过多的一种药剂 C、明矾可用作净水剂 D、金属钠可用于冶炼钛等金属7. 下列表述正确的是( )A、硫离子的结构示意图:
3. 下列物质属于电解质且能导电的是( )A、石墨 B、液态HCl C、葡萄糖 D、熔融的Na2CO34. Fe2O3+3CO 2Fe+3CO2的反应类型是( )A、化合反应 B、置换反应 C、氧化还原反应 D、复分解反应5. 下列物质的水溶液因水解而呈酸性的是( )A、HCl B、CH3COONa C、FeCl3 D、NaCl6. 化学知识在生产和生活中有着重要的应用.下列说法中不正确的是( )A、SiO2通常用于通讯行业 B、发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔;而碳酸钠可作医疗上治疗胃酸过多的一种药剂 C、明矾可用作净水剂 D、金属钠可用于冶炼钛等金属7. 下列表述正确的是( )A、硫离子的结构示意图: B、乙烯的结构简式为CH2CH2
C、过氧化氢的电子式:
B、乙烯的结构简式为CH2CH2
C、过氧化氢的电子式:  D、H2O分子的比例模型
D、H2O分子的比例模型  8. 有关硫及其化合物说法正确的是( )A、有浓硫酸参与的反应都是氧化还原反应 B、硫在足量空气中燃烧生成大量SO3 C、SO2能使酸性高锰酸钾溶液褪色,体现了漂白性 D、二氧化硫可用于抑制酒类中细菌生长,可在葡萄酒中微量添加9. 下列说法正确的是( )A、在配制一定物质的量浓度溶液的实验中量筒是必需仪器 B、实验室中,盛装NaOH 溶液的试剂瓶用橡皮塞 C、某未知液中加入稀NaOH溶液,没有产生使湿润的红色石蕊试纸变蓝的气体,则该未知液中不含NH4+ D、用pH试纸测定某溶液的pH时,需预先用蒸馏水湿润pH 试纸10. 下列说法正确的是( )A、H2O与D2O互为同位素 B、纤维素与淀粉互为同分异构体 C、干冰和冰为同一种物质 D、甲烷和十六烷互为同系物11. 下列说法正确的是( )A、煤、石油、天然气均为化石燃料,它们属于可再生资源 B、大自然利用太阳能最成功的是植物的光合作用 C、石油的分馏、催化裂化、裂解等石油加工方法,其目的均为得到更多的汽油 D、化肥的大量使用不会造成环境污染12. 下列关于反应速率的说法中,不正确的是( )A、反应速率用于衡量化学反应进行的快慢 B、决定反应速率的主要因素有浓度、压强、温度和催化剂 C、可逆反应达到化学平衡时,正、逆反应的速率都不为0 D、增大反应物浓度、提高反应温度都能增大反应速率13. 实现下列转化的反应方程式中,正确的是( )A、H2SO3→H2SO4:2H2SO3+O2=2H2SO4 B、Fe→Fe3+:2Fe+6H+=2Fe3++3H2↑ C、Br﹣→Br2:2Br﹣+I2=Br2+2I﹣ D、Cu→CuSO4:Cu+2H2SO4(稀)=CuSO4+SO2↑+2H2O14. 如图为周期表中短周期的一部分,若X原子最外层电子数比次外层电子数少3,则下列说法不正确的是
8. 有关硫及其化合物说法正确的是( )A、有浓硫酸参与的反应都是氧化还原反应 B、硫在足量空气中燃烧生成大量SO3 C、SO2能使酸性高锰酸钾溶液褪色,体现了漂白性 D、二氧化硫可用于抑制酒类中细菌生长,可在葡萄酒中微量添加9. 下列说法正确的是( )A、在配制一定物质的量浓度溶液的实验中量筒是必需仪器 B、实验室中,盛装NaOH 溶液的试剂瓶用橡皮塞 C、某未知液中加入稀NaOH溶液,没有产生使湿润的红色石蕊试纸变蓝的气体,则该未知液中不含NH4+ D、用pH试纸测定某溶液的pH时,需预先用蒸馏水湿润pH 试纸10. 下列说法正确的是( )A、H2O与D2O互为同位素 B、纤维素与淀粉互为同分异构体 C、干冰和冰为同一种物质 D、甲烷和十六烷互为同系物11. 下列说法正确的是( )A、煤、石油、天然气均为化石燃料,它们属于可再生资源 B、大自然利用太阳能最成功的是植物的光合作用 C、石油的分馏、催化裂化、裂解等石油加工方法,其目的均为得到更多的汽油 D、化肥的大量使用不会造成环境污染12. 下列关于反应速率的说法中,不正确的是( )A、反应速率用于衡量化学反应进行的快慢 B、决定反应速率的主要因素有浓度、压强、温度和催化剂 C、可逆反应达到化学平衡时,正、逆反应的速率都不为0 D、增大反应物浓度、提高反应温度都能增大反应速率13. 实现下列转化的反应方程式中,正确的是( )A、H2SO3→H2SO4:2H2SO3+O2=2H2SO4 B、Fe→Fe3+:2Fe+6H+=2Fe3++3H2↑ C、Br﹣→Br2:2Br﹣+I2=Br2+2I﹣ D、Cu→CuSO4:Cu+2H2SO4(稀)=CuSO4+SO2↑+2H2O14. 如图为周期表中短周期的一部分,若X原子最外层电子数比次外层电子数少3,则下列说法不正确的是( )
R
X
Y
Z
A、元素X的最高价氧化物对应水化物的化学式为H3PO4 B、元素Y有两种常见的氧化物且都能与元素R的氢化物反应生成对应价态的酸 C、R,X,Y三者的气态氢化物稳定性依次增强 D、Z的单质能与Y的某些化合物发生置换反应15. 苯环结构中不存在碳碳双键,而是一种介于单键和双键之间的结构,下列不可以作为事实依据的是( )A、苯不能使酸性KMnO4溶液褪色 B、苯不能使溴水因发生化学反应而褪色 C、苯在加热和有催化剂存在条件下与H2反应生成环己烷 D、邻二氯苯只有一种结构16. 下列说法不正确的是( )A、乙烯在空气中燃烧时有黑烟,因此可以用燃烧法区别甲烷和乙烯 B、苯与浓硝酸在浓硫酸存在条件下加热发生取代反应 C、蛋白质溶液中加入饱和硫酸铵溶液,蛋白质发生变性 D、氨基酸能够以不同数目和顺序相结合形成结构复杂的多肽17. 某原电池装置如图所示,下列有关说法不正确的是( ) A、锌是该电池的负极 B、锌电极上发生氧化反应 C、铜电极的电极反应式为:2H++2e﹣=H2↑ D、若将电解质溶液换成AgNO3溶液,两电极的反应式均发生改变18. 一定条件下,反应4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)△H=﹣a kJ/mol,在5L密闭容器中进行,10s时,水蒸气的物质的量增加了0.60mol,则下列说法不正确的是( )A、10s内,NH3的平均反应速率为0.008mol•L﹣1•s﹣1 B、该反应达到平衡时6v(O2)正=5v(H2O)逆 C、10s内,反应放出的热量为0.1akJ D、10s时,H2O的反应速率为0.012mol•L﹣1•s﹣119. 反应 A+B→C(△H<0)分两步进行 ①A+B→X (△H>0)②X→C(△H<0)下列示意图中,能正确表示总反应过程中能量变化的是( )A、
A、锌是该电池的负极 B、锌电极上发生氧化反应 C、铜电极的电极反应式为:2H++2e﹣=H2↑ D、若将电解质溶液换成AgNO3溶液,两电极的反应式均发生改变18. 一定条件下,反应4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)△H=﹣a kJ/mol,在5L密闭容器中进行,10s时,水蒸气的物质的量增加了0.60mol,则下列说法不正确的是( )A、10s内,NH3的平均反应速率为0.008mol•L﹣1•s﹣1 B、该反应达到平衡时6v(O2)正=5v(H2O)逆 C、10s内,反应放出的热量为0.1akJ D、10s时,H2O的反应速率为0.012mol•L﹣1•s﹣119. 反应 A+B→C(△H<0)分两步进行 ①A+B→X (△H>0)②X→C(△H<0)下列示意图中,能正确表示总反应过程中能量变化的是( )A、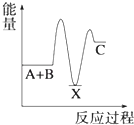 B、
B、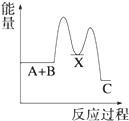 C、
C、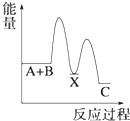 D、
D、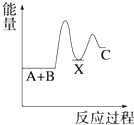 20. 下列说法正确的是( )A、碘单质的升华过程中,只需克服分子间作用力 B、NH4Cl属于离子化合物,该物质中只存在离子键 C、在N2、CO2和SiO2物质中,都存在共价键,它们都是由分子构成 D、金刚石和足球烯(C60)均为原子晶体21. 25℃时,甲、乙两烧杯分别盛有5mL pH=1的盐酸和硫酸,下列描述中不正确的是( )A、物质的量浓度:c甲=2c乙 B、水电离出的OH﹣浓度:c(OH﹣)甲=c(OH﹣)乙 C、若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:甲=乙 D、将甲、乙烧杯中溶液混合后(不考虑体积变化),所得溶液的pH>122. 用NA表示阿伏加德罗常数,下列说法正确的是( )A、1L 1mol/L的盐酸中含HCl分子的数目为NA B、1 mol Cl2与足量的铁反应转移的电子数是3 NA C、常温常压下,15g乙烷分子中含有的共价键键数目为3.5NA D、标准状况下,4.48 L重水(D2O)中含有的中子数为2NA23. 常温下向20mL0.1mol/LHA溶液中逐滴加入0.1mol/LNaOH溶液,其pH变化情况如图所示(忽略温度变化).下列说法中不正确的是( )
20. 下列说法正确的是( )A、碘单质的升华过程中,只需克服分子间作用力 B、NH4Cl属于离子化合物,该物质中只存在离子键 C、在N2、CO2和SiO2物质中,都存在共价键,它们都是由分子构成 D、金刚石和足球烯(C60)均为原子晶体21. 25℃时,甲、乙两烧杯分别盛有5mL pH=1的盐酸和硫酸,下列描述中不正确的是( )A、物质的量浓度:c甲=2c乙 B、水电离出的OH﹣浓度:c(OH﹣)甲=c(OH﹣)乙 C、若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:甲=乙 D、将甲、乙烧杯中溶液混合后(不考虑体积变化),所得溶液的pH>122. 用NA表示阿伏加德罗常数,下列说法正确的是( )A、1L 1mol/L的盐酸中含HCl分子的数目为NA B、1 mol Cl2与足量的铁反应转移的电子数是3 NA C、常温常压下,15g乙烷分子中含有的共价键键数目为3.5NA D、标准状况下,4.48 L重水(D2O)中含有的中子数为2NA23. 常温下向20mL0.1mol/LHA溶液中逐滴加入0.1mol/LNaOH溶液,其pH变化情况如图所示(忽略温度变化).下列说法中不正确的是( ) A、由题可知HA为弱酸 B、滴定终点位于c和d点之间 C、滴定到b点时:n(Na+)+n(H+)﹣n(OH﹣)+n(HA)=0.002mol D、滴定到d点时:c(OH﹣)>c(Na+)>c(A﹣)>c(H+)24. 已知还原性I﹣>Fe2+>I2 , 在水溶液中I2可被Cl2氧化为IO3﹣ , 向含溶质amol的FeI2溶液中通入bmol Cl2 , 充分反应(不考虑单质与水的反应).下列说法不正确的是( )A、当a=2b时,反应后的粒子浓度之比:c(Fe2+):c(I﹣):c(Cl﹣)=1:1:1 B、当3a=2b时,发生的离子反应:2Fe2++4I﹣+3Cl2═2Fe3++2I2+6Cl﹣ C、当13a=2b时,发生的离子反应:2Fe2++4I﹣+13Cl2+12H2O═4IO3﹣+26Cl﹣+2Fe3++24H+ D、若反应后溶液中I2与IO3﹣的物质的量为1:1,则反应中转移的电子3.5b mol25. 某溶液中可能含有下列6种离子中的某几种:Cl﹣、SO42﹣、HCO3﹣、Na+、K+、Mg2+ , 所含离子的浓度均相等.为了确认溶液的组成,进行如下实验:取200mL上述溶液,加入足量Ba(OH)2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.88g,向沉淀中加入过量的盐酸,有2.33g.关于原溶液组成的结论,不正确的是( )A、一定存在SO42﹣、HCO3﹣、Mg2+ , 至少存在Na+、K+中的一种 B、为了确定是否存在Cl﹣ , 可向溶液中加入硝酸酸化的硝酸银溶液 C、c(HCO3﹣)=0.05mol/L D、4.88g沉淀中含有3种成分
A、由题可知HA为弱酸 B、滴定终点位于c和d点之间 C、滴定到b点时:n(Na+)+n(H+)﹣n(OH﹣)+n(HA)=0.002mol D、滴定到d点时:c(OH﹣)>c(Na+)>c(A﹣)>c(H+)24. 已知还原性I﹣>Fe2+>I2 , 在水溶液中I2可被Cl2氧化为IO3﹣ , 向含溶质amol的FeI2溶液中通入bmol Cl2 , 充分反应(不考虑单质与水的反应).下列说法不正确的是( )A、当a=2b时,反应后的粒子浓度之比:c(Fe2+):c(I﹣):c(Cl﹣)=1:1:1 B、当3a=2b时,发生的离子反应:2Fe2++4I﹣+3Cl2═2Fe3++2I2+6Cl﹣ C、当13a=2b时,发生的离子反应:2Fe2++4I﹣+13Cl2+12H2O═4IO3﹣+26Cl﹣+2Fe3++24H+ D、若反应后溶液中I2与IO3﹣的物质的量为1:1,则反应中转移的电子3.5b mol25. 某溶液中可能含有下列6种离子中的某几种:Cl﹣、SO42﹣、HCO3﹣、Na+、K+、Mg2+ , 所含离子的浓度均相等.为了确认溶液的组成,进行如下实验:取200mL上述溶液,加入足量Ba(OH)2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.88g,向沉淀中加入过量的盐酸,有2.33g.关于原溶液组成的结论,不正确的是( )A、一定存在SO42﹣、HCO3﹣、Mg2+ , 至少存在Na+、K+中的一种 B、为了确定是否存在Cl﹣ , 可向溶液中加入硝酸酸化的硝酸银溶液 C、c(HCO3﹣)=0.05mol/L D、4.88g沉淀中含有3种成分二、非选择题
-
26. 甘蔗是我们生活中较为常见的经济作物.
 (1)、B的分子式是 .(2)、向试管中加入甘蔗渣经浓硫酸水解后的混合液,先加NaOH溶液,再加新制氢氧化铜,加热,可看到(现象).(3)、写出C→D的化学方程式 .27. 固体D是一种红色氧化物.
(1)、B的分子式是 .(2)、向试管中加入甘蔗渣经浓硫酸水解后的混合液,先加NaOH溶液,再加新制氢氧化铜,加热,可看到(现象).(3)、写出C→D的化学方程式 .27. 固体D是一种红色氧化物. (1)、混合气体A通入足量NaOH溶液后,溶液B中属于盐的溶质有 .(2)、白色沉淀C中加入盐酸的实验现象为 .(3)、固体D与HCl溶液反应的离子方程式为 .28. 为了探究实验富制氯气过程中反应物与生成氯气之间量的关系.设计了如图所示的装置
(1)、混合气体A通入足量NaOH溶液后,溶液B中属于盐的溶质有 .(2)、白色沉淀C中加入盐酸的实验现象为 .(3)、固体D与HCl溶液反应的离子方程式为 .28. 为了探究实验富制氯气过程中反应物与生成氯气之间量的关系.设计了如图所示的装置 (1)、装置A的名称是(2)、该实验装置检查气密性的方法是(3)、如果将过二氧化锰与20mL12mol/L的盐酸混合加热,充分反应后收集到的氯气少于0.06mol,其可能原因有
(1)、装置A的名称是(2)、该实验装置检查气密性的方法是(3)、如果将过二氧化锰与20mL12mol/L的盐酸混合加热,充分反应后收集到的氯气少于0.06mol,其可能原因有a.加热使浓盐酸放出大量HCl
b.盐酸变稀后不发生该反应
c.烧瓶中残留有氯气
d.装置B中液面高于A.
29. 取一定量碳酸钠和碳酸氢钠的固体混合物样品,分成两等份,对其中一份样品进行加热完全分解产生CO2 112mL,另一份样品溶于水,向所得溶液中逐滴加入150mL稀盐酸时产生CO2 112mL,过量时产生CO2 448L(气体体积均为标准状况)(1)、碳酸氢钠与碳酸钠的物质的量之比 .(2)、盐酸物质的量浓度为 . (保留2位有效数字)三、加试题:
-
30. 为迎接G20峰会的到来,浙江加大了对环境治理的力度.其中对含氮化物的处理是一个重要的课题.(1)、氮氧化物
(I)已知:N2(g)和O2(g)反应生成NO(g)过程中的能量变化情况如图1:

①2NO(g)⇌N2(g)+O2(g)△H=
②你认为该反应能否自发,并说明理由
(II)科学家利用2NO(g)⇌Na(g)+O2(g)来消除NO的污染.1molNO在恒温、容积恒定为1L的密闭容器中反应,10min后达到平衡,NO的物质的量为0.4mol.在第15min时,保持温度不变,将容器的体积迅速增大至2L并保持恒容,第25min时到达平衡;第30min时,保持温度和体积不变,向容器中再通入0.2molNO,第50min时达到平衡,请在图2中画出从第15min起到70minNO的物质的量随时间变化的曲线 .
 (2)、亚硝酸盐
(2)、亚硝酸盐(I)来源:用氧化性熔融盐处理钢铁表面氧化膜时会产生污染物亚硝酸盐,请写出FeO与NaNO3在加热条件下发生的反应 .
(II)电化学处理:用电解法降解NO2‑其原理如图3所示
电源正极为(填A或B),
阴极反应式为 .
 31. 以苯甲醛为原料,通过Cannizzaro反应来制备苯甲醇和苯甲酸,反应式为:
31. 以苯甲醛为原料,通过Cannizzaro反应来制备苯甲醇和苯甲酸,反应式为:主反应:

副反应:

主要物料的物理常数如表:
名称
分子量
性状
相对密度
(g•cm﹣3)
沸点
(℃)
溶解度
水
乙醚
苯甲醛
106
无色液体
1.04
179
微溶
易溶
苯甲酸
122
无色晶体
1.27
249
0.21g
66g
苯甲醇
108
无色液体
1.04
205
微溶
易溶
乙醚
74
无色液体.
0.71
35
不溶
﹣﹣
实验步骤:
 (1)、仪器A的作用是 .(2)、蒸馏操作时温度应该控制在左右.获得产品乙时进行的操作Ⅱ的名称是 .(3)、①上层溶液1中除乙醚外主要有机杂质是、 .
(1)、仪器A的作用是 .(2)、蒸馏操作时温度应该控制在左右.获得产品乙时进行的操作Ⅱ的名称是 .(3)、①上层溶液1中除乙醚外主要有机杂质是、 .洗涤时先后用到了饱和NaHSO3溶液、10%的NaHCO3溶液和水.
②洗涤操作在中进行.
a.烧杯 b.布氏漏斗 c.烧瓶 d.分液漏斗
③加入10%的NaHCO3溶液至(填现象)时说明杂质已被除尽.
(4)、若产品甲的质量为5.40g,则产品甲的产率是 .32. 有机物G是一种“β﹣兴奋剂”,其合成路线如下: 已知:
已知:  (1)、写出化合物E同时符合下列条件的所有同分异构体的结构简式
(1)、写出化合物E同时符合下列条件的所有同分异构体的结构简式①红外光谱显示含有三种官能团,其中无氧官能团与E相同,不含甲基
②1H﹣NMR谱显示分子中含有苯环,且苯环上只有一种不同化学环境的氢原子.
③苯环上只有4个取代基,能发生银镜反应
(2)、下列说法不正确的是A、化合物B生成C的反应为取代反应 B、1mol化合物D最多与4molH2发生加成反应 C、化合物D生成E的条件为浓氯水/铁屑 D、化合物G的分子式为C17H14Cl2NO3(3)、写出E+F→G的化学方程式(4)、根据题中信息,设计以苯和CH3COCl为原料制备F的合成路线(用流程图表示,其他无机试剂任选)