2017年江苏省南通市如皋市高考化学模拟试卷(一)
试卷更新日期:2017-02-21 类型:高考模拟
一、单项选择题
-
1. 下列有关环境问题的做法错误的是( )A、生活污水使用明矾杀菌消毒 B、向燃煤中加入适量石灰石“固硫” C、推广使用可降解塑料防止白色污染 D、提倡公交出行可减少氮氧化物排放2. 下列有关化学用语表示正确的是( )A、NH4Cl的电子式:
 B、对硝基甲苯:
B、对硝基甲苯:  C、碳酸的电离方程式:H2CO3⇌2H++CO
D、硫离子的结构示意图:
C、碳酸的电离方程式:H2CO3⇌2H++CO
D、硫离子的结构示意图:  3. 下列有关物质的性质与应用相对应的是( )A、碳酸钠溶液呈碱性,可用于洗去铁屑表面的油污 B、铝易发生钝化,可用于作飞机、火箭的结构材料 C、炭具有还原性,可用于冶炼钠、镁、铝等金属 D、浓硫酸具有强氧化性,可用于干燥二氧化硫气体4. 短周期主族元素X,Y,Z,W的原子序数依次增大.X原子最外层比次外层多3个电子;Y,Z均为金属,Y是同周期中原子半径最大的元素,Z的简单离子半径在同周期元素中最小;W的最高价氧化物在无机含氧酸中酸性最强.下列说法正确的是( )A、X的气态氢化物的热稳定性比O(氧)的强 B、元素Z,W的简单离子具有相同的电子层结构 C、Y,Z,W的最高价氧化物对应的水化物之间能相互反应 D、等质量的Y和Z单质分别与足量稀盐酸反应,前者产生的氢气多5. 下列指定反应的离子方程式正确的是( )A、用醋酸溶解大理石:CaCO3+2H+=Ca2++H2O+CO2↑ B、向氯化铝溶液中滴加过量氨水:Al3++4NH3•H2O=AlO +4NH+4+2H2O C、向碳酸氢钙溶液中加入少量烧碱溶液:Ca2++2HCO +2OH﹣=CaCO3↓+CO +H2O D、亚硫酸钠溶液中滴加酸性高锰酸钾溶液:5SO +6H++2MnO =5SO +2Mn2++3H2O6. 设NA为阿伏加德罗常数的值.下列说法正确的是( )A、标准状况下,11.2 L CCl4中含有的分子数为0.5NA B、在Na2O2与水的反应中,每生成1 mol O2 , 转移电子的数为2NA C、常温常压下,7.8 g苯中含有双键的数目为0.3NA D、25℃时,0.1 mol•L﹣1 NH4NO3溶液中含有的铵根离子数为0.1NA7. 常温下,下列各组离子在指定溶液中一定能大量共存的是( )A、pH=1的溶液中:K+、Fe2+、NO 、Cl﹣ B、0.1 mol•L﹣1NaHCO3溶液:Na+、Ba2+、NO 、OH﹣ C、滴加KSCN溶液显红色的溶液:NH 、K+、Cl﹣、I﹣ D、澄清透明的溶液中:Cu2+、K+、SO 、Cl﹣8. 用下列实验装置进行相应实验,能达到实验目的是( )A、
3. 下列有关物质的性质与应用相对应的是( )A、碳酸钠溶液呈碱性,可用于洗去铁屑表面的油污 B、铝易发生钝化,可用于作飞机、火箭的结构材料 C、炭具有还原性,可用于冶炼钠、镁、铝等金属 D、浓硫酸具有强氧化性,可用于干燥二氧化硫气体4. 短周期主族元素X,Y,Z,W的原子序数依次增大.X原子最外层比次外层多3个电子;Y,Z均为金属,Y是同周期中原子半径最大的元素,Z的简单离子半径在同周期元素中最小;W的最高价氧化物在无机含氧酸中酸性最强.下列说法正确的是( )A、X的气态氢化物的热稳定性比O(氧)的强 B、元素Z,W的简单离子具有相同的电子层结构 C、Y,Z,W的最高价氧化物对应的水化物之间能相互反应 D、等质量的Y和Z单质分别与足量稀盐酸反应,前者产生的氢气多5. 下列指定反应的离子方程式正确的是( )A、用醋酸溶解大理石:CaCO3+2H+=Ca2++H2O+CO2↑ B、向氯化铝溶液中滴加过量氨水:Al3++4NH3•H2O=AlO +4NH+4+2H2O C、向碳酸氢钙溶液中加入少量烧碱溶液:Ca2++2HCO +2OH﹣=CaCO3↓+CO +H2O D、亚硫酸钠溶液中滴加酸性高锰酸钾溶液:5SO +6H++2MnO =5SO +2Mn2++3H2O6. 设NA为阿伏加德罗常数的值.下列说法正确的是( )A、标准状况下,11.2 L CCl4中含有的分子数为0.5NA B、在Na2O2与水的反应中,每生成1 mol O2 , 转移电子的数为2NA C、常温常压下,7.8 g苯中含有双键的数目为0.3NA D、25℃时,0.1 mol•L﹣1 NH4NO3溶液中含有的铵根离子数为0.1NA7. 常温下,下列各组离子在指定溶液中一定能大量共存的是( )A、pH=1的溶液中:K+、Fe2+、NO 、Cl﹣ B、0.1 mol•L﹣1NaHCO3溶液:Na+、Ba2+、NO 、OH﹣ C、滴加KSCN溶液显红色的溶液:NH 、K+、Cl﹣、I﹣ D、澄清透明的溶液中:Cu2+、K+、SO 、Cl﹣8. 用下列实验装置进行相应实验,能达到实验目的是( )A、 用如图所示装置验证反应产物二氧化碳
B、
用如图所示装置验证反应产物二氧化碳
B、 用如图装置吸收氨气并防止倒吸
C、
用如图装置吸收氨气并防止倒吸
C、 如图装置配制100 mL 1 mol•L﹣1的硫酸
D、
如图装置配制100 mL 1 mol•L﹣1的硫酸
D、 用如图装置除去氯气中的氯化氢
9. 下列物质的转化在给定条件下能实现的是( )A、Fe Fe2O3 Fe2(SO4)3 B、MgO MgSO4(aq) Mg C、饱和NaCl(aq) NaHCO3 Na2CO3 D、NH3 NO HNO310. 通过乙醇制取氢气通常有如下两条途径:
用如图装置除去氯气中的氯化氢
9. 下列物质的转化在给定条件下能实现的是( )A、Fe Fe2O3 Fe2(SO4)3 B、MgO MgSO4(aq) Mg C、饱和NaCl(aq) NaHCO3 Na2CO3 D、NH3 NO HNO310. 通过乙醇制取氢气通常有如下两条途径:a.CH3CH2OH(g)+H2O(g)=4H2(g)+2CO(g)△H1=+256.6kJ•mol﹣1
b.2CH3CH2OH(g)+O2(g)=6H2(g)+4CO(g)△H2=+27.6kJ•mol﹣1
则下列说法正确的是( )
A、升高a的反应温度,乙醇的转化率增大 B、由b可知:乙醇的燃烧热为13.8 kJ•mol﹣1 C、2H2(g)+O2(g)=2H2O(g)△H=+485.6 kJ•mol﹣1 D、制取等量的氢气,途径b消耗的能量更多二、不定项选择题
-
11. 下列有关说法正确的是( )A、加入硫酸铜可使锌与稀硫酸的反应速率加快,说明Cu2+具有催化作用 B、向某溶液中滴加硝酸酸化的BaCl2溶液产生白色沉淀,则该溶液中含有SO42﹣ C、在电解精炼铜过程中,阳极质量的减少多于阴极质量的增加 D、298 K时,2H2S(g)+SO2(g)=3S(s)+2H2O(l)能自发进行,则其△H<012. 2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏如皋落户.用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示.下列说法正确的是( )
 A、放电时,甲电极为正极,OH﹣移向乙电极 B、放电时,乙电极反应为:NiO(OH)+H2O+e﹣=Ni(OH)2+OH﹣ C、充电时,电池的碳电极与直流电源的正极相连 D、电池总反应为H2+2NiOOH 2Ni(OH)213. 根据下列实验操作和现象所得到的结论正确的是( )A、向NaAlO2溶液中通入足量CO2 , 有白色沉淀产生,说明碳酸的酸性强于氢氧化铝 B、用铂丝蘸取某溶液进行焰色反应,火焰呈黄色,说明溶液中不含有K+ C、在KI淀粉溶液中滴入氯水变蓝,再通入SO2 , 蓝色褪去,说明SO2具有漂白性 D、向某FeCl2溶液中,加入Na2O2粉末出现红褐色沉淀,说明原FeCl2已氧化变质14. 如图图示与对应的叙述相符的是( )
A、放电时,甲电极为正极,OH﹣移向乙电极 B、放电时,乙电极反应为:NiO(OH)+H2O+e﹣=Ni(OH)2+OH﹣ C、充电时,电池的碳电极与直流电源的正极相连 D、电池总反应为H2+2NiOOH 2Ni(OH)213. 根据下列实验操作和现象所得到的结论正确的是( )A、向NaAlO2溶液中通入足量CO2 , 有白色沉淀产生,说明碳酸的酸性强于氢氧化铝 B、用铂丝蘸取某溶液进行焰色反应,火焰呈黄色,说明溶液中不含有K+ C、在KI淀粉溶液中滴入氯水变蓝,再通入SO2 , 蓝色褪去,说明SO2具有漂白性 D、向某FeCl2溶液中,加入Na2O2粉末出现红褐色沉淀,说明原FeCl2已氧化变质14. 如图图示与对应的叙述相符的是( ) A、图1表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 B、图2表示A,B两物质的溶解度随温度变化情况,将t1℃时A,B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A C、图3表示镁条放入盐酸中生成氢气速率随时间的变化,起初反应速率加快的原因可能是该反应为放热反应 D、图4表示在含等物质的量NaOH,Na2CO3的混合溶液中滴加0.1 mol•L﹣1盐酸至过量时,产生气体的体积与消耗盐酸的关系15. 硫酸钙可用于生产硫酸、漂白粉等一系列物质(见图).下列说法正确的是( )
A、图1表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 B、图2表示A,B两物质的溶解度随温度变化情况,将t1℃时A,B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A C、图3表示镁条放入盐酸中生成氢气速率随时间的变化,起初反应速率加快的原因可能是该反应为放热反应 D、图4表示在含等物质的量NaOH,Na2CO3的混合溶液中滴加0.1 mol•L﹣1盐酸至过量时,产生气体的体积与消耗盐酸的关系15. 硫酸钙可用于生产硫酸、漂白粉等一系列物质(见图).下列说法正确的是( ) A、CO2制取干冰的过程吸收热量,属于物理变化 B、硫酸钙与焦炭反应时生成的n(CO2):n(SO2)=1:2 C、由SO2制取H2SO4的过程均为氧化还原反应 D、石灰乳与Cl2反应制取漂白粉时,Cl2仅作还原剂
A、CO2制取干冰的过程吸收热量,属于物理变化 B、硫酸钙与焦炭反应时生成的n(CO2):n(SO2)=1:2 C、由SO2制取H2SO4的过程均为氧化还原反应 D、石灰乳与Cl2反应制取漂白粉时,Cl2仅作还原剂三、非选择题
-
16. 氧化还原反应在生产生活中有着重要的应用.请按要求写出相应的方程式.(1)、将含SO2的废气通入含Fe2+(催化剂)的溶液中,常温下可使SO2转化为SO24﹣ , 其总反应为2SO2+O2+2H2O=2H2SO4 . 上述总反应分两步进行,第一步反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,写出第二步反应的离子方程式: .(2)、pH=3.6时,碳酸钙与硫酸铝反应可制备碱式硫酸铝[Al2(SO4)x(OH)6﹣2x]溶液.若溶液的pH偏高,则碱式硫酸铝产率降低且有气泡产生,用化学方程式表示其原因: .(3)、ClO2是一种高效安全的杀菌消毒剂.氯化钠电解法生产ClO2工艺原理示意图如下:

①写出氯化钠电解槽内发生反应的离子方程式: .
②写出ClO2发生器中的化学方程式,并标出电子转移的方向及数目: .
③ClO2能将电镀废水中的CN﹣离子氧化成两种无毒气体,自身被还原成Cl﹣ . 写出该反应的离子方程式 .
17. 某化工厂用软锰矿(含MnO2及少量Al2O3)和闪锌矿(含ZnS及少量FeS)联合生产Zn、MnO2 , 其部分生产流程如下:
已知:过滤(Ⅱ)所得滤液是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液.相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L﹣1计算)如下表:
沉淀物
Fe(OH)3
Al(OH)3
Zn(OH)2
Mn(OH)2
开始沉淀时的pH
2.7
4.0
6.4
7.7
完全沉淀时的pH
3.7
5.2
8.0
10.4
(1)、加热、浸取时所加矿石均需粉碎,其目的是 .(2)、写出FeS和MnO2和稀硫酸反应的离子方程式: .(3)、试剂X的作用是调节溶液的pH以生成Fe(OH)3、Al(OH)3 . pH调节的范围是 , 试剂X可以选用(填选项字母).A.MnCO3 B.Na2CO3 C.Zn2(OH)2CO3 D.NH3•H2O
(4)、电解(Ⅴ)中阳极的电极反应式为 .(5)、Zn和MnO2是制作电池的原料.某锌﹣锰碱性电池以KOH溶液为电解质溶液,其电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s).该电池的正极的电极反应式为 .18. FeCO3与砂糖混用可作补血剂.以黄铁矿烧渣(含CuO、Fe2O3、FeO、SiO2、Al2O3等)为主要原料制备FeCO3的流程如下: (1)、质量分数为30%(密度是1.176g•cm﹣3)的稀硫酸的物质的量浓度为 .(2)、检验滤液A中存在Fe2+的试剂是 .(3)、加入足量铁粉的作用除调节pH使Al3+转化为Al(OH)3沉淀外,还有两个作用,写出其中一个反应的离子方程式:(4)、写出滤液C与NH4HCO3溶液反应的离子方程式: .(5)、FeCO3在空气中灼烧可制得铁系氧化物材料.已知25℃,101kPa时:
(1)、质量分数为30%(密度是1.176g•cm﹣3)的稀硫酸的物质的量浓度为 .(2)、检验滤液A中存在Fe2+的试剂是 .(3)、加入足量铁粉的作用除调节pH使Al3+转化为Al(OH)3沉淀外,还有两个作用,写出其中一个反应的离子方程式:(4)、写出滤液C与NH4HCO3溶液反应的离子方程式: .(5)、FeCO3在空气中灼烧可制得铁系氧化物材料.已知25℃,101kPa时:4Fe(s)+3O2(g)═2Fe2O3△H=﹣1648kJ•mol﹣1
C(s)+O2(g)═CO2(g)△H=﹣393kJ•mol﹣1
2Fe(s)+2C(s)+3O2(g)═2FeCO3(s)△H=﹣1480kJ•mol﹣1
写出FeCO3在空气中灼烧生成Fe2O3的热化学方程式: .
(6)、某兴趣小组为充分利用副产品,欲利用滤渣D为原料制取Al2O3 , 请补充完成实验步骤:向滤渣D中加入适量NaOH溶液,19. 多巴胺是一种重要的中枢神经传导物质.用香兰素与硝基甲烷等为原料合成多巴胺的路线如下. (1)、下列说法正确的是 .A、可用银镜反应鉴别香兰素和多巴胺 B、1mol香兰素与溴水发生取代反应时,最多消耗3mol Br2 C、有机物B分子中不含手性碳原子 D、多巴胺分子中最多有7个碳原子共平面(2)、有机物C中的含氧官能团的名称为 .(3)、反应①、②的反应类型分别为 .(4)、写出同时满足下列条件的A的一种同分异构体的结构简式 .
(1)、下列说法正确的是 .A、可用银镜反应鉴别香兰素和多巴胺 B、1mol香兰素与溴水发生取代反应时,最多消耗3mol Br2 C、有机物B分子中不含手性碳原子 D、多巴胺分子中最多有7个碳原子共平面(2)、有机物C中的含氧官能团的名称为 .(3)、反应①、②的反应类型分别为 .(4)、写出同时满足下列条件的A的一种同分异构体的结构简式 .①具有α﹣氨基酸的共同结构片段;
②能与FeCl3溶液发生显色反应;
③由6种不同化学环境的氢原子.
20. 黄钠铁矾[NaaFeb(SO4)c(OH)d]具有沉淀颗粒大、沉淀速率快、容易过滤等特点.某研究小组先将某废水中Fe2+氧化为Fe3+ , 再加入Na2SO4使其生成黄钠铁矾而除去铁.为测定黄钠铁矾的组成,该小组进行了如下实验:①称取12.125g样品,加盐酸完全溶解后,配成250.00mL溶液A.
②量取25.00mL溶液A,加入足量的KI,再用0.2500mol•L﹣1Na2S2O3溶液滴定生成的I2(反应原理为I2+2Na2S2O3=2NaI+Na2S4O6),消耗30.00mL Na2S2O3溶液至终点.
③另取50.00mL溶液A,加入足量BaCl2溶液充分反应后,过滤,将所得沉淀洗涤、干燥后,称得其质量为2.330g.
(1)、NaaFeb(SO4)c(OH)d中a、b、c、d之间的代数关系式为 .(2)、通过计算确定黄钠铁矾的化学式(写出计算过程).21. 将不可再生的天然气、石油、煤等化石燃料转化利用、变废为宝已成为当务之急.(1)、根据键能数据估算CH4+4F2=CF4+4HF的反应热△H= .化学键
C﹣H
C﹣F
H﹣F
F﹣F
键能/(kJ•mol﹣1)
414
489
565
155
(2)、甲醇、二甲醚(CH3OCH3)被称为21世纪的新型燃料,均可利用CO和H2反应合成.①某燃料电池以二甲醚为原料,熔融碳酸盐为电解质,其负极反应如下:CH3OCH3+6CO ﹣12e﹣=8CO2+3H2O.写出该燃料电池的正极反应式: .
②废水中含甲醇对水质会造成污染,Co3+可将甲醇氧化为CO2 . 某同学以Pt作电极电解酸性含甲醇废水与CoSO4混合液模拟工业除污原理,其阳极反应式为 .
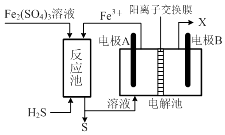
(3)、某企业采用如图所示原理处理化石燃料开采、加工过程产生的H2S废气.①电解池中电极A、B均为惰性电极,其中A为电解池的极;电极B所得到的物质X的分子式为 .
②反应池中发生的离子反应方程式为 .
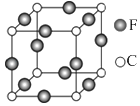
 22. A、B、C、D、E、F六种元素均位于周期表的前四周期,且原子序数依次增大.元素A是原子半径最小的元素;B元素基态原子的核外电子分占四个原子轨道(能级);D元素原子的已成对电子总数是未成对电子总数的3倍;E与D处于同一主族;F位于ds区,且原子的最外层只有1个电子.(1)、F+离子的电子排布式是 .(2)、B、C、D元素的第一电离能由大到小的顺序是 .(3)、B、C元素的某些氢化物的分子中均含有18个电子,则B的这种氢化物的化学式是;B、C的这些氢化物的沸点相差较大的主要原因是 .(4)、A、B、D可形成分子式为A2BD的某化合物,则该化合物分子中B原子的轨道杂化类型是;1mol该分子中含有π键的数目是 .(5)、C、F两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是 , C原子的配位数是 .
22. A、B、C、D、E、F六种元素均位于周期表的前四周期,且原子序数依次增大.元素A是原子半径最小的元素;B元素基态原子的核外电子分占四个原子轨道(能级);D元素原子的已成对电子总数是未成对电子总数的3倍;E与D处于同一主族;F位于ds区,且原子的最外层只有1个电子.(1)、F+离子的电子排布式是 .(2)、B、C、D元素的第一电离能由大到小的顺序是 .(3)、B、C元素的某些氢化物的分子中均含有18个电子,则B的这种氢化物的化学式是;B、C的这些氢化物的沸点相差较大的主要原因是 .(4)、A、B、D可形成分子式为A2BD的某化合物,则该化合物分子中B原子的轨道杂化类型是;1mol该分子中含有π键的数目是 .(5)、C、F两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是 , C原子的配位数是 .