2016年江苏省徐州市铜山区高考化学模拟试卷(5月份)
试卷更新日期:2017-02-20 类型:高考模拟
一、选择题
-
1. 化学与环境、材料、信息、能源关系密切,下列说法错误的是( )A、半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 B、将“地沟油”制成肥皂,可以提高资源的利用率 C、我国首艘航母“辽宁舰”上用于舰载机降落的拦阻索是特种钢缆,属于金属材料 D、推广以植物秸秆为原料的综合利用技术,避免焚烧秸秆造成空气污染2. 下列化学用语表述正确的是( )A、过氧化氢电子式:
 B、F﹣的结构示意图:
B、F﹣的结构示意图:  C、邻羟基苯甲酸的结构简式:
C、邻羟基苯甲酸的结构简式:  D、中子数为28的钙原子: Ca
3. 下列说法正确的是( )
D、中子数为28的钙原子: Ca
3. 下列说法正确的是( ) A、分子式为C2H4O的有机化合物性质相同 B、氯水和二氧化硫都具有漂白作用,两者漂白原理不相同 C、某反应过程中的能量变化如图所示,可见催化剂能改变该反应的焓变 D、等质量的铜粉按a、b两种途径完全转化,途径a和途径b消耗的H2SO4相等途径a:Cu CuO CuSO4;途径b:Cu CuSO44. 下列有关物质性质的叙述正确的是( )A、液氨汽化时要吸收大量的热,可用作制冷剂 B、次氯酸钠具有碱性,可用于配制“84”消毒液 C、Al2O3具有很高的熔点,可用于制造熔融烧碱的坩埚 D、SiO2既能溶于NaOH溶液又能溶于HF溶液,说明SiO2是两性氧化物5. 短周期主族元素X,Y,Z,M,N的原子序数依次增大.X和M的原子核外均有两个未成对电子,但不处于同一主族.Y,Z,M最高价氧化物对应的水化物两两之间能相互反应.下列叙述正确的是( )A、原子半径:r(Z)>r(Y)>r(M) B、Y和M形成的化合物只含有离子键 C、元素非金属性由弱到强的顺序:M,N,X D、电解N和Z形成的化合物可得到Z的单质6. 在下列溶液中,各组离子一定能够大量共存的是( )A、能使广泛pH试纸显红色的溶液:K+、Ba2+、Cl﹣、Br﹣ B、含有大量Al3+的溶液:Na+、Cl﹣、HCO3﹣、SO42﹣ C、能使淀粉碘化钾试纸显蓝色的溶液:K+、SO42﹣、S2﹣、SO32﹣ D、常温下 =1012的溶液:Fe2+、Mg2+、NO3﹣、Cl﹣7. 下列有关实验装置进行的相应实验,能达到实验目的是( )A、
A、分子式为C2H4O的有机化合物性质相同 B、氯水和二氧化硫都具有漂白作用,两者漂白原理不相同 C、某反应过程中的能量变化如图所示,可见催化剂能改变该反应的焓变 D、等质量的铜粉按a、b两种途径完全转化,途径a和途径b消耗的H2SO4相等途径a:Cu CuO CuSO4;途径b:Cu CuSO44. 下列有关物质性质的叙述正确的是( )A、液氨汽化时要吸收大量的热,可用作制冷剂 B、次氯酸钠具有碱性,可用于配制“84”消毒液 C、Al2O3具有很高的熔点,可用于制造熔融烧碱的坩埚 D、SiO2既能溶于NaOH溶液又能溶于HF溶液,说明SiO2是两性氧化物5. 短周期主族元素X,Y,Z,M,N的原子序数依次增大.X和M的原子核外均有两个未成对电子,但不处于同一主族.Y,Z,M最高价氧化物对应的水化物两两之间能相互反应.下列叙述正确的是( )A、原子半径:r(Z)>r(Y)>r(M) B、Y和M形成的化合物只含有离子键 C、元素非金属性由弱到强的顺序:M,N,X D、电解N和Z形成的化合物可得到Z的单质6. 在下列溶液中,各组离子一定能够大量共存的是( )A、能使广泛pH试纸显红色的溶液:K+、Ba2+、Cl﹣、Br﹣ B、含有大量Al3+的溶液:Na+、Cl﹣、HCO3﹣、SO42﹣ C、能使淀粉碘化钾试纸显蓝色的溶液:K+、SO42﹣、S2﹣、SO32﹣ D、常温下 =1012的溶液:Fe2+、Mg2+、NO3﹣、Cl﹣7. 下列有关实验装置进行的相应实验,能达到实验目的是( )A、 用图所示装置除去乙烯中少量SO2气体
B、
用图所示装置除去乙烯中少量SO2气体
B、 用图装置量取20.00 mL 0.10 mol•L﹣1硫酸
C、
用图装置量取20.00 mL 0.10 mol•L﹣1硫酸
C、 用图所示装置可分离CH3COOC2H5和饱和碳酸钠溶液
D、
用图所示装置可分离CH3COOC2H5和饱和碳酸钠溶液
D、 用图装置制备Fe(OH)2并能较长时间观察其颜色
8. 利用自然资源制备相关化学物质,下列化工生产不可行的是( )A、FeS2 SO2 H2SO3 H2SO4 B、石英砂 粗硅 粗SiCl4 高纯硅 C、提取食盐后的母液 含Br2的液体 粗Br2 Br2 D、铝土矿 NaAlO2(aq) Al(OH)3 Al2O3 Al9. 下列反应的离子方程式书写正确的是( )A、铜溶于0.5 mol•L﹣1的硝酸中:Cu+4H++2NO3﹣═Cu2++2NO2↑+2H2O B、工业上将Cl2通入石灰乳中制漂白粉:Cl2+2OH﹣═Cl﹣+ClO﹣+H2O C、向NH4HSO4溶液中滴加少量Ba(OH)2的溶液:Ba2++2OH﹣+2H++SO42﹣═BaSO4↓+2H2O D、H2C2O4(弱酸)溶液中加入酸性KMnO4溶液:2MnO42﹣+5H2C2O4=2Mn2++10CO2↑+2H2O+6OH﹣10. 最近中美研究人员发明了一种可快速充放电的铝离子电池,该电池电解质为离子液体{AlCl3/[EMIM]Cl},放电时有关离子转化如图所示.下列说法正确的是( )
用图装置制备Fe(OH)2并能较长时间观察其颜色
8. 利用自然资源制备相关化学物质,下列化工生产不可行的是( )A、FeS2 SO2 H2SO3 H2SO4 B、石英砂 粗硅 粗SiCl4 高纯硅 C、提取食盐后的母液 含Br2的液体 粗Br2 Br2 D、铝土矿 NaAlO2(aq) Al(OH)3 Al2O3 Al9. 下列反应的离子方程式书写正确的是( )A、铜溶于0.5 mol•L﹣1的硝酸中:Cu+4H++2NO3﹣═Cu2++2NO2↑+2H2O B、工业上将Cl2通入石灰乳中制漂白粉:Cl2+2OH﹣═Cl﹣+ClO﹣+H2O C、向NH4HSO4溶液中滴加少量Ba(OH)2的溶液:Ba2++2OH﹣+2H++SO42﹣═BaSO4↓+2H2O D、H2C2O4(弱酸)溶液中加入酸性KMnO4溶液:2MnO42﹣+5H2C2O4=2Mn2++10CO2↑+2H2O+6OH﹣10. 最近中美研究人员发明了一种可快速充放电的铝离子电池,该电池电解质为离子液体{AlCl3/[EMIM]Cl},放电时有关离子转化如图所示.下列说法正确的是( ) A、放电时,负极发生:2AlCl4﹣﹣e﹣=Al2Cl3﹣+Cl﹣ B、充电时,泡沫石墨极与外电源的负极相连 C、放电时,电路中每流过3mol电子,正极减少27g D、充电时,阴极发生:4Al2Cl3﹣+3e﹣=Al+7AlCl4﹣
A、放电时,负极发生:2AlCl4﹣﹣e﹣=Al2Cl3﹣+Cl﹣ B、充电时,泡沫石墨极与外电源的负极相连 C、放电时,电路中每流过3mol电子,正极减少27g D、充电时,阴极发生:4Al2Cl3﹣+3e﹣=Al+7AlCl4﹣二、不定项选择题
-
11. 下列说法正确的是( )A、外加直流电源保护钢闸门时,钢闸门与电源的负极相连 B、铅蓄电池在放电过程中,负极质量增加,正极质量减少 C、锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去 D、t℃时,恒容密闭容器中反应:NO2(g)+SO2(g)⇌NO(g)+SO3(g),通入少量O2 , K值及SO2转化率不变12. 某有机化合物结构简式如图,下列有关它的性质的叙述中,正确的是( )
 A、有弱酸性,与Na2CO3、NaHCO3溶液均能反应 B、在一定条件下,1 mol该物质最多能与3 mol NaOH完全反应 C、在一定条件下,该物质可以发生取代、加成、水解、消去反应 D、该有机物分子中所有碳原子可能共平面13. 下列化学实验事实及其解释或结论都正确的是( )A、测定同温度下相同浓度的Na2CO3和Na2SO3溶液的pH,前者大于后者,说明碳元素非金属性弱于硫元素 B、向1 mL 1%的NaOH溶液中加入2 mL 2%的CuSO4溶液,振荡后再加入0.5 mL有机物X,加热后未出现砖红色沉淀,说明X中不含有醛基 C、往苯酚的浊液中加入Na2CO3溶液,溶液变澄清,说明酸性:苯酚>HCO3﹣ D、向浓度均为0.1 mol•L﹣1的MgCl2、CuCl2混合溶液中逐滴加入氨水,首先生成蓝色沉淀,说明Ksp[Cu(OH)2]>Ksp[Mg(OH)2]14. 25℃时,下列溶液中粒子的物质的量浓度关系正确的是( )A、向浓度为0.1mol•L﹣1的NaHCO3溶液中滴加少量盐酸后所得溶液中:c(Na+)=c(CO32﹣)+c(HCO3﹣)+c(H2CO3) B、pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合所得溶液中:c(CH3COO﹣)+c(H+)>c(Na+)+c(OH﹣) C、0.1 mol•L﹣1CH3COOH溶液和0.1 mol•L﹣1CH3COONa溶液等体积混合:c(Na+)>c(CH3COOH)>c(CH3COO﹣)>c(H+)>c(OH﹣) D、0.1 mol•L﹣1 NH4HSO4溶液中滴加0.1 mol•L﹣1 NaOH溶液至中性:c(Na+)>c(SO42﹣)>c(NH4+)>c(OH﹣)=c(H+)15. 在体积为2L的恒容密闭容器中发生反应xA(g)+yB(g)⇌zC(g),图1表示200℃时容器中A,B,C物质的量随时间的变化关系,图2表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系.则下列结论正确的是( )
A、有弱酸性,与Na2CO3、NaHCO3溶液均能反应 B、在一定条件下,1 mol该物质最多能与3 mol NaOH完全反应 C、在一定条件下,该物质可以发生取代、加成、水解、消去反应 D、该有机物分子中所有碳原子可能共平面13. 下列化学实验事实及其解释或结论都正确的是( )A、测定同温度下相同浓度的Na2CO3和Na2SO3溶液的pH,前者大于后者,说明碳元素非金属性弱于硫元素 B、向1 mL 1%的NaOH溶液中加入2 mL 2%的CuSO4溶液,振荡后再加入0.5 mL有机物X,加热后未出现砖红色沉淀,说明X中不含有醛基 C、往苯酚的浊液中加入Na2CO3溶液,溶液变澄清,说明酸性:苯酚>HCO3﹣ D、向浓度均为0.1 mol•L﹣1的MgCl2、CuCl2混合溶液中逐滴加入氨水,首先生成蓝色沉淀,说明Ksp[Cu(OH)2]>Ksp[Mg(OH)2]14. 25℃时,下列溶液中粒子的物质的量浓度关系正确的是( )A、向浓度为0.1mol•L﹣1的NaHCO3溶液中滴加少量盐酸后所得溶液中:c(Na+)=c(CO32﹣)+c(HCO3﹣)+c(H2CO3) B、pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合所得溶液中:c(CH3COO﹣)+c(H+)>c(Na+)+c(OH﹣) C、0.1 mol•L﹣1CH3COOH溶液和0.1 mol•L﹣1CH3COONa溶液等体积混合:c(Na+)>c(CH3COOH)>c(CH3COO﹣)>c(H+)>c(OH﹣) D、0.1 mol•L﹣1 NH4HSO4溶液中滴加0.1 mol•L﹣1 NaOH溶液至中性:c(Na+)>c(SO42﹣)>c(NH4+)>c(OH﹣)=c(H+)15. 在体积为2L的恒容密闭容器中发生反应xA(g)+yB(g)⇌zC(g),图1表示200℃时容器中A,B,C物质的量随时间的变化关系,图2表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系.则下列结论正确的是( ) A、200℃时,反应从开始到平衡的平均速率v(B)=0.04mol•L﹣1•min﹣1 B、图2所知反应xA(g)+yB(g)⇌zC(g)的△H>0,且a=2 C、若在图1所示的平衡状态下,再向体系中充入He,此时v正>v逆 D、200℃时,向容器中充入2mol A和1mol B,达到平衡时,A的体积分数小于0.5
A、200℃时,反应从开始到平衡的平均速率v(B)=0.04mol•L﹣1•min﹣1 B、图2所知反应xA(g)+yB(g)⇌zC(g)的△H>0,且a=2 C、若在图1所示的平衡状态下,再向体系中充入He,此时v正>v逆 D、200℃时,向容器中充入2mol A和1mol B,达到平衡时,A的体积分数小于0.5三、解答题
-
16. 铝硅合金材料性能优良.铝土矿(含30% SiO2、40.8% Al2O3和少量Fe2O3等)干法制取该合金的工艺如图1:
 (1)、铝硅合金材料中若含铁,会影响其抗腐蚀性.原因是 .(2)、焙烧除铁反应时Fe2O3转化为NH4Fe(SO4)2 , Al2O3少部分发生类似反应,写出Fe2O3发生反应的方程式 . 氧化物转化为硫酸盐的百分率与温度的关系如图2,最适宜焙烧温度为 .(3)、若操作①中所得溶液中加入过量NaOH溶液,含铝微粒发生反应的离子方程式为 .(4)、用焦炭还原SiO2、Al2O3会产生SiC等中间体.写出中间体SiC再与Al2O3反应生成铝、硅单质的化学方程式 .(5)、不计损失,投入1t铝土矿,当加入27kg纯铝后,铝硅合金中m:n= .17. 有机物F是一种治疗关节炎止痛药,合成F的一种传统法路线如图:
(1)、铝硅合金材料中若含铁,会影响其抗腐蚀性.原因是 .(2)、焙烧除铁反应时Fe2O3转化为NH4Fe(SO4)2 , Al2O3少部分发生类似反应,写出Fe2O3发生反应的方程式 . 氧化物转化为硫酸盐的百分率与温度的关系如图2,最适宜焙烧温度为 .(3)、若操作①中所得溶液中加入过量NaOH溶液,含铝微粒发生反应的离子方程式为 .(4)、用焦炭还原SiO2、Al2O3会产生SiC等中间体.写出中间体SiC再与Al2O3反应生成铝、硅单质的化学方程式 .(5)、不计损失,投入1t铝土矿,当加入27kg纯铝后,铝硅合金中m:n= .17. 有机物F是一种治疗关节炎止痛药,合成F的一种传统法路线如图: (1)、B中含氧官能团的名称为 .(2)、C→D的反应可分为两步,其反应类型为、 .(3)、写出比F少5个碳原子的同系物X的结构简式:(任写一种);X有多种同分异构体,满足下列条件的X的同分异构体共有种.
(1)、B中含氧官能团的名称为 .(2)、C→D的反应可分为两步,其反应类型为、 .(3)、写出比F少5个碳原子的同系物X的结构简式:(任写一种);X有多种同分异构体,满足下列条件的X的同分异构体共有种.①属于芳香族化合物 ②苯环上只有1个取代基 ③属于酯类物质
(4)、写出E转化为F和无机盐的化学方程式为 .(5)、已知:①


②

 R、R′表示烃基
R、R′表示烃基合成F的一种改良法是以
 、苯、(CH3CO)2O为原料来合成,写出有关的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2Br CH3CHOH CH3COOCH2CH3 . 18. 化学工业中会产生大量含铬废水,直接排放会产生污染.(1)、工业上处理酸性含Cr2O72﹣废水的方法如下:
、苯、(CH3CO)2O为原料来合成,写出有关的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2Br CH3CHOH CH3COOCH2CH3 . 18. 化学工业中会产生大量含铬废水,直接排放会产生污染.(1)、工业上处理酸性含Cr2O72﹣废水的方法如下:①SO2还原法:向1000L含0.002mol•L﹣1 Cr2O72﹣的酸性废水中通入SO2使Cr2O72﹣全部转化为Cr3+ , 至少需要通入 L SO2(标准状况)
②铁屑还原法:向含Cr2O72﹣的酸性废水中加入废铁屑,加热充分反应后,加入熟石灰调节溶液的pH,使Cr3+完全沉淀.
已知25℃时,Ksp[Cr(OH)3]=6.3×10﹣31 . 欲使溶液中残余Cr3+的物质的量浓度为6.3×10﹣7 mol•L﹣1 , 应调节溶液的pH= .
(2)、铬元素总浓度的测定:准确移取20.00mL含Cr2O72﹣和Cr3+的酸性废水,向其中加入足量(NH4)2S2O8溶液将Cr3+氧化成Cr2O72﹣ , 煮沸除去过量(NH4)2S2O8;向上述溶液中加入过量的KI溶液,充分反应后,以淀粉为指示剂,向其中滴加0.03mol•L﹣1的Na2S2O3标准溶液,终点时消耗Na2S2O3溶液20.00mL.①上述操作过程中,若无煮沸操作,则测定的铬元素总浓度会 .
②计算废水中铬元素总浓度(单位:mg•L﹣1 , 写出计算过程)
已知测定过程中发生的反应如下:
①2Cr3++3S2O82﹣+7H2O=Cr2O72﹣+6SO42﹣+14H+
②Cr2O72﹣+6I﹣+14H+=2Cr3++3I2+7H2O
③I2+2S2O32﹣=2I﹣+S4O62﹣ .
19. 甲酸钙广泛用于食品、化工、石油等工业生产上,300~400℃左右分解. (1)、实验室制取的方法之一是:Ca(OH)2+2HCHO+H2O2=Ca(HCOO)2+2H2O+H2↑.
(1)、实验室制取的方法之一是:Ca(OH)2+2HCHO+H2O2=Ca(HCOO)2+2H2O+H2↑.实验室制取时,将工业用氢氧化钙和甲醛依次加入到质量分数为30~70%的过氧化氢溶液中(投料物质的量之比依次为1:2:1.2),最终可得到质量分数98%以上且重金属含量极低的优质产品.
(I)过氧化氢比理论用量稍多,其目的是 .
(II)反应温度最好控制在30~70℃之间,温度不易过高,其主要原因是 .
(III)制备时在混合溶液中要加入微量硼酸钠抑制甲醛发生副反应外,还要加入少量的Na2S溶液,加硫化钠的目的是 .
(IV)实验时需强力搅拌45min,其目的是;结束后需调节溶液的pH 7~8,其目的是 . 最后经结晶分离、干燥得产品.
(2)、某研究性学习小组用工业碳酸钙(主要成分为CaCO3;杂质为:Al2O3、FeCO3) 为原料,先制备无机钙盐,再与甲酸钠溶液混合制取甲酸钙.结合下图几种物质的溶解度曲线及表中相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L﹣1计算),现提供的试剂有:a.甲酸钠,b.5mol•L﹣1硝酸,c.5mol•L﹣1盐酸,d.5mol•L﹣1硫酸,e.3%H2O2溶液,f.澄清石灰水.金属
离子
开始沉淀
的pH
沉淀完全
的pH
Fe3+
1.1
3.2
Al3+
3.0
5.0
Fe2+
5.8
8.8
实验步骤
步骤1:称取13.6g甲酸钠溶于约20mL水,配成溶液待用,并称取研细的碳酸钙样品10g待用.
步骤2: .
步骤3: .
步骤4:过滤后,将滤液与甲酸钠溶液混合,调整溶液pH 7~8,充分搅拌,所得溶液经蒸发浓缩、、洗涤、60℃时干燥得甲酸钙晶体.
20. 氢能是一种极具发展潜力的清洁能源.硫碘循环分解水是最具潜力的制氢方法.其反应原理如下:Ⅰ.SO2+2H2O+I2=H2SO4+2HIⅡ.2H2SO4=2SO2+O2+2H2OⅢ.2HI=H2+I2
(1)、反应Ⅱ在低温条件下不能自发进行的原因是 .在反应器中加入SO2、I2、H2O的物质的量分别为1mol、9mol、16mol,充分反应静置后得到混合物分成两层﹣﹣上层是含低浓度I2的H2SO4层和下层是高浓度的I2的HI层.
①根据上述事实,下列说法正确的是(选填序号).
a.H2SO4溶液和HI溶液不互溶
b.HI溶液的密度大于H2SO4溶液的密度
c.I2在HI溶液中比在H2SO4溶液中易溶
②辨别两层溶液的方法是 .
③HI层中存在I﹣+I2⇌I3﹣ , c(H+) c(I﹣)+c(I3﹣)(填大于、小于或等于)
(2)、已知:SO3(g)+H2O(g)=H2SO4(l)△H=﹣177kJ/mol2SO3(g)=2SO2(g)+O2(g)△H=+196kJ/mol
则2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g)的△H=kJ/mol
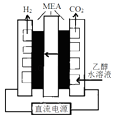
(3)、电解乙醇水溶液制备氢气具有诱人的前景,如图是电解乙醇水溶液的装置剖面,MEA为电解质膜允许质子通过.①通电电解前需要向阴极区通入氩气,其目的是
②写出阳极电极反应式 .
 21. 氮元素可形成氢化物、卤化物、氮化物、叠氮化物和配合物等多种化合物.(1)、肼(N2H4)可用作火箭燃料,其原理是:N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g),若反应中有4mol N﹣H键断裂,则形成的π键有 mol,N2H4的沸点比C2H6的主要原因是 .(2)、F2和过量NH3在铜催化作用下反应生成NF3 , NF3分子的空间构型为 .(3)、铁和氨气在640℃可发生置换反应,产物之一的晶胞结构见图.写出该反应的化学方程式: .
21. 氮元素可形成氢化物、卤化物、氮化物、叠氮化物和配合物等多种化合物.(1)、肼(N2H4)可用作火箭燃料,其原理是:N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g),若反应中有4mol N﹣H键断裂,则形成的π键有 mol,N2H4的沸点比C2H6的主要原因是 .(2)、F2和过量NH3在铜催化作用下反应生成NF3 , NF3分子的空间构型为 .(3)、铁和氨气在640℃可发生置换反应,产物之一的晶胞结构见图.写出该反应的化学方程式: . (4)、叠氮化钠(NaN3)分解反应为:2NaN3(s)=2Na(l)+3N2(g),下列有关说法正确的是(填序号).
(4)、叠氮化钠(NaN3)分解反应为:2NaN3(s)=2Na(l)+3N2(g),下列有关说法正确的是(填序号).a.常温下,N2很稳定,是因为N的电离能大
b.钠晶胞结构见图2,每个晶胞含有5个钠原子
c.第一电离能(I1):N>O>P>S
d.NaN3与KN3结构类似,晶格能:NaN3<KN3
(5)、配合物Y的结构见图3,Y中含有(填序号);a.极性共价键 b.非极性共价键 c.配位键 d.氢键
Y中碳原子的杂化方式有 .