2015-2016学年江西省宜春市高二上学期期末化学试卷
试卷更新日期:2017-02-20 类型:期末考试
一、选择题
-
1. 以下对化学反应描述的观点中正确的有几项:①放热反应在常温下均能自发进行;②电解过程中,化学能转化为电能而“储存”起来;③原电池工作时所发生的反应一定有氧化还原反应;④加热时,化学反应只向吸热反应方向进行;⑤盐类均能发生水解反应;⑥相同温度下,同一反应的化学平衡常数的大小与化学反应方程式的书写有关.( )A、1项 B、2项 C、3项 D、4项2. 关于如图所示转化关系(X代表卤素),说法不正确的是( )
 A、2H(g)+2X(g)=2HX(g)△H3<0 B、途径Ⅰ生成HX的反应热与途径无关,所以△H1=△H2+△H3 C、途径Ⅰ生成HBr放出的热量比生成HCl的少,说明HBr比HCl稳定 D、Cl、Br、I的非金属性依次减弱,所以途径Ⅱ吸收的热量依次减小3. 在恒温恒容密闭容器中发生反应2NO2⇌2NO+O2 , 不能说明反应达到平衡状态的是( )A、2v(O2)=v(NO2) B、单位时间内生成n mol O2的同时生成2n molNO2 C、混合气体的颜色不再改变 D、混合气体的平均相对分子质量不再改变4. 25℃时,下列各组溶液混合后,溶液一定呈中性的是( )A、等体积、等物质的量浓度的氨水与盐酸混合 B、pH之和为14的氨水与硝酸等体积混合 C、pH之和为14的Ba(OH)2溶液与NaHSO4溶液等体积混合 D、等体积、等物质的量浓度的Ca(OH)2溶液与Na2CO3溶液混合5. 下列关于“一定”的说法中正确的是( )A、使用pH试纸测定溶液pH时若先润湿,测得溶液的pH一定有影响 B、25℃时,水溶液中水电离出的c(H+)和水电离的c(OH﹣)乘积一定等于10﹣14 C、如果Na2Y的水溶液显中性,该溶液中一定没有电离平衡 D、温度保持不变,向水中加入醋酸钠固体一定会影响水的电离6. 三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调节NiCl2溶液pH至7.5,加入适量硫酸钠后进行电解.电解过程中产生的Cl2在弱碱性条件下生成ClO﹣ , 把二价镍氧化为三价镍.以下说法正确的是( )A、可用铁作阳极材料 B、电解过程中阳极附近溶液的pH升高 C、阳极反应方程式为:2Cl﹣﹣2e﹣═Cl2↑ D、1 mol二价镍全部转化为三价镍时,外电路中通过 了2 mol 电子7. 1.5g 火箭燃料二甲基肼(CH3﹣NH﹣NH﹣CH3)完全燃烧放出50kJ热量,则二甲基肼的燃烧热为( )A、2000kJ B、△H=﹣2000kJ/mol C、△H=﹣1500kJ/mol D、﹣2000kJ/mol8. 一真空定容的密闭容器中盛有1mol PCl5 , 发生反应PCl5(g)⇌PCl3(g)+Cl2(g),一定条件下平衡时PCl5所占的体积百分数为M,若相同条件相同容器中,最初放入2mol PCl5 , 则平衡时,PCl5的体积百分数为N,下列结论正确的是( )A、M>N B、M=N C、M<N D、无法比较9. 下列事实一定能说明HA为弱电解质的有几句:( )
A、2H(g)+2X(g)=2HX(g)△H3<0 B、途径Ⅰ生成HX的反应热与途径无关,所以△H1=△H2+△H3 C、途径Ⅰ生成HBr放出的热量比生成HCl的少,说明HBr比HCl稳定 D、Cl、Br、I的非金属性依次减弱,所以途径Ⅱ吸收的热量依次减小3. 在恒温恒容密闭容器中发生反应2NO2⇌2NO+O2 , 不能说明反应达到平衡状态的是( )A、2v(O2)=v(NO2) B、单位时间内生成n mol O2的同时生成2n molNO2 C、混合气体的颜色不再改变 D、混合气体的平均相对分子质量不再改变4. 25℃时,下列各组溶液混合后,溶液一定呈中性的是( )A、等体积、等物质的量浓度的氨水与盐酸混合 B、pH之和为14的氨水与硝酸等体积混合 C、pH之和为14的Ba(OH)2溶液与NaHSO4溶液等体积混合 D、等体积、等物质的量浓度的Ca(OH)2溶液与Na2CO3溶液混合5. 下列关于“一定”的说法中正确的是( )A、使用pH试纸测定溶液pH时若先润湿,测得溶液的pH一定有影响 B、25℃时,水溶液中水电离出的c(H+)和水电离的c(OH﹣)乘积一定等于10﹣14 C、如果Na2Y的水溶液显中性,该溶液中一定没有电离平衡 D、温度保持不变,向水中加入醋酸钠固体一定会影响水的电离6. 三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调节NiCl2溶液pH至7.5,加入适量硫酸钠后进行电解.电解过程中产生的Cl2在弱碱性条件下生成ClO﹣ , 把二价镍氧化为三价镍.以下说法正确的是( )A、可用铁作阳极材料 B、电解过程中阳极附近溶液的pH升高 C、阳极反应方程式为:2Cl﹣﹣2e﹣═Cl2↑ D、1 mol二价镍全部转化为三价镍时,外电路中通过 了2 mol 电子7. 1.5g 火箭燃料二甲基肼(CH3﹣NH﹣NH﹣CH3)完全燃烧放出50kJ热量,则二甲基肼的燃烧热为( )A、2000kJ B、△H=﹣2000kJ/mol C、△H=﹣1500kJ/mol D、﹣2000kJ/mol8. 一真空定容的密闭容器中盛有1mol PCl5 , 发生反应PCl5(g)⇌PCl3(g)+Cl2(g),一定条件下平衡时PCl5所占的体积百分数为M,若相同条件相同容器中,最初放入2mol PCl5 , 则平衡时,PCl5的体积百分数为N,下列结论正确的是( )A、M>N B、M=N C、M<N D、无法比较9. 下列事实一定能说明HA为弱电解质的有几句:( )①常温时NaA溶液的pH大于7;
②用HA溶液做导电实验,灯泡很暗;
③HA与NaCl不能反应;
④常温下0.1mol•L﹣1的HA溶液pH=2;
⑤1L pH=1的HA溶液加水稀释至100mL后溶液的pH=2.2;
⑥1L pH=1的HA溶液和1L pH=1的盐酸分别与足量的NaOH溶液完全反应,最终HA消耗的NaOH多;
⑦HA溶液中加水稀释,溶液中c(OH﹣)增大.
A、4句 B、5句 C、6句 D、7句10. 在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t℃时AgCl的Ksp=4×10﹣10 , 下列说法不正确的是( )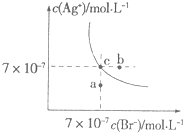 A、在t℃时,AgBr的Ksp为4.9×10﹣13 B、在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点 C、图中a点对应的是AgBr的不饱和溶液 D、向组成为c点的溶液中加入等体积的0.1 mol/L的氯化钠溶液,可产生AgCl沉淀11. 0.1mol/LNaOH和0.1mol/LNH4Cl溶液等体积混和后,离子浓度大小顺序正确的是( )A、c(Na+)>c(Cl﹣)>c(OH﹣)>c(H+) B、c(Na+)=c(Cl﹣)>c(OH﹣)>c(H+) C、c(Na+)=c(Cl﹣)>c(H+)>c(OH﹣) D、c(Cl﹣)>c(Na+)>c(OH﹣)>c(H+)12. 常温下,将0.1mo1•L﹣1的醋酸溶液加水稀释至原来体积的10倍,下列有关叙述正确的是( )A、CH3COOH的电离平衡常数增大为原来的10倍 B、CH3COO﹣与CH3COOH的浓度之比增大为原来的10倍 C、CH3COO﹣与H+的浓度之积减小为原来的0.1 D、CH3COOH与CH3COO﹣的浓度之和减小为原来的0.113. 在常温下,取浓度相同的NaOH和HCl溶液,以3:2的体积比相混合(体积变化忽略不计),所得溶液的pH等于13,则原溶液的浓度为( )A、0.01mol•L﹣1 B、0.05mol•L﹣1 C、0.017mol•L﹣1 D、0.50mol•L﹣114. 已知在100℃的温度下,水的离子积KW=1×10﹣12 . 本题涉及的溶液,其温度均为100℃.下列说法中正确的是( )A、0.005 mol•L﹣1的硫酸溶液,pH=2 B、0.001 mol•L﹣1的氢氧化钠溶液,pH=11 C、0.005 mol•L﹣1的硫酸溶液与0.01 mol•L﹣1的氢氧化钠溶液等体积混合,混合溶液的pH为6,溶液显酸性 D、完全中和pH=3的硫酸溶液50 mL,需要pH=11的NaOH溶液50 mL15. 已知25℃时有关弱酸的电离平衡常数:
A、在t℃时,AgBr的Ksp为4.9×10﹣13 B、在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点 C、图中a点对应的是AgBr的不饱和溶液 D、向组成为c点的溶液中加入等体积的0.1 mol/L的氯化钠溶液,可产生AgCl沉淀11. 0.1mol/LNaOH和0.1mol/LNH4Cl溶液等体积混和后,离子浓度大小顺序正确的是( )A、c(Na+)>c(Cl﹣)>c(OH﹣)>c(H+) B、c(Na+)=c(Cl﹣)>c(OH﹣)>c(H+) C、c(Na+)=c(Cl﹣)>c(H+)>c(OH﹣) D、c(Cl﹣)>c(Na+)>c(OH﹣)>c(H+)12. 常温下,将0.1mo1•L﹣1的醋酸溶液加水稀释至原来体积的10倍,下列有关叙述正确的是( )A、CH3COOH的电离平衡常数增大为原来的10倍 B、CH3COO﹣与CH3COOH的浓度之比增大为原来的10倍 C、CH3COO﹣与H+的浓度之积减小为原来的0.1 D、CH3COOH与CH3COO﹣的浓度之和减小为原来的0.113. 在常温下,取浓度相同的NaOH和HCl溶液,以3:2的体积比相混合(体积变化忽略不计),所得溶液的pH等于13,则原溶液的浓度为( )A、0.01mol•L﹣1 B、0.05mol•L﹣1 C、0.017mol•L﹣1 D、0.50mol•L﹣114. 已知在100℃的温度下,水的离子积KW=1×10﹣12 . 本题涉及的溶液,其温度均为100℃.下列说法中正确的是( )A、0.005 mol•L﹣1的硫酸溶液,pH=2 B、0.001 mol•L﹣1的氢氧化钠溶液,pH=11 C、0.005 mol•L﹣1的硫酸溶液与0.01 mol•L﹣1的氢氧化钠溶液等体积混合,混合溶液的pH为6,溶液显酸性 D、完全中和pH=3的硫酸溶液50 mL,需要pH=11的NaOH溶液50 mL15. 已知25℃时有关弱酸的电离平衡常数:弱酸化学式
CH3COOH
HCN
H2CO3
电离平衡常数(25℃)
1.8×10﹣5
4.9×10﹣10
K1=4.3×10﹣7
K2=5.6×10﹣11
则下列有关说法正确的是( )
A、等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Ma2CO3)>pH(CH3COONa) B、amol/L HCN 溶液与b mol/L NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN﹣),则一定a大于b C、冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离(程)度、c(H+)均先增大后减小 D、NaHCO3和Na2CO3的混合溶液中,一定存在:c(Na+)+c(H+)=c(OH﹣)+c(HCO3﹣)+2c(CO32﹣)16. 现有 0.4mol/L HA溶液和0.2mol/L NaOH溶液等体积混合组成的混合溶液.下列有关推断不正确的是( )A、若HA 的电离能力大于A﹣的水解能力,则有c(A﹣)>c(Na+)>c(HA)>c(H+)>c(OH﹣) B、若A﹣的水解能力大于HA 的电离能力,则有c(Na+)>c(HA)>c(A﹣)>c(OH﹣)>c(H+) C、无论该溶液呈酸性还是碱性,都有 c(Na+)+c(H+)=c(A﹣)+c(OH﹣) D、无论该溶液呈酸性还是碱性,都有2c(Na+)=c(A﹣)+c(HA)二、非选择题
-
17. 反应①Fe(s)+CO2(g)⇌FeO(s)+CO(g)△H1=akJ•mol﹣1 , 平衡常数为K;反应②CO(g)+ O2(g)⇌CO2(g)△H2=bkJ•mol﹣1 . 测得在不同温度下,K值如表:
温度/℃
500
700
900
K
1.00
1.47
2.40
(1)、若500℃时进行反应①,CO2起始浓度为2mol/L,CO的平衡浓度为 .(2)、反应①中的a0(填“大于”、“小于”或“等于”).(3)、700℃时反应①达到平衡,要使得该平衡向右移动,其他条件不变时,可以采取的措施有(填序号).A、缩小反应器体积 B、通入CO2 C、升高温度到 900℃ D、使用合适的催化剂(4)、如图图象符合反应①的是(填序号)(图中φ是混合物中CO的含量;T为温度).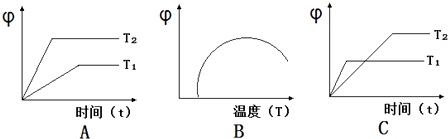 (5)、反应③2Fe(s)+O2(g)═2FeO(s)△H3= .18. 在常温常压下,1g C2H5OH燃烧生成CO2和液态H2O时放出29.71kJ热量,表示该反应的热化学方程式为;将NaHCO3溶液跟Al2(SO4)3溶液混合,相关反应的离子方程式是19. 有浓度均为0.2mol/L的Na2CO3溶液与NaHCO3溶液,试回答下列问题:
(5)、反应③2Fe(s)+O2(g)═2FeO(s)△H3= .18. 在常温常压下,1g C2H5OH燃烧生成CO2和液态H2O时放出29.71kJ热量,表示该反应的热化学方程式为;将NaHCO3溶液跟Al2(SO4)3溶液混合,相关反应的离子方程式是19. 有浓度均为0.2mol/L的Na2CO3溶液与NaHCO3溶液,试回答下列问题:①微粒种类:Na2CO3NaHCO3溶液(填“>”、“<”或“=”)
②两溶液分别加入0.1molNaOH固体,恢复到室温,Na2CO3溶液中的c(CO32﹣)(填“增大”、“减小”或“不变”);NaHCO3溶液中的c(HCO3﹣)(填“增大”、“减小”或“不变”).
20. 常温下,甲为0.1mol/L的HA溶液,pH>1;乙为0.1mol/L的BOH溶液,且溶液中c(OH﹣):c(H+)=1012 . 请分别写出甲、乙两溶液中溶质的电离方程式、 .21. 相同条件下,对于浓度均为0.1mol/L的NaCl溶液和CH3COONa溶液,溶液中离子总数:NaCl溶液 CH3COONa溶液(填>、﹦、<).22. 物质的量浓度相同的:①氨水 ②氯化铵 ③碳酸氢铵 ④硫酸氢铵 ⑤硫酸铵五种溶液中C(NH )由大到小的顺序是(填序号).23. 在密闭容器中,使2mol N2和6mol H2混合发生下列反应:N2(g)+3H2(g)⇌2ΝΗ3(g)△H<0(1)、当反应达到平衡时,N2和H2的浓度比是;N2和H2的转化率比是 .(2)、升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量 , 密度 . (填“变大”、“变小”或“不变”)(3)、当达到平衡时,充入氩气,并保持压强不变,平衡将(填“正向”、“逆向”或“不”)移动.(4)、若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将(填“向左移动”、“向右移动”或“不移动”).达到新平衡后,容器内温度(填“大于”、“小于”或“等于”)原来的2倍.24. 如图所示,甲、乙是电化学实验装置,请回答下列问题: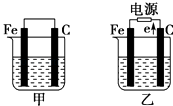 (1)、若甲、乙两个烧杯中均盛放饱和NaCl溶液.
(1)、若甲、乙两个烧杯中均盛放饱和NaCl溶液.①甲中石墨棒上的电极反应式是 .
②将湿润的淀粉KI试纸放在乙烧杯的上方,发现试纸先变蓝后褪色,这是因为电解生成的某种气体A氧化了I﹣生成了I2 . 若A气体和I2按物质的量之比为5:1反应,且生成两种酸,该反应的化学方程式为 .
③如果不考虑气体产物与烧杯中溶液之间的反应,当乙反应有0.01mol电子转移后停止实验,烧杯中溶液的体积为100mL,则溶液混匀后的pH=
(2)、若甲、乙两烧杯中均盛放CuSO4溶液.①甲中铁棒上的电极反应式为 .
②乙中总反应的离子方程式为 .
③如果起始时乙中盛放100mL pH=5的CuSO4溶液(25℃),一段时间后溶液的pH变为1,若要使溶液恢复到起始时的浓度(忽略溶液体积的变化),可向溶液中加入(填写物质的化学式) g.
25. 如图所示,A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气囊.关闭K2 , 将各1mol NO2通过K1、K3分别充入A、B中,反应起始时A、B的体积相同均为a L.
①B中可通过判断可逆反应2NO2⇌N2O4已经达到平衡.
②若平衡后在A容器中再充入0.5mol N2O4 , 则重新到达平衡后,平衡混合气中NO2的体积分数(填“变大”“变小”或“不变”).
③若容器A中到达平衡所需时间t s,达到平衡后容器内压强为起始压强的0.8倍,则平均化学反应速率v(NO2)等于
④若打开K2 , 平衡后B容器的体积缩至0.4a L,则打开K2之前,气球B体积为 L.
26. 已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH:溶质
CH3COONa
NaHCO3
Na2CO3
NaClO
NaCN
C6H5ONa
pH
8.1
8.8
11.6
10.3
11.1
11.3
(1)、请根据上述信息判断下列反应不能发生的是 (填编号).A、CH3COOH+NaCN═CH3COONa+HCN B、CO2+H2O+2NaClO═Na2CO3+2HClO C、Na2CO3+C6H5OH→NaHCO3+C6H5ONa D、HCN+Na2CO3→NaCN+CO2+H2O(2)、已知常温时Ksp(AgCl)=1.8×10﹣10mol2•L﹣2 , 向50mL 0.18mol•L﹣1的AgNO3溶液中加入相同体积0.22mol•L﹣1的盐酸,则c(Ag+)= .