北京市2018年中考化学试卷
试卷更新日期:2018-08-08 类型:中考真卷
一、单选题
-
1. 下列物质能使紫色石蕊试液变红的是( )A、CO2 B、O2 C、NaCl D、NaOH2. 下列含金属元素的物质是( )A、H2SO4 B、Al2O3 C、NO2 D、P2O53. 一些物质的pH范围如下,其中呈碱性的是( )A、油污净(12~13) B、西瓜汁(5~6) C、洁厕灵(1~2) D、橘子汁(3~4)4. 下列金属不能与CuSO4溶液反应的是( )A、Ag B、Fe C、Zn D、Al5. 下列操作错误的是( )A、
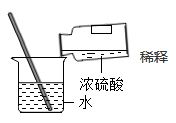 稀释
B、
稀释
B、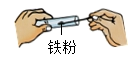 取药
C、
取药
C、 称量
D、
称量
D、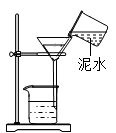 过滤
6. 下列符号能表示2个氯分子的是( )A、Cl2 B、2Cl2 C、2Cl D、2Cl-7. 下列物质能与NaOH反应的是( )A、Fe B、CO2 C、Fe2O3 D、NaCl8. 电解水实验如下图。下列说法正确的是( )
过滤
6. 下列符号能表示2个氯分子的是( )A、Cl2 B、2Cl2 C、2Cl D、2Cl-7. 下列物质能与NaOH反应的是( )A、Fe B、CO2 C、Fe2O3 D、NaCl8. 电解水实验如下图。下列说法正确的是( )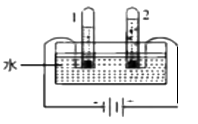 A、试管2中得到H2 B、产生H2与O2的体积比约为1:2 C、该实验说明水是由H2和O2组成 D、可用带火星的木条检验生成的O29. 用下图装置进行实验。下列现象能证明空气中O2的含量的是( )
A、试管2中得到H2 B、产生H2与O2的体积比约为1:2 C、该实验说明水是由H2和O2组成 D、可用带火星的木条检验生成的O29. 用下图装置进行实验。下列现象能证明空气中O2的含量的是( )
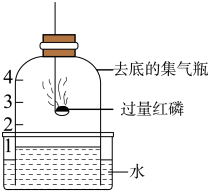 A、红磷燃烧,产生白烟 B、瓶中液面先下降,后上升 C、瓶中液面最终上升至1处 D、水槽中液面下降10. 已知20℃时,NaCl和NaNO3的溶解度分别为36g和88g。
A、红磷燃烧,产生白烟 B、瓶中液面先下降,后上升 C、瓶中液面最终上升至1处 D、水槽中液面下降10. 已知20℃时,NaCl和NaNO3的溶解度分别为36g和88g。
①~⑤所得溶液属于饱和溶液的是( )
A、①③ B、②④ C、②⑤ D、④⑤11. 依据下列20℃时的实验和数据回答10~11题。已知20℃时,NaCl和NaNO3的溶解度分别为36g和88g。

下列关于①~⑤所得溶液的说法错误的是( )
A、溶质质量:①<② B、溶液质量:②<④ C、溶质质量分数:①=③ D、⑤中溶质与溶剂的质量比为9:1012. 氨催化氧化是制硝酸的主要反应之一。该反应前后分子种类变化的微观示意图如下。下列说法错误的是( )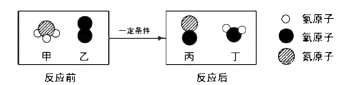 A、甲中氮、氢原子个数比为1:3 B、乙的相对分子质量为32 C、两种生成物均为化合物 D、生成的丙与丁的分子个数比为1:2
A、甲中氮、氢原子个数比为1:3 B、乙的相对分子质量为32 C、两种生成物均为化合物 D、生成的丙与丁的分子个数比为1:2二、填空题
-
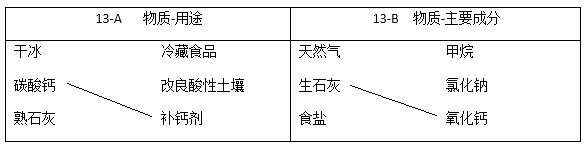
13. 补齐连线。从12-A或13-B中任选一个作答,若均作答,按13-A计分。
 14. 干热岩是地层深处的热岩体。下图为利用其发电的示意图。
14. 干热岩是地层深处的热岩体。下图为利用其发电的示意图。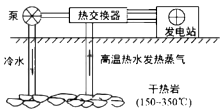 (1)、将干热岩的热量传递到热交换器的物质是。(2)、从微粒的角度分析,水变为水蒸气时,变化的是。
(1)、将干热岩的热量传递到热交换器的物质是。(2)、从微粒的角度分析,水变为水蒸气时,变化的是。三、简答题
-
15. H2O2可作增氧剂。常温下,用4%H2O2溶液进行实验,研究pH对H2O2分解所得溶液中氧量的影响,测定结果如图。
 (1)、H2O2分解的化学方程式为。(2)、分析如图得到的结论是。16. 阅读下面科普短文。
(1)、H2O2分解的化学方程式为。(2)、分析如图得到的结论是。16. 阅读下面科普短文。化石能源是目前应用最广泛的能源,但其储量有限,不可再生。《2050年世界与中国能源展望》中提出,全球能源结构正在向多元、清洁、低碳转型。
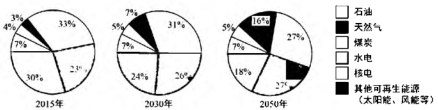
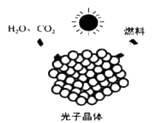
由上图可见,太阳能、风能等其他可再生能源在能源结构中所占比例日益增多。太阳能的利用是热门研究方向之一。例如,通过光催化可将H2O、CO2转化为H2、CO、CH4、CH3OH(甲醇)等太阳能燃料,示意图右图。
随着科技的进步,能源将得到更充分的利用。例如,利用照明灯、人体散发的热量灯生活中随处可见的废热发电。我国研发的“柔性、可裁剪碲化铋(Bi2Te3)/纤维素复合热点薄膜电池”,能充分贴合人体体表,实现利用体表散热为蓝牙耳机、手表、智能手环等可穿戴电子设备供电。

在新能源的开发和利用中,化学起着不可替代的作用。
依据文章内容回答下列问题。
(1)、比较2015、2030和2050年能源结构中的化石能源,所占比例降低的是。(2)、H2O、CO2转化得到的太阳能燃料中,属于氧化物的是;该过程属于(填“物理”或“化学”)变化。(3)、复合热点薄膜电池中Bi2Te3由种元素组成。(4)、下列说法正确的是 ____________(填序号)。A、能源结构向多元、清洁、低碳转型 B、科技进步会促进能源的利用 C、石油和太阳能属于可再生能源 D、生活中的废热可转化为电能17. 用下图装置进行实验(夹持仪器略去)。加热一段时间后,蜡烛熔化、掉落,之后火柴燃烧。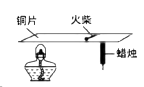 (1)、能说明铜具有导热性的现象是。(2)、能体现物质化学性质的现象是___________(填序号)。A、酒精燃烧 B、蜡烛熔化 C、火柴燃烧18. 用下图装置进行实验(夹持仪器略去)。
(1)、能说明铜具有导热性的现象是。(2)、能体现物质化学性质的现象是___________(填序号)。A、酒精燃烧 B、蜡烛熔化 C、火柴燃烧18. 用下图装置进行实验(夹持仪器略去)。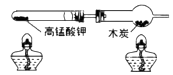 (1)、高锰酸钾分解的化学方程式为。(2)、木炭遇O2燃烧时,现象为。19. 实验室用如图装置制取CO2。
(1)、高锰酸钾分解的化学方程式为。(2)、木炭遇O2燃烧时,现象为。19. 实验室用如图装置制取CO2。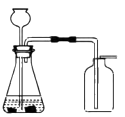 (1)、反应的化学方程式为。(2)、用向上排空气法收集CO2的原因是。20. 用下图所示实验验证可燃物燃烧的条件。
(1)、反应的化学方程式为。(2)、用向上排空气法收集CO2的原因是。20. 用下图所示实验验证可燃物燃烧的条件。已知:白磷的着火点为40℃。
 (1)、设计B、D的目的是。(2)、能验证可燃物需要O2的现象是。(3)、A~D中,可不做的实验是(填序号)。
(1)、设计B、D的目的是。(2)、能验证可燃物需要O2的现象是。(3)、A~D中,可不做的实验是(填序号)。四、流程题
-
21. 炼铁的主要原料是赤铁矿(主要成分是Fe2O3)、焦炭、空气等,转化过程如下:
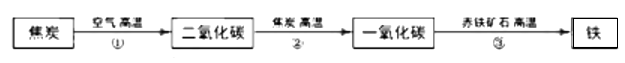 (1)、②中,反应为CO2+C 2CO,其中化合价发生改变的元素是。(2)、③中,CO与Fe2O3反应的化学方程式为。22. 为保护绿水青山,可将工业残留的钡渣(主要成分为碳酸钡(BaCO3))进行无害化处理,制取化工原料;硫酸钡(BaSO4)。主要流程如下:
(1)、②中,反应为CO2+C 2CO,其中化合价发生改变的元素是。(2)、③中,CO与Fe2O3反应的化学方程式为。22. 为保护绿水青山,可将工业残留的钡渣(主要成分为碳酸钡(BaCO3))进行无害化处理,制取化工原料;硫酸钡(BaSO4)。主要流程如下:
已知:BaSO4难溶于水,氯化钡(BaCl2)可溶于水。
(1)、粉碎钡渣的目的是。(2)、反应釜1中的气体X为。(3)、反应釜2中发生复分解反应的化学方程式为。五、实验题
-
23. 进行如下微型实验,研究物质的性质。
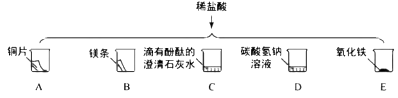 (1)、能产生气泡的是(填序号)。(2)、能证明C中发生反应的现象是。(3)、有一只烧杯中的物质不与稀盐酸反应,原因是。
(1)、能产生气泡的是(填序号)。(2)、能证明C中发生反应的现象是。(3)、有一只烧杯中的物质不与稀盐酸反应,原因是。六、科学探究题
-
24. 为探究碳还原氧化铜的最佳实验条件,用木炭粉和氧化铜的干燥混合物1~2.5g进行系列实验。
【查阅资料】①氧化铜(CuO)为黑色固体。
②碳还原氧化铜得到的铜中可能含有少量的氧化亚铜;氧化亚铜为红色固体,能与稀硫酸反应:Cu2O+ H2SO4 = CuSO4 + H2O + Cu
【进行实验】
实验1:取质量比1:11的木炭粉和氧化铜混合物1.3g,进行实验。
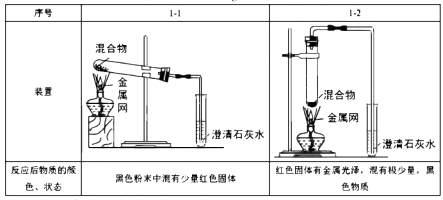
实验2:取一定量的混合物,用1—2装置进行实验。
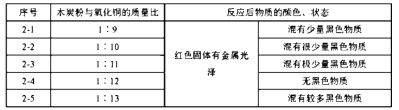
【解释与结论】
(1)、配平化学方程式:C+CuO Cu+ CO2↑。(2)、实验1—2中,证明产生CO2的现象是。(3)、实验1的目的是。(4)、实验2的结论是。(5)、【反思与评价】实验2没有进行质量比为1:14的实验,理由是。
(6)、为检验2—4的红色固体中是否含Cu2O,所需试剂是。
-