上海市长宁区2017-2018学年高考化学二模考试试卷
试卷更新日期:2018-08-06 类型:高考模拟
一、单选题
-
1. SO2排放会导致的环境问题是( )A、酸雨 B、温室效应 C、臭氧空洞 D、光化学烟雾2. 下列关于过氧化钠用途的描述错误的是( )A、供氧剂 B、消毒剂 C、漂白剂 D、淡黄色颜料3. 下列关于次氯酸(HClO)的判断正确的是( )A、见光易分解 B、很稳定 C、是强酸 D、呈黄绿色4. 下列关于矿物油(汽油、煤油、柴油等)的判断正确的是( )A、都是烃的衍生物 B、都有固定沸点 C、都易溶于水 D、都不能与氢氧化钠溶液反应5. 下列变化与碘的升华需克服相同类型作用力的是( )
A、氯化钠溶于水 B、硅的熔化 C、氯化氢溶于水 D、溴的汽化6. 下列各组气体通常条件下不能相互发生化学反应的是( )A、SO2和H2S B、Cl2和CO2 C、H2和F2 D、NH3和HCl7. 下列变化会放出热量的是( )A、碘升华 B、冰融化 C、氢氧化钠溶于水 D、氯化铵溶于水8. 0.10mol/L 的 NH4Cl 溶液中,浓度最小的离子是( )
A、NH4+ B、H+ C、Cl- D、OH-9. 下列分离方法中,和物质的溶解度无关的是( )A、升华 B、萃取 C、纸层析法 D、蒸发结晶10. 对于常温下1升pH=1 的硝酸溶液,下列叙述正确的是( )A、该溶液1mL稀释至100mL后,pH等于3 B、向该溶液中加入含 0.1mol 氢氧化钡的溶液恰好完全中和 C、该溶液中硝酸电离出的 c(H+)等于水电离出的c(H+) D、该溶液中硝酸电离出的 c(H+)是水电离出的c(H+)的100倍11. 1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反应装置如图。下列对该实验的描述错误的是 ( ) A、不能用水浴加热 B、长玻璃管起冷凝回流作用 C、为提纯乙酸丁酯,可用水和碳酸钠溶液洗涤 D、通常加入过量1-丁醇以提高乙酸的转化率12. 下列表示吸热反应的图的是( )A、
A、不能用水浴加热 B、长玻璃管起冷凝回流作用 C、为提纯乙酸丁酯,可用水和碳酸钠溶液洗涤 D、通常加入过量1-丁醇以提高乙酸的转化率12. 下列表示吸热反应的图的是( )A、 B、
B、 C、
C、 D、
D、 13. 一定条件下,工业合成氨的反应达到平衡。下列措施,既能加快该反应的速率,又能增大反应物转化率的是( )
13. 一定条件下,工业合成氨的反应达到平衡。下列措施,既能加快该反应的速率,又能增大反应物转化率的是( )
A、使用催化剂 B、移走 NH3 C、提高反应温度 D、缩小容器体积14. 下列关于钢铁发生吸氧腐蚀的分析正确的是( )A、吸氧腐蚀是吸热反应 B、铁作原电池正极 C、正极电极反应为:2H2O+O2+4e-=4OH- D、原电池负极反应为:Fe-3e-=Fe3+15. 配制 250 mL 0.100 mol/L 的氯化钠溶液,操作错误的是( )A、 B、
B、 C、
C、 D、
D、 16. 某烷烃结构简式为
16. 某烷烃结构简式为 ,其一氯代物共有( ) A、2 种 B、4 种 C、5 种 D、7 种17. 检验硫酸铁溶液中是否含有硫酸亚铁,可选用的试剂是( )A、NaOH 溶液 B、酸性 KMnO4 溶液 C、KSCN 溶液 D、Cu18. H2S 分子结构和 H2O 相似,但 S-H 键键能比 O-H 键键能低。下列判断错误的是( )A、H2S 分子呈折线型 B、H2S 分子是极性分子 C、H2S 沸点低于 H2O,因为 S-H 键键能低 D、H2S 分子稳定性低于 H2O 分子19. 溶质都为1mol的NH4HCO3稀溶液和Ba(OH)2稀溶液混合,能完整表示该反应离子方程式的是( )
,其一氯代物共有( ) A、2 种 B、4 种 C、5 种 D、7 种17. 检验硫酸铁溶液中是否含有硫酸亚铁,可选用的试剂是( )A、NaOH 溶液 B、酸性 KMnO4 溶液 C、KSCN 溶液 D、Cu18. H2S 分子结构和 H2O 相似,但 S-H 键键能比 O-H 键键能低。下列判断错误的是( )A、H2S 分子呈折线型 B、H2S 分子是极性分子 C、H2S 沸点低于 H2O,因为 S-H 键键能低 D、H2S 分子稳定性低于 H2O 分子19. 溶质都为1mol的NH4HCO3稀溶液和Ba(OH)2稀溶液混合,能完整表示该反应离子方程式的是( )
A、CO32-+Ba2+→BaCO3↓ B、HCO3-+OH-→H2O+CO32- C、Ba2++2OH-+NH4++HCO3-→BaCO3↓+NH3∙H2O+H2O D、Ba2++OH-+NH4++HCO3-→BaCO3↓+NH3∙H2O+H2O20. 只用下列一种物质不能鉴别①CCl4、②NaI 溶液、③Na2SO3 溶液三者的是( )
A、溴水 B、硫酸溶液 C、BaCl2 溶液 D、淀粉溶液二、综合题
-
21. 砷化镓(GaAs)是优良的半导体材料或用于制作微型激光器或太阳能电池的材料等。部分元素在周期表中位置如下:
Al
Si
P
Ga
Ge
As
回答下列问题:
(1)、六种元素中,非金属性最强的元素是:.写出As原子的最外层的电子排布式 , As原子核外有个未成对电子。(2)、根据元素周期律,可判断原子半径GaAs。(选填“>”、 “<”或“=”)。写出铝的最高价氧化物对应水化物的电离方程式:(3)、NH3 的分子构型是。GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,可能的原因是.写出C2H2的电子式为:(4)、比较下列锗卤化物的熔点和沸点,分析其变化规律及原因GeCl4
GeBr4
GeI4
熔点/℃
-49.5
26
146
沸点/℃
83.1
186
约400
22. 在 Cu/ZnO催化剂存在下,CO2和H2可发生下列反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)(1)、反应中被氧化的元素是: , 氧化剂是。试在下列方程式中用单线桥标出电子转移的方向和数目:CO2(g)+3H2(g) CH3OH(g)+H2O(g)(2)、该反应的平衡常数表达式 K=。若只增加CO2的浓度,该平衡向移动,平衡常数 K (选填“增大”、“小”或“不变”)。(3)、从下图可以看出,由于温度不同,A和B中 先达到平衡状态,说明反应温度 A B(选填“>”、“<”或“=”),从甲醇体积分数的比较还可以说明该反应是热反应(选填“放”或“吸”);反应进行到图中M处时,正反应速率逆反应速率(选填“>”、 “<”或“=”)。 (4)、一定条件下,将 n(CO2):n(H2)=1:1 的混合气充入恒温恒容密闭容器中,若容器中气体(选填“密度”或“压强”)保持不变,说明该反应已达平衡状态。23. 普鲁卡因毒性较小,是临床常用的局部麻药之一。某兴趣小组以苯和乙烯为主要原料,采用以下路线合成:
(4)、一定条件下,将 n(CO2):n(H2)=1:1 的混合气充入恒温恒容密闭容器中,若容器中气体(选填“密度”或“压强”)保持不变,说明该反应已达平衡状态。23. 普鲁卡因毒性较小,是临床常用的局部麻药之一。某兴趣小组以苯和乙烯为主要原料,采用以下路线合成:
请回答下列问题:
(1)、写出下列反应类型,反应①属于反应,反应②属于反应。写出化合物 B 的结构简式。(2)、已知: 试写出 E 中所含的你学习过的 1 个官能团的名称是: 并写出 C+D→E 反应的化学方程式: (3)、已知
试写出 E 中所含的你学习过的 1 个官能团的名称是: 并写出 C+D→E 反应的化学方程式: (3)、已知 与化合物 B 是同分异构体,且同时符合下列条件①②。写出同时符合下列条件的 B 的其它 3 个同分异 构体的结构简式。
与化合物 B 是同分异构体,且同时符合下列条件①②。写出同时符合下列条件的 B 的其它 3 个同分异 构体的结构简式。①分子中含有羧基 ②H—NMR谱显示分子中含有苯环,且苯环上有两种不同化学环境的氢原子
(4)、α-甲基苯乙烯(AMS) 与乙苯都属于烃类中的同一类别,该类别的名称是。 设计一条由 AMS 合成
与乙苯都属于烃类中的同一类别,该类别的名称是。 设计一条由 AMS 合成 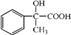 的合成路线:。
的合成路线:。 三、实验题
-
24. 无水MgBr2 可广泛用于有机反应催化剂、污水处理剂等。实验室可用镁屑与液溴为原料,采用下图装置制备无水MgBr2 , 请回答:
 (1)、识别下图中仪器。A的名称是 , B是(2)、实验时,可向装置C中缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。干燥的氮气能将液溴吹出,因为液溴具有的性质;实验中不能用干燥空气代替干燥N2 , 原因是:(3)、已知:Mg和Br2反应剧烈放热;乙醚(C2H5OC2H5)极易挥发。MgBr2和乙醚能发生如下反应:MgBr2+3C2H5OC2H5 MgBr2·3C2H5OC2H5+Q(Q>0);反应完毕后恢复至室温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品。第一次过滤除去的物质是。过滤必须用到的玻璃仪器是:。
(1)、识别下图中仪器。A的名称是 , B是(2)、实验时,可向装置C中缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。干燥的氮气能将液溴吹出,因为液溴具有的性质;实验中不能用干燥空气代替干燥N2 , 原因是:(3)、已知:Mg和Br2反应剧烈放热;乙醚(C2H5OC2H5)极易挥发。MgBr2和乙醚能发生如下反应:MgBr2+3C2H5OC2H5 MgBr2·3C2H5OC2H5+Q(Q>0);反应完毕后恢复至室温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品。第一次过滤除去的物质是。过滤必须用到的玻璃仪器是:。
(4)、试用平衡移动的原理说明得到三乙醚合溴化镁后,加热有利于其分解,得无水MgBr2产品的原因:(5)、为测定产品的纯度,可用EDTA(简写为Y4-)标准溶液滴定,反应的离子方程式:Mg2++Y4-=Mg Y2-①滴定前润洗滴定管的操作方法是
②测定前,先称取0.2500g无水MgBr2产品,溶解后,用0.0500mol/L的EDTA 标准溶液滴定至终点,消耗EDTA 标准溶液26.50mL,则测得无水MgBr2产品的纯度是 (以质量分数表示)。