上海市崇明区2017-2018学年高考化学二模考试试卷
试卷更新日期:2018-08-06 类型:高考模拟
一、单选题
-
1. 以下属于无机物的是( )A、四氯化碳 B、石墨 C、无水醋酸钠 D、天然橡胶2. 某微粒结构示意图:
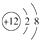 ,有关该微粒的叙述正确的是( ) A、中子数为10 B、带12个单位正电荷 C、电子式为Mg2+ D、最外层电子数为03. 下列化工生产没有涉及氧化还原反应的是( )
,有关该微粒的叙述正确的是( ) A、中子数为10 B、带12个单位正电荷 C、电子式为Mg2+ D、最外层电子数为03. 下列化工生产没有涉及氧化还原反应的是( )
A、工业合成氨 B、工业制纯碱 C、工业制烧碱 D、工业制盐酸4. 下列与化学键相关的叙述中正确的是( )A、含共价键的化合物一定是共价化合物 B、离子化合物中一定含有离子键 C、离子键是阴阳离子的静电吸引 D、极性键与非极性键无法共存5. 下列烃的衍生物可以发生加成反应的是( )A、乙醛 B、乙酸 C、乙醇 D、乙酸乙酯6. 生活中的下列应用,没有发生化学变化的是( )
A、氯气用作自来水的消毒剂 B、用醋酸除去热水瓶中水垢 C、二氧化硫用作纸浆漂白剂 D、活性炭用作卫生间除臭剂7. 少量金属钠投入下列试剂中,反应最缓慢的是( )
A、蒸馏水 B、0.1mol/L盐酸 C、0.1mol/L NaOH溶液 D、无水乙醇8. 下列气体能用浓硫酸干燥的是( )A、SO2 B、SO3 C、HI D、H2S9. 同一短周期元素X、Y、Z、W形成的最高价含氧酸的酸性依次增强,下列有关叙述正确的是( )
A、单质沸点:X<Y<Z<W B、气态氢化物的稳定性:X>Y>Z>W C、原子序数:X>Y>Z>W D、最高正价:X<Y<Z<W10. 下列各组内物质反应产生的气体分别通入FeSO4溶液中,能与FeSO4发生反应的是( )A、Na2O2和H2O B、Al和NaOH溶液 C、食盐和浓硫酸共热 D、铜片和浓硫酸共热11. 某学生配制0.2mol/L NaOH溶液时浓度偏小了,可能的原因是( )A、容量瓶中有残留水 B、称好的NaOH发生潮解 C、漏掉洗涤操作步骤 D、摇匀后液面低于刻度线12. 下列装置或原理能达到实验目的的是( )A、制取Cl2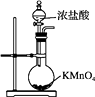 B、除去Cl2中的HCl
B、除去Cl2中的HCl  C、氯气的尾气处理
C、氯气的尾气处理 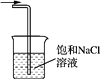 D、测氯水的pH
D、测氯水的pH  13. 有7瓶氯盐溶液,阳离子分别是Cu2+、Fe3+、Al3+、Mg2+、Fe2+、NH4+、Na+等离子的溶液,只用一种试剂即可鉴别,该试剂可能是( )A、KMnO4溶液 B、KSCN溶液 C、NaOH溶液 D、NH3 · H2O溶液14. 反应A(g) + 3B(g) ⇌2C(g) + 2D(g) 在四种不同情况下的反应速率分别为:① 、 ② 、 ③ 、④ ,该反应进行的快慢顺序为( )A、①>③=②>④ B、①>②=③>④ C、②>①=④>③ D、①>④>②=③15. 有些离子方程式能表示一类反应,有些离子方程式却只能表示一个反应。下列离子方程式中,只能表示一个化学反应的是( )A、OH-+HCO3-→CO32-+H2O B、Cl2 + H2O ⇌ H++Cl-+ HClO C、CO32-+2H+→CO2↑+H2O D、Ag++ Cl-→ AgCl↓16. 向如图所示装置中缓慢通入气体X,若打开活塞K,则品红溶液褪色;若关闭活塞K,则品红溶液无变化而澄清石灰水变浑浊。X和Y可能是( )
13. 有7瓶氯盐溶液,阳离子分别是Cu2+、Fe3+、Al3+、Mg2+、Fe2+、NH4+、Na+等离子的溶液,只用一种试剂即可鉴别,该试剂可能是( )A、KMnO4溶液 B、KSCN溶液 C、NaOH溶液 D、NH3 · H2O溶液14. 反应A(g) + 3B(g) ⇌2C(g) + 2D(g) 在四种不同情况下的反应速率分别为:① 、 ② 、 ③ 、④ ,该反应进行的快慢顺序为( )A、①>③=②>④ B、①>②=③>④ C、②>①=④>③ D、①>④>②=③15. 有些离子方程式能表示一类反应,有些离子方程式却只能表示一个反应。下列离子方程式中,只能表示一个化学反应的是( )A、OH-+HCO3-→CO32-+H2O B、Cl2 + H2O ⇌ H++Cl-+ HClO C、CO32-+2H+→CO2↑+H2O D、Ag++ Cl-→ AgCl↓16. 向如图所示装置中缓慢通入气体X,若打开活塞K,则品红溶液褪色;若关闭活塞K,则品红溶液无变化而澄清石灰水变浑浊。X和Y可能是( )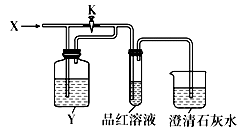
选项
A
B
C
D
X
SO2
Cl2
HCl
Cl2
Y
NaOH溶液
饱和NaHCO3溶液
饱和NaCl溶液
Na2SO3溶液
A、A B、B C、C D、D17. 下图是2SO3(g) ⇌ 2SO2(g) + O2(g) 的能量变化图,据图得出的相关叙述正确的是( )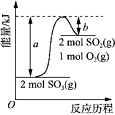 A、2SO3(g) ⇌ 2SO2(g) + O2(g) + (a-b) kJ B、1mol SO2的能量比1mol SO3的能量高 C、若有2mol SO3充分反应,吸收(a-b) kJ热量 D、该化学反应过程中的能量变化既有吸热又有放热18. 物质的量浓度均为0.1mol/L的盐酸和醋酸溶液,下列说法正确的是( )A、两溶液加入等质量的锌粉,产生氢气的速率相同 B、两溶液中氢氧根离子浓度均为 mol/L C、加入醋酸钠固体,二者的pH均增大 D、与氢氧化钠反应至中性时,二者消耗氢氧化钠的质量相同19. 如图装置中X和Y均为石墨电极,电解液为滴有酚酞的某浓度NaCl溶液,电解一段时间后,X极附近溶液先变红。下列有关说法中正确的是( )
A、2SO3(g) ⇌ 2SO2(g) + O2(g) + (a-b) kJ B、1mol SO2的能量比1mol SO3的能量高 C、若有2mol SO3充分反应,吸收(a-b) kJ热量 D、该化学反应过程中的能量变化既有吸热又有放热18. 物质的量浓度均为0.1mol/L的盐酸和醋酸溶液,下列说法正确的是( )A、两溶液加入等质量的锌粉,产生氢气的速率相同 B、两溶液中氢氧根离子浓度均为 mol/L C、加入醋酸钠固体,二者的pH均增大 D、与氢氧化钠反应至中性时,二者消耗氢氧化钠的质量相同19. 如图装置中X和Y均为石墨电极,电解液为滴有酚酞的某浓度NaCl溶液,电解一段时间后,X极附近溶液先变红。下列有关说法中正确的是( ) A、X极连接电源正极 B、X极上产生气体有刺激性气味 C、Y极上发生氧化反应 D、电子从X极经过溶液流向Y极20. 某种类型的心脏起搏器工作时发生下列反应:4Li+2SOCl2→4LiCl+S+SO2 , 下列有关判断正确的是(提示:SOCl2中S显 价)( )A、还原剂只有Li B、SOCl2既是氧化剂又是还原剂 C、还原产物包括LiCl和S D、生成1.12LSO2时,反应转移电子为0.2mol
A、X极连接电源正极 B、X极上产生气体有刺激性气味 C、Y极上发生氧化反应 D、电子从X极经过溶液流向Y极20. 某种类型的心脏起搏器工作时发生下列反应:4Li+2SOCl2→4LiCl+S+SO2 , 下列有关判断正确的是(提示:SOCl2中S显 价)( )A、还原剂只有Li B、SOCl2既是氧化剂又是还原剂 C、还原产物包括LiCl和S D、生成1.12LSO2时,反应转移电子为0.2mol二、综合题
-
21. X、Y、Z、R、M、N为六种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。
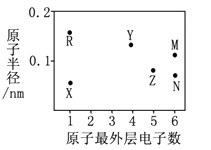 (1)、M元素的原子核外有种能量不同的电子,有个未成对电子;Z元素在元素周期表中的位置是第周期族。(2)、N、R、X三种元素的原子可构成一种强碱性物质,该物质的电子式是;Y元素的氧化物是制造光纤的主要材料,该氧化物是晶体(填晶体类型)。
(1)、M元素的原子核外有种能量不同的电子,有个未成对电子;Z元素在元素周期表中的位置是第周期族。(2)、N、R、X三种元素的原子可构成一种强碱性物质,该物质的电子式是;Y元素的氧化物是制造光纤的主要材料,该氧化物是晶体(填晶体类型)。某化工生产的核心环节的反应为:2MN2(g) + N2(g) ⇌ 2 MN3(g) + Q(Q>0)
(3)、该反应的平衡常数表达式K=;欲使K值变大,可采取的措施是。(4)、该反应达到平衡后,在其他条件不变的情况下,若使容器的体积扩大为原来的两倍,则平衡。(选填“正向移动”、“逆向移动”或“不移动”)22. NH4Al(SO4)2是常见的焙烤食品添加剂;NH4HSO4在医药、电子工业中用途广泛。请回答下列问题:(1)、相同条件下,0.1mol/L NH4Al(SO4)2中c(NH4+) (填“等于”“大于”或“小于”) 0.1mol/L NH4HSO4中c(NH4+)。0.1mol/L NH4Al(SO4)2溶液的pH随温度变化的曲线如图甲所示:
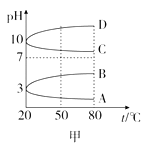 (2)、图甲中符合0.1mol/L NH4Al(SO4)2的pH随温度变化的曲线是(填字母)。(3)、向100mL 0.1mol/L NH4Al(SO4)2溶液中滴入90mL 0.5mol/L NaOH溶液,产生白色沉淀克。(4)、写出NH4HSO4溶液中滴加足量NaOH溶液的化学方程式;
(2)、图甲中符合0.1mol/L NH4Al(SO4)2的pH随温度变化的曲线是(填字母)。(3)、向100mL 0.1mol/L NH4Al(SO4)2溶液中滴入90mL 0.5mol/L NaOH溶液,产生白色沉淀克。(4)、写出NH4HSO4溶液中滴加足量NaOH溶液的化学方程式;25℃时,向100mL 0.1mol/L NH4HSO4溶液中滴加0.1mol/L NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图乙所示。
 (5)、试分析图乙中a、b、c、d四个点,水的电离程度最大的是。23. 杨梅醛是常用的水果型食用香精,其合成路线如下:
(5)、试分析图乙中a、b、c、d四个点,水的电离程度最大的是。23. 杨梅醛是常用的水果型食用香精,其合成路线如下:
已知:(CH3CO)2O是乙酸酐,也可写成
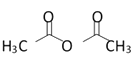 。
。请回答下列问题:
(1)、写出反应类型:①;③。(2)、写出反应②的化学方程式:。(3)、写出两种符合下列条件的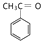 的同分异构体:。
的同分异构体:。i. 含有苯环 ii. 含有醛基:
(4)、以下是检验ClCH2COOH中氯元素的实验方案,请把它补充完整。取少量ClCH2COOH置于试管中, , 加热, , 滴加硝酸银溶液,观察是否产生白色沉淀。
(5)、根据上述合成路线,设计以CH3COOH和 为原料制备
为原料制备  的合成路线(其它试剂任选)。
的合成路线(其它试剂任选)。 三、实验题
-
24. 资料显示:久置于潮湿环境中的漂白粉受热生成O2和少量Cl2;干燥的漂白粉加热后发生反应Ca(ClO)2 CaCl2 + O2↑。
学生甲利用下图装置进行实验:加热A中试管内装有的潮湿漂白粉样品时,观察到B中有大量气泡产生。
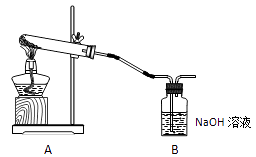 (1)、B中发生反应的离子方程式为。(2)、请写出实验室检验氯气的方法:。
(1)、B中发生反应的离子方程式为。(2)、请写出实验室检验氯气的方法:。学生乙设计实验测定某干燥漂白粉样品中次氯酸钙的百分含量。实验步骤如下:
①称量坩埚的质量,为W1g。
②坩埚中加入样品后再称,质量为W2g。
③重复进行加热、冷却、称量,直到恒重,质量为W3g。
(3)、称量所用仪器名称为;实验到达恒重的判断依据是。(4)、该漂白粉样品中次氯酸钙的百分含量为(用W1、W2、W3表示);若所用坩埚内壁沾有受热易分解的物质,则该实验测得的结果。(选填“偏大”、“偏小”或“无影响”)