山东省临沂市2017-2018学年高考理综-化学三模考试试卷
试卷更新日期:2018-08-06 类型:高考模拟
一、单选题
-
1. 中国传统文化对人类文明贡献巨大,古代文献中记载了很多化学研究成果。下列常见古诗文对应化学知识正确的是( )
 A、A B、B C、C D、D2. 环丙叉环丙烷(b)由于其特殊的结构,一直受到结构和理论化学家的注意,根据其转化关系,下列说法正确的是( )
A、A B、B C、C D、D2. 环丙叉环丙烷(b)由于其特殊的结构,一直受到结构和理论化学家的注意,根据其转化关系,下列说法正确的是( ) A、b的所有原子都在一个平面内 B、p在氢氧化钠的乙醇溶液中加热生成烯烃 C、m的同分异构体中属于芳香族化合物的共有5种 D、反应①是加成反应,反应②是消去反应3. 短周期主族元素X、Y、Z、W的原子半径依次增大,且原子最外层电子数之和为15,Y是地壳中含量最高的元素,Y与Z同主族,Z与W同周期。下列说法正确的是( )A、简单氢化物的还原性:Y>Z B、Z的简单离子与W的具有相同的电子层结构 C、化合物WX2中既存在离子键,又存在共价键 D、X与Y形成的化合物可能使酸性KMnO4溶液褪色4. 根据下列实验能得出相应结论的是( )
A、b的所有原子都在一个平面内 B、p在氢氧化钠的乙醇溶液中加热生成烯烃 C、m的同分异构体中属于芳香族化合物的共有5种 D、反应①是加成反应,反应②是消去反应3. 短周期主族元素X、Y、Z、W的原子半径依次增大,且原子最外层电子数之和为15,Y是地壳中含量最高的元素,Y与Z同主族,Z与W同周期。下列说法正确的是( )A、简单氢化物的还原性:Y>Z B、Z的简单离子与W的具有相同的电子层结构 C、化合物WX2中既存在离子键,又存在共价键 D、X与Y形成的化合物可能使酸性KMnO4溶液褪色4. 根据下列实验能得出相应结论的是( ) A、A B、B C、C D、D5. 电解NaB(OH)4溶液制备H3BO3的原理如下图所示,下列叙述错误的是( )
A、A B、B C、C D、D5. 电解NaB(OH)4溶液制备H3BO3的原理如下图所示,下列叙述错误的是( ) A、M室发生的电极反应式:2H2O-4e-=O2↑+4H+ B、a、c为阴离子交换膜,b为阳离子交换膜 C、N室中:a%<b% D、理论上每生成1 mol H3BO3 , 两极室共产生标准状况下16.8 L气体6. 某实验小组将SO2通入Na2S和Na2SO3的混合溶液中制备硫代硫酸钠(Na2S2O3)。其装置如下图所示(省略夹持装置),下列说法错误的是( )
A、M室发生的电极反应式:2H2O-4e-=O2↑+4H+ B、a、c为阴离子交换膜,b为阳离子交换膜 C、N室中:a%<b% D、理论上每生成1 mol H3BO3 , 两极室共产生标准状况下16.8 L气体6. 某实验小组将SO2通入Na2S和Na2SO3的混合溶液中制备硫代硫酸钠(Na2S2O3)。其装置如下图所示(省略夹持装置),下列说法错误的是( ) A、装置②的作用之一是观察SO2的生成速率,其中的液体可以是饱和NaHSO3溶液 B、为提高产品纯度,使烧瓶中Na2S和Na2SO3恰好完全反应,则 C、装置④的作用是吸收尾气,同时防止倒吸 D、装置①也可用于高锰酸钾与浓盐酸反应制备氯气7. 已知电导率越大导电能力越强。常温下用0.100 mol·L-1NaOH溶液分别滴定10.00mL浓度均为0.100 mol·L-1的盐酸和醋酸溶液,测得滴定过程中溶液的电导率如图所示。下列说法正确的是( )
A、装置②的作用之一是观察SO2的生成速率,其中的液体可以是饱和NaHSO3溶液 B、为提高产品纯度,使烧瓶中Na2S和Na2SO3恰好完全反应,则 C、装置④的作用是吸收尾气,同时防止倒吸 D、装置①也可用于高锰酸钾与浓盐酸反应制备氯气7. 已知电导率越大导电能力越强。常温下用0.100 mol·L-1NaOH溶液分别滴定10.00mL浓度均为0.100 mol·L-1的盐酸和醋酸溶液,测得滴定过程中溶液的电导率如图所示。下列说法正确的是( ) A、曲线①代表滴定盐酸的曲线 B、滴定醋酸的过程应该选择甲基橙作为指示剂 C、a、b、c三点溶液中水的电离程度:c>a>b D、b点溶液中:c(OH-)>c(H+)+c(CH3COO-)+c(CH3COOH)
A、曲线①代表滴定盐酸的曲线 B、滴定醋酸的过程应该选择甲基橙作为指示剂 C、a、b、c三点溶液中水的电离程度:c>a>b D、b点溶液中:c(OH-)>c(H+)+c(CH3COO-)+c(CH3COOH)二、实验题
-
8. 亚氯酸钠(NaClO2)是一种高效的漂白剂和水处理剂。以氯酸钠为原料制备亚氯酸钠的装置如下图所示(夹持装置省略)。

已知:
①纯ClO2易分解爆炸,空气中ClO2的体积分数在10%以下比较安全。
②NaClO2饱和溶液在温度低于38℃时析出晶体NaClO2·3H2O;高于38℃时析出NaClO2;高于60℃时NaClO2分解成NaClO3和NaCl。
(1)、检查A装置气密性的方法是。该装置中产生ClO2的化学方程式为。(2)、实验过程中需要持续通入空气,目的是。(3)、NaClO2在碱性溶液中才能稳定存在,下列可用于检测三颈瓶中溶液酸碱性的是(填代号)。a.石蕊
b.酚酞
c.pH试纸
d.pH计
(4)、B装置中发生反应的离子方程式为;使用冰水浴的原因是;反应结束后,从溶液中得到NaClO2固体的实验操作是。(5)、NaClO2是一种高效水处理剂,在一定条件下可以将CN-氧化成两种无毒无害的气体。现用NaClO2处理10m3含CN-a mg·L-1的工业污水,理论上至少需要NaClO2的质量是g。三、综合题
-
9. 氮及其化合物与人类生产、生活密切相关。(1)、氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。
已知:CO(g)+NO2(g)=NO(g)+CO2(g) △H=-a kJ·mol-1(a>0)
2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-b kJ·mol-1(b>0)
若用CO还原NO2至N2 , 当消耗标准状况下3.36L CO时,放出的热量为kJ(用含有a和b的代数式表示)。
(2)、在373K时,向体积为2L的恒容真空容器中通入0.40 mol NO2 , 发生反应:2NO2(g) N2O4(g) △H=-57.0 kJ·mol-1。测得NO2的体积分数[ (NO2)]与反应时间(t)的关系如下表:
①0~20 min内,v(N2O4)=mol·L-1·min-1。
②上述反应中,v(NO2)=k1·c2(NO2),v(N2O4)=k2·c(N2O4),其中k1、k2为速率常数,则373K时,k1、k2的数学关系式为。改变温度至T1时k1=k2 , 则T1373K(填“>”、“<”或“=”)。
(3)、连二次硝酸(H2N2O2)是一种二元弱酸。25℃时,向100 mL 0.1 mol·L-1H2N2O2溶液中加入V mL 0.1mol·L-1 NaOH溶液。(已知25℃时,连二次硝酸的Ka1=10-7 , Ka2=10-12)①若V=100,则所得溶液中c(H2N2O2)c(N2O22-) (填“>”、“<”或“=”),通过计算解释原因。
②若V=200,则所得溶液中离子浓度由大到小的顺序为。
10. 工业上利用废镍催化剂(主要成分为Ni,还含有一定量的Zn、Fe、SiO2、CaO等)制备草酸镍晶体的流程如下: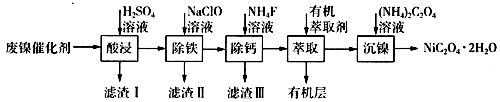 (1)、请写出一种能提高“酸浸”速率的措施:;滤渣I的成分是(填化学式)。(2)、除铁时,控制不同的条件可以得到不同的滤渣II。已知滤渣II的成分与温度、pH的关系如图所示:
(1)、请写出一种能提高“酸浸”速率的措施:;滤渣I的成分是(填化学式)。(2)、除铁时,控制不同的条件可以得到不同的滤渣II。已知滤渣II的成分与温度、pH的关系如图所示:
①若控制温度40℃、pH=8,则滤渣II的主要成分为(填化学式)。
②若控制温度80℃、pH=2,可得到黄铁矾钠[Na2Fe6(SO4)4(OH)12](图中阴影部分),写出生成黄铁矾钠的离子方程式:。
(3)、已知除铁后所得100 mL溶液中c(Ca2+)=0.01mol·L-1 , 加入100 mL NH4F溶液,使Ca2+恰好沉淀完全即溶液中c(Ca2+)=1×10-5 mol·L-1 , 则所加c(NH4F)=mol·L-1。[已知Ksp(CaF2)=5.29×10-9](4)、加入有机萃取剂的作用是。(5)、某化学镀镍试剂的化学式为MxNi(SO4)y(M为+1价阳离子,Ni为+2价,x、y均为正整数)。为测定该镀镍试剂的组成,进行如下实验:I.称量28.7g镀镍试剂,配制100 mL溶液A;
Ⅱ.准确量取10.00 mL溶液A,用0.40 mol·L-1的EDTA(Na2H2Y)标准溶液滴定其中的Ni2+(离子方程式为Ni2++H2Y2-=NiY2-+2H+),消耗EDTA标准溶液25.00mL;
Ⅲ.另取10.00 mL溶液A,加入足量的BaCl2溶液,得到白色沉淀4.66g。
①配制100 mL镀镍试剂时,需要的仪器除药匙、托盘天平、玻璃棒、烧杯、量筒、胶头滴管外,还需要。
②该镀镍试剂的化学式为。
11. 钛及其化合物在化工、医药、材料等领域有着广泛的应用。(1)、基态钛原子的价电子排布式为 , 与钛同周期的元素中,基态原子的未成对电子数与钛相同的有种。(2)、钛比钢轻、比铝硬,是一种新兴的结构材料,钛的硬度比铝大的原因是。(3)、在浓的TiCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为TiCl3·6H2O的绿色晶体,该晶体中两种配体的物质的量之比为1:5,则该配合离子的化学式为。(4)、半夹心结构催化剂M能催化乙烯、丙烯、苯乙烯的聚合,其结构如下图所示。
①组成M的元素中,电负性最大的是(填名称)。
②M中碳原子的杂化方式为。
③M中不含(填代号)。
a.π键
b.σ键
c.离子键
d.配位键
(5)、金红石(TiO2)是含钛的主要矿物之一。其晶胞结构(晶胞中相同位置的原子相同)如图所示。
①A、B、C、D 4种微粒,其中氧原子是(填代号)。
②若A、B、C的原子坐标分别为A(0,0,0)、B(0.69a,0.69a,c)、C(a,a,c),则D的原子坐标为D(0.19a, , );钛氧键的键长d=(用代数式表示)。
12. 以C2H2为原料合成环丁烯类化合物L的路线如下: (1)、A由碳、氢、氧三种元素组成,相对分子质量是30,则A的名称为。(2)、B分子中的碳原子都在同一直线上,B的结构简式为。(3)、C→D、J→K的反应类型分别为、。(4)、设计C→D、E→F两步反应的目的是。(5)、G和H生成I的化学方程式为。(6)、化合物X是I的同分异构体,可与FeCl3溶液发生显色反应,且能与NaHCO3溶液反应放出CO2 , X共有种(不考虑立体异构);其中核磁共振氢谱为五组峰,峰面积比为2:2:2:1:1的结构简式为。(7)、写出用
(1)、A由碳、氢、氧三种元素组成,相对分子质量是30,则A的名称为。(2)、B分子中的碳原子都在同一直线上,B的结构简式为。(3)、C→D、J→K的反应类型分别为、。(4)、设计C→D、E→F两步反应的目的是。(5)、G和H生成I的化学方程式为。(6)、化合物X是I的同分异构体,可与FeCl3溶液发生显色反应,且能与NaHCO3溶液反应放出CO2 , X共有种(不考虑立体异构);其中核磁共振氢谱为五组峰,峰面积比为2:2:2:1:1的结构简式为。(7)、写出用 和乙炔为原料制备
和乙炔为原料制备  的合成路线(其他试剂任选)。
的合成路线(其他试剂任选)。
-